Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 10: Sistemas Coloidales
- Módulo 10: Sistemas Coloidales
Módulo 10: Sistemas Coloidales

En tercer año de ciclo básico trabajaste la clasificación de los sistemas en heterogéneos y homogéneos, según el número de fases presentes. Profundizaremos al respecto, y veremos que no todo es lo que parece.
¿QUÉ TIENEN EN COMÚN LA GELATINA, LA MAYONESA Y UN HELADO?

Comencemos retomando algunos conceptos (solución y suspensión) y analizando uno nuevo (coloide).
Como ya has trabajado una solución es un tipo de sistema homogéneo formado por dos o más componentes, una suspensión es un tipo de sistema heterogéneo formado por dos o más fases, y los sistemas coloidales son sistemas intermedios, que a simple vista parecen homogéneos pero si los observamos con un ultramicroscopio notamos que no lo son.
A continuación analizamos algunas propiedades de cada tipo de sistemas.
- SOLUCIÓN: mezcla homogénea donde las partículas dispersas no pueden filtrarse ni sedimentan. Es posible obtener estos componentes mediante algún método de fraccionamiento como destilación, cristalización o cromatografía. Las partículas no son visibles a simple vista ni siquiera usando un microscopio o un ultramicroscopio. Tamaño de partícula: 1 a 10 Å. Recuerda que 1 Å ångström corresponde a 1x10-10 m
- SUSPENSIÓN: mezcla heterogénea donde las partículas dispersas sedimentan y pueden filtrarse. Las partículas de la fase dispersa son visibles a simple vista. Ejemplo: arena en agua, algunos medicamentos y cosméticos donde la fase dispersa se deposita en el fondo del recipiente y es necesario agitarlos antes de usar. Tamaño de partícula: mayor de 10 000 Å.
- DISPERSIONES COLOIDALES O COLOIDES: tipo intermedia de mezcla en el que las partículas con apariencia de soluto, o fase dispersa, se suspenden en la fase con apariencia de solvente, fase continua o dispersante. Las partículas tienen un tamaño intermedio entre las microscópicas y visibles. No son filtrables ya que las partículas traspasan los filtros. Las partículas de la fase dispersa son muy pequeñas, solo visibles con un ultramicroscopio y en algunos casos con un microscopio. Tamaño de partícula: 10 a 10 000 Å.
Están en la “línea divisoria” entre los sistemas homogéneos y las mezclas heterogéneas, es decir entre las soluciones verdaderas y las suspensiones; se ven homogéneos y la fase dispersa no sedimenta, pero al ser observados al microscopio su aspecto es de dos o más fases como las suspensiones.
Los coloides o sistemas coloidales pueden formarse por cualquier combinación entre sólidos, líquidos y gases, excepto la combinación gas-gas que siempre constituye una solución.
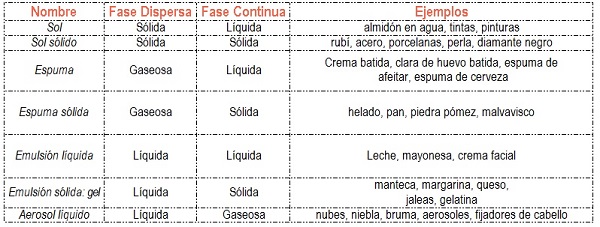
Material extraído y adaptado de: Whitten, K., Davis, R. y Peck. M. (1998). Química General. (5ta edición). Madrid, España: Mc Graw Hill y Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012) Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
- SOLUCIÓN: mezcla homogénea donde las partículas dispersas no pueden filtrarse ni sedimentan. Es posible obtener estos componentes mediante algún método de fraccionamiento como destilación, cristalización o cromatografía. Las partículas no son visibles a simple vista ni siquiera usando un microscopio o un ultramicroscopio. Tamaño de partícula: 1 a 10 Å. Recuerda que 1 Å ångström corresponde a 1x10-10 m
Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
