Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 14: Ecuaciones Químicas
- Módulo 14: Ecuaciones Químicas
Módulo 14: Ecuaciones Químicas

Comenzando...
En el curso de tercer año de Química aprendiste que podemos clasificar los cambios que ocurren constantemente a nuestro alrededor como físicos o químicos. Los cambios físicos son aquellas transformaciones en las que la composición de la materia no se modifica, por ejemplo cuando colocas agua en el congelador, se transforma en hielo pero sigue siendo agua (fórmula química: H2O). Por el contrario cuando ocurren cambios químicos se modifica la composición de la materia. Un ejemplo de un cambio químico es cuando cocinas una torta de chocolate.

Formas de representar la materia y sus interacciones:
- Nivel macroscópico: Cuando ocurre un cambio químico se forman nuevas sustancias. Llamamos reactivos a las sustancias presentes inicialmente en el sistema y productos a las sustancias que se obtienen luego de la transformación. En un sistema cerrado, al ocurrir el cambio, la masa del sistema se conserva.
Por ejemplo, si reaccionan gas dicloro y sodio metálico, se forma cloruro de sodio. Como podrás ver a continuación al agregar una gota de agua comienza la reacción, y luego de la explosión se observa un polvo de color blanco.
- Nivel ultra microscópico: Al ocurrir una reacción química se rompen unos enlaces químicos y se forman otros nuevos. Los átomos de los elementos que intervienen se reordenan dando lugar a la formación de nuevas sustancias, es decir, los reactivos y los productos están formados por los mismos elementos.
En el caso de la formación de cloruro de sodio, se rompe el enlace metálico que une a las partículas del sodio, también se rompe el enlace covalente que mantiene unidos a los átomos de cloro (formando la molécula de dicloro). Y se forma un enlace iónico (o unión iónica) entre las partículas de sodio y cloro formando el compuesto cloruro de sodio,
- Nivel simbólico: Podemos simbolizar una reacción química a través de una ecuación. En las ecuaciones químicas se representa a cada sustancia con su fórmula correspondiente y se indica el estado de agregación en que se encuentra cada sustancia (sólido, líquido, gas, vapor, acuoso).
Podemos representar la reacción entre el dicloro y el sodio metálico de la siguiente manera:
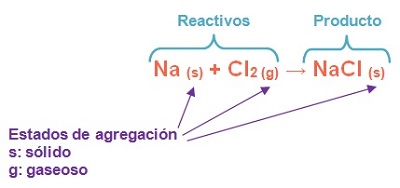
La expresión anterior se puede leer de la siguiente forma; el sodio metálico sólido y (+) el dicloro gaseoso reaccionan para formar (→) cloruro de sodio sólido.
Para expresar la igualdad del número de átomos de todos los elementos que intervienen debemos "balancear" o "igualar" la expresión anterior. Observamos que el número de átomos de cloro en los reactivos es 2 y en el producto es 1. Para balancear debemos colocar números delante de las fórmulas químicas (nunca en el medio o al final de las mismas porque cambiaríamos dichas fórmulas) hasta lograr la igualdad. Colocamos un 2 delante de la fórmula del cloruro de sodio (NaCl) y revisamos
Na + Cl2 → 2 NaCl
Ahora debemos igualar el número de átomos de sodio. Colocamos un 2 delante de la fórmula del sodio metálico (Na) y revisamos nuevamente.
2 Na + Cl2 → 2 NaCl
Lista la igualación o balanceo.
Este método para balancear las expresiones se conoce como MÉTODO POR TANTEO. Se utiliza para expresiones sencillas.
Para aplicarlo primero debes chequear el número de átomos de cada elemento. Si el número de los átomos de todos los elementos coincide, la expresión ya está balanceada.
De lo contrario, comenzamos por el elemento que se encuentre con diferencia, le ubicamos un número delante (recuerda que el número que utilices multiplicará al subíndice, si lo hay) para igualar el número de átomos del mismo.
Luego que hayamos balanceado correctamente el número de átomos de dicho elemento, debemos chequear los demás elementos químicos hasta asegurarnos que todos están correctamente balanceados.
- Nivel macroscópico: Cuando ocurre un cambio químico se forman nuevas sustancias. Llamamos reactivos a las sustancias presentes inicialmente en el sistema y productos a las sustancias que se obtienen luego de la transformación. En un sistema cerrado, al ocurrir el cambio, la masa del sistema se conserva.
Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
