Química - 3º B.D.
Actividad 1: Laboratorio Virtual Ley de Hess
![]()
En este experimento se determinará y comparará la entalpía de tres cambios exotérmicos.
Cambio 1: El hidróxido de sodio se disuelve en agua formando una solución acuosa.
NaOH(s) → Na+(ac) + OH-(ac) + QP1 kJ
Cambio 2: El hidróxido de sodio sólido reacciona con una solución de ácido clorhídrico formándose agua y una solución que contiene cloruro de sodio.
NaOH(s)
+ H+(ac) + Cl-(ac) → H2O(l)
+ Na+(ac) + Cl-(ac) + QP2
kJ
Cambio 3: Una solución de hidróxido de sodio reacciona con una solución de ácido clorhídrico formándose agua y una solución que contiene cloruro de sodio.
Na+(ac) + OH-(ac) + H+(ac) + Cl-(ac) → H2O(l) + Na+(ac) + Cl-(ac) + QP3 kJ
Para determinar el calor liberado a presión constante (QP) en cada cambio se utilizará un vaso de espuma como calorímetro.
La variación en la temperatura que ocurre en cada cambio será utilizada para calcular la energía liberada (expresada en kJ/mol de hidróxido de sodio usado). El calor absorbido por el calorímetro será despreciado y el valor de calor específico del agua a utilizar será 4,18 J/g ºC.
![]()
Accede al simulador en línea en el siguiente enlace.
Cambio 1
- En el menú Glassware, selecciona una probeta de 50,0 mL (en Graduated Cylinders) y un vaso de espuma (en Other: Foam Cup) que oficiará como calorímetro.
- En el menú Tools, selecciona una balanza (Scale).
- En el menú Solutions, selecciona agua destilada (Distilled water) e hidróxido de sodio sólido (Solid NaOH).
- Todo irá apareciendo en el área de trabajo (Workbench).
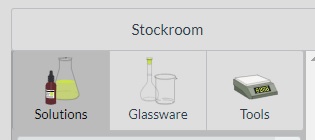
Menú del simulador
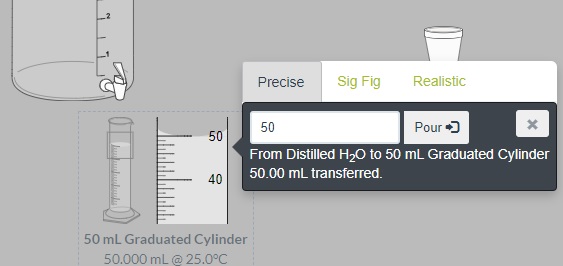
- Transfiere 50,0 mL de agua destilada al vaso de espuma. Para ello, arrastra el recipiente que contiene el agua destilada hasta la probeta de 50,0 mL, cuando se encuentre en la posición correcta se desplegará un menú como el que se observa en la siguiente imagen, escribe 50 y luego oprime la tecla Pour. Notarás que la probeta tendrá 50,0 mL de agua. Luego haz clic en la X para cerrar dicho menú.
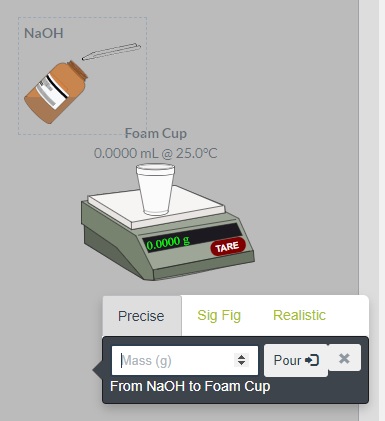
- Mide 1,00 g de hidróxido de sodio dentro del vaso de espuma. Arrastra el vaso vacío sobre la balanza. Haz clic en el botón para tarar (Tare). Lleva el frasco que contiene NaOH sobre el vaso y se desplegará un menú como el que se ve en la siguiente imagen. Escribe la masa indicada y oprime el botón Pour. Luego retira el vaso de espuma de la balanza y colócalo en el área de trabajo.
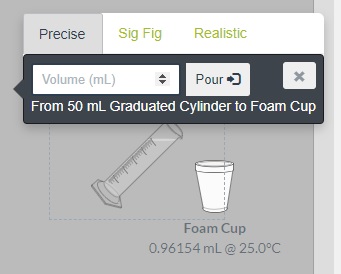
- Haz clic en la probeta y registra el valor de temperatura del agua en su interior. Arrastra la probeta hasta el vaso de espuma. En el menú que se despliega escribe 50,0 mL y luego oprime Pour para colocar el agua dentro del vaso de espuma junto con el NaOH sólido. Registra la temperatura más alta alcanzada en el vaso de espuma.
Recuerda que si deseas quitar algún material del área de trabajo, debes hacer clic derecho sobre el material y seleccionar Remove (remover).
Cambio 2
- Toma el ácido clorhídrico HCl 0,5 M (mol/L) de la sección Strong Acids en Solutions, un vaso de espuma y una probeta de 50,0 mL y colócalos en el área de trabajo. El procedimiento es el mismo que el realizado en el cambio 1 excepto que en vez de utilizar 50,0 mL del agua destilada se utilizarán 50,0 mL de HCl 0,5 mol/L.
- Registra la temperatura más alta alcanzada en el vaso de espuma.
Cambio 3
- Toma dos nuevas probetas de 25,0 mL, un nuevo vaso de espuma, HCl 1,0 mol/L de la sección Strong Acids y NaOH 1,0 mol/L de la sección Strong Bases.
- Mide 25,0 mL de solución de HCl con una probeta limpia y agrégalos al nuevo vaso de espuma. Registra la temperatura inicial del HCl.
- Mide 25,0 mL de solución de NaOH con la otra probeta limpia y agrégalos al vaso de espuma.
- Registra la temperatura más alta alcanzada en el vaso de espuma.
![]()
- Diseña y completa una tabla que contenga los siguientes datos: cambio, masa de NaOH, temperatura inicial, temperatura final, QP liberado, cantidad química de NaOH y ΔH molar del cambio. Incluye los datos obtenidos así como los cálculos realizados.
- Escribe las ecuaciones que representan los cambios 1, 2 y 3 completando los valores de H1, H2 y H3.
- Aplica la ley de Hess para obtener H3 y compáralo con el valor obtenido experimentalmente.
- Imagina que se utilizan 4,00 g de NaOH sólido en el cambio 1, ¿cuál es la energía (expresada en Joules) liberada en la reacción? ¿Qué efecto tiene esto en el valor de H1?
![]()
- Incluye una explicación a los resultados obtenidos en la sección tratamiento de datos.
- Repasa la ley de Hess e indica cómo esta actividad experimental se relaciona con dicha ley.
- Si quisieras repetir este experimento en el laboratorio de tu centro educativo, ¿cuáles serían las mayores fuentes de error experimental que tendrías?
![]()
Escribe un informe breve que incluya:
- el tratamiento de datos,
- la discusión y
- la conclusión a la que llegas luego de trabajar con el simulador.
Actividad traducida de: ChemCollective. (2010). Heats of Reaction - Hess' Law Info. Recuperado de: http://chemcollective.org/activities/info/138
