Saponificación
1. Surfactantes
Surfactantes o detergentes
Las manchas y pegotes de grasa no pueden eliminarse con agua. El agua es una sustancia polar y sus moléculas interactúan entre sí mediante enlaces o puentes de hidrógeno. Las grasas y aceites son no polares e interactúan entre sí mediante fuerzas de Van der Waals. Para lograr que sustancias tan diferentes interactúen en forma cruzada, es necesario utilizar sustancias mediadoras conocidas como detergentes o surfactantes. Se trata de moléculas que presentan una “cabeza” polar (o iónica) y una “cola” no polar. La “cola” interactúa mediante fuerzas de Van der Waals con las moléculas no polares de grasa, mientras la “cabeza” lo hace, mediante enlaces de hidrógeno, con el agua.
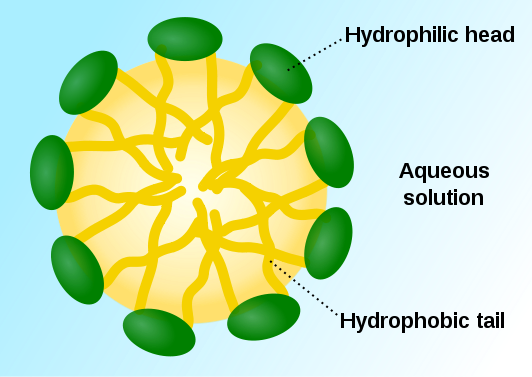
Las colas no polares (en amarillo) de las moléculas de un detergente, se mezclan con la grasa mientras que las cabezas polares (en verde), se mezclan con el agua. Así la grasa es forzada a interactuar con el agua a través de una sustancia intermediaria
Existen
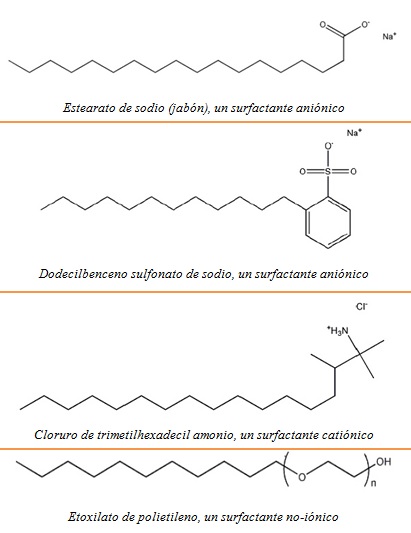
esencialmente tres tipos de surfactantes: aniónicos, catiónicos y no-iónicos.
- Los
surfactantes aniónicos tienen una cabeza cargada negativamente. Los
tipos más comunes son los jabones y los alquil-benceno sulfonatos.
- Los surfactantes
catiónicos tienen una cabeza cargada positivamente. Los más comunes son los
cloruros de alquil amonio.
Los surfactantes no iónicos tienen una cabeza polar pero carente de carga eléctrica neta. Un ejemplo es el de los etoxilatos de polietileno.
Cuando se disuelven en agua, las moléculas de los surfactantes suelen agruparse en la superficie (de ahí el nombre); así, las colas no polares se colocan fuera del agua. Las moléculas de surfactante pueden formar agrupamientos llamados micelas: estas son pequeñas esferas formadas por el surfactante que atrapan a las moléculas de grasa permitiendo su dispersión en agua.