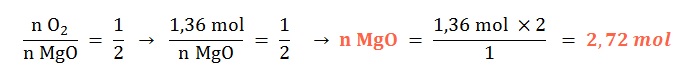Material de lectura
1. Repasando algunos conceptos base
1.4. Proporciones molares y cálculos sencillos
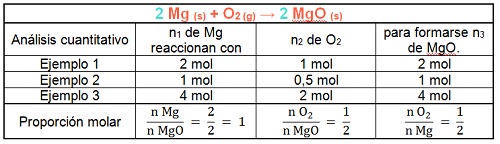
Como puedes observar en el siguiente cuadro, las proporciones en que se combinan los reactivos (Mg y O2) y se forma el producto (MgO) no varían.
- Ejemplo 1
Se tienen 3,50 mol de magnesio sólido, ¿con qué cantidad química de dioxígeno reaccionará al ocurrir su combustión?
Planteo:
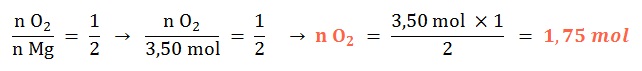
- Ejemplo 2
Se tienen 1,33 mol de dioxígeno gaseoso, ¿con qué cantidad química de magnesio sólido reaccionará al ocurrir su combustión?
Planteo:
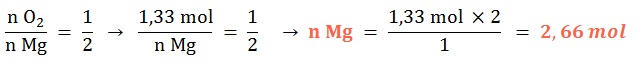
- Ejemplo 3
Si reaccionan 8,62 mol de magnesio sólido ¿qué cantidad química de óxido de magnesio sólido se formará?
Planteo:
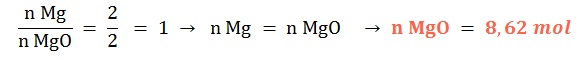
- Ejemplo 4
Si reaccionan 5,31 mol de dioxígeno gaseoso ¿qué cantidad química de óxido de magnesio sólido se formará?
Planteo:
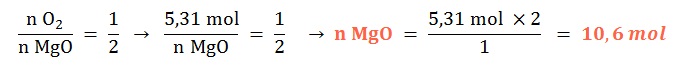
- Ejemplo 5
Si reaccionan 43,5 g de dioxígeno gaseoso ¿qué cantidad química de óxido de magnesio sólido se formará?
Planteo:
Primeramente calcularemos a qué cantidad química de dioxígeno se corresponden esos 43,5 g.

Y luego realizamos el cálculo tomando en cuenta la proporción molar: