Material de lectura
3. Interpretación de las transferencias de energía: entalpía
3.5. Ley de Hess
“La entalpía de la reacción global es la suma de las entalpías de los pasos de la reacción en que la reacción puede ser dividida” o “cuando los reactivos se convierten en productos, el cambio de entalpía es el mismo independientemente de que se efectúe la reacción en un paso o en una serie de pasos”.
Se aplica aún cuando las reacciones intermedias o la reacción global realmente no puedan llevarse a cabo.
Se utiliza para predecir las entalpías de reacciones que no se pueden medir directamente en el laboratorio, la reacción es muy lenta, o suceden reacciones secundarias que producen otras sustancias además del compuesto de interés.
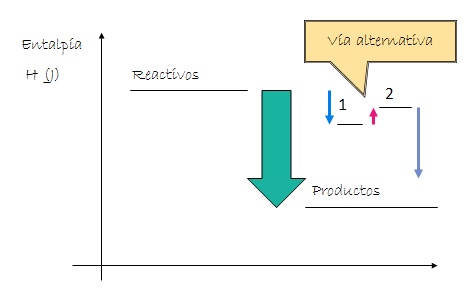

El calor liberado o absorbido a presión constante (entalpía) en una transformación química depende únicamente de cuál es la situación de partida y cuál es la situación final del sistema y no depende del camino seguido durante el proceso.
Si ciertos reactivos se convierten en determinados productos (en las mismas condiciones), la variación de entalpía tiene el mismo valor independientemente que el proceso se realice en uno o varios pasos.
Por ejemplo, la variación de la entalpía del proceso de obtención de dióxido de carbono a partir de carbono grafito y dioxígeno gaseoso tiene el mismo valor ya sea que la transformación tenga lugar en una etapa o en dos etapas.
- Proceso en una etapa:
C (grafito) + O2 (g) → CO2 (g) ∆H1 = - 393 kJ/mol
- Proceso en dos etapas:
C (grafito) + 1/2 O2 (g) → CO (g) ∆H2 = - 111 kJ/mol
CO (g) + 1/2 O2 (g) → CO2 (g) ∆H3 = - 282 kJ/mol
Entonces:
∆H1 = ∆H2 + ∆H3
- 393 kJ/mol = - 111 kJ/mol + ( - 282 kJ/mol)
Si se parte de carbono grafito y dioxígeno gaseoso y se obtiene dióxido de carbono gaseoso el calor liberado a presión constante es 393 kJ/mol, no importa si se forma directamente el dióxido de carbono, o si en una primera etapa se obtiene monóxido de carbono (CO) y este luego reacciona con más dioxígeno produciéndose dióxido de carbono gaseoso.