Material de lectura
1. Equilibrio químico
1.4. Evolución de un sistema hacia el equilibrio
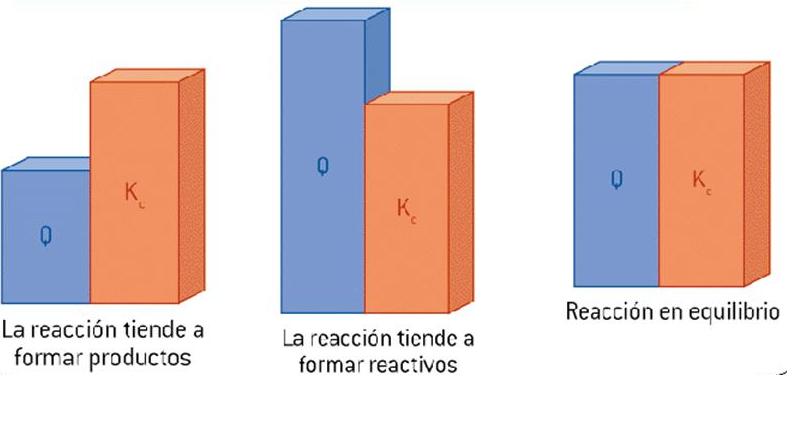
No es suficiente que en un sistema coexistan reactivos y productos para que se encuentre en equilibrio. Esto ocurre si las concentraciones de ambos corresponden a las del equilibrio a esa temperatura. Para evaluar esto definimos Q como la relación entre las concentraciones en cualquier instante.
- Si Q
coincide con K el
sistema alcanzó el equilibrio.
- Si Q <
K, la
concentración de los productos es menor que la que corresponde al valor de
dicha concentración en el equilibrio, a la misma temperatura, y el sistema
evolucionará hacia la formación
de productos.
- Si Q >
K se
da la situación inversa y se descompondrá
parte del producto para
formar reactivo.
Observa el siguiente vídeo: