¿Qué son la entropía y la energía libre?
3. ¿Qué es la energía libre?
3.1. ¿Qué es la energía libre de reacción?
![]()
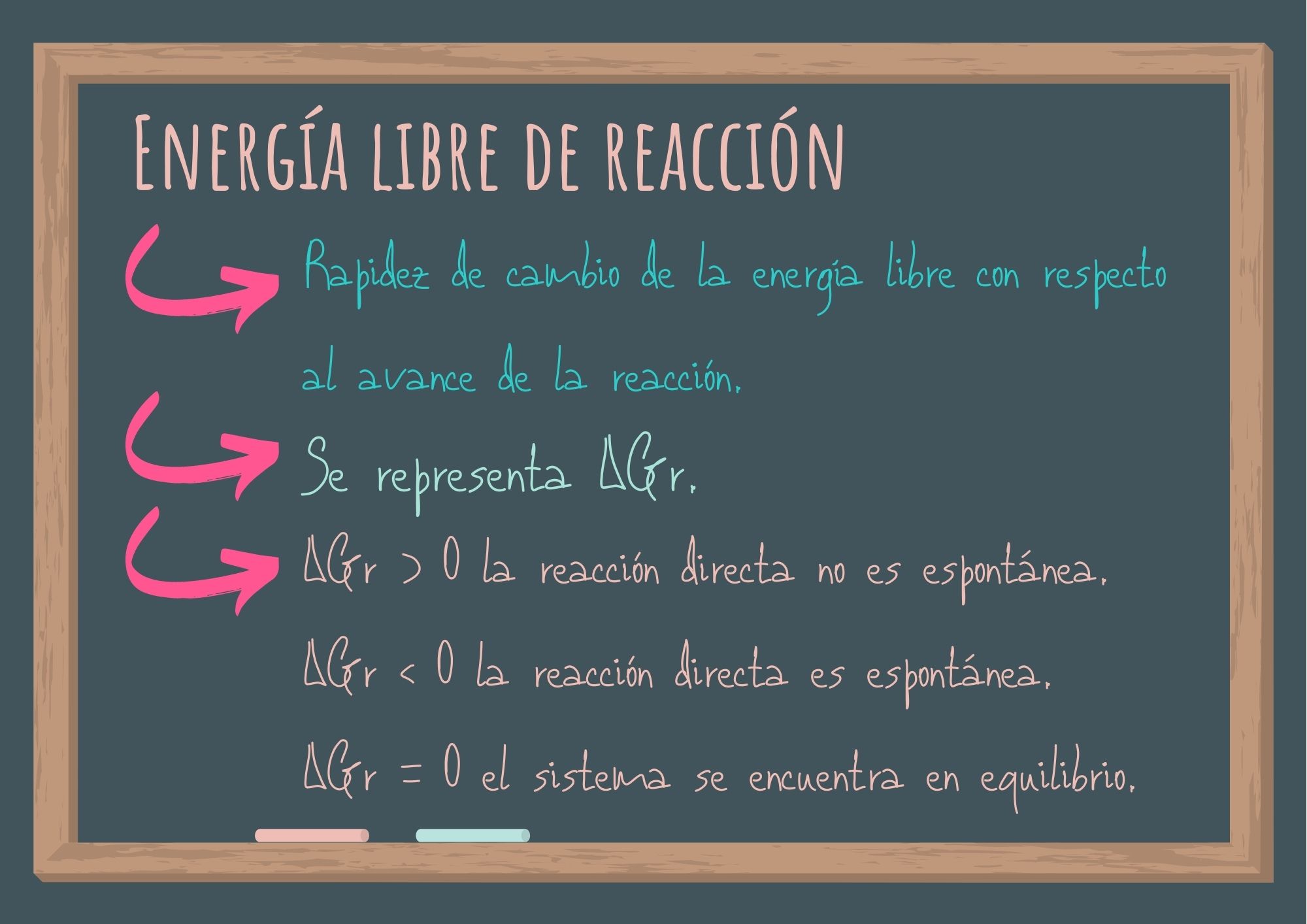
Es la rapidez de cambio de la energía libre con respecto al avance de la reacción.
Se representa: ΔGr. Se expresa en kJ/mol. Es una propiedad extensiva (propiedad que depende de la masa).
Si las condiciones son estándar (presión de 1 atmósfera), se habla de ΔG°r o rapidez de cambio de la energía libre estándar,
![]()
A temperatura y presión constantes una reacción es espontánea si ΔGr < 0 y se encuentra en equilibrio si ΔGr = 0.
Si ΔGr > 0 la reacción directa no es espontánea y la reacción inversa a la planteada será permitida.
El signo nos permite predecir el sentido de la reacción química permitida desde el punto de vista termodinámico (reacción espontánea).
![]()
- En condiciones estándar la combustión completa de la glucosa se representa a continuación:
C6H12O6 (s) + 6 O2 (g) → 6 H2O (l) + 6 CO2 (g) ΔG°r = - 2880 kJ/mol
El valor de la energía libre de reacción directa es MENOR a cero por lo que dicha reacción es espontánea.
- La formación del dipéptido alanilglicina se representa a continuación:
Alanina + Glicina → Alanilglicina ΔG°r = + 29 kJ/mol
El valor de la energía libre de reacción directa es MAYOR a cero por lo que dicha reacción NO es espontánea.
![]()