Introducción: interacción materia y energía, concentración y absorbancia
3. Transmitancia versus absorbancia
3.2. Ley de Bouguer-Lambert-Beer
![]()
El aspecto fundamental de la absorbancia está relacionado a su proporcionalidad directa con la concentración de la especie absorbente en la muestra. Esto está planteado en la ley de Bouguer-Lambert-Beer. También se conoce como la ley de Lambert-Beer. Fue propuesta de formas diferentes e independientes en primer lugar por el matemático y astrónomo francés Pierre Bouguer en 1729. Luego por el filósofo y matemático alemán, Johann Heinrich Lambert en 1760, y por último el físico y matemático también alemán, August Beer en el año 1852. Se puede decir que esta ley se trata de un método matemático, que es utilizado para expresar de qué modo la materia absorbe la luz.

Retratos de Bouger, Lambert y Beer.
La ley afirma que la totalidad de luz que emana de una muestra puede disminuir debido a tres fenómenos:
1. El número de materiales de absorción en su trayectoria, lo cual se denomina concentración.
2. Las distancias que la luz debe atravesar a través de la muestra. Denominamos a este fenómeno, distancia del camino óptico.
3. Las probabilidades que hay de que el fotón de esa longitud particular de onda pueda absorberse por el material. Esto es la constante de proporcionalidad.
A = ε . l . C
Donde:
- A: absorbancia.
- ε: constante de proporcionalidad, denominada absortividad molar, cuyas unidades son L/mol.cm (M-1.cm-1). Es característica de cada sustancia e indica cuánta luz se absorbe a una longitud dada.
- l: camino óptico o espesor de la celda expresada en cm.
- C: concentración de la solución expresada en mol/L.
![]()
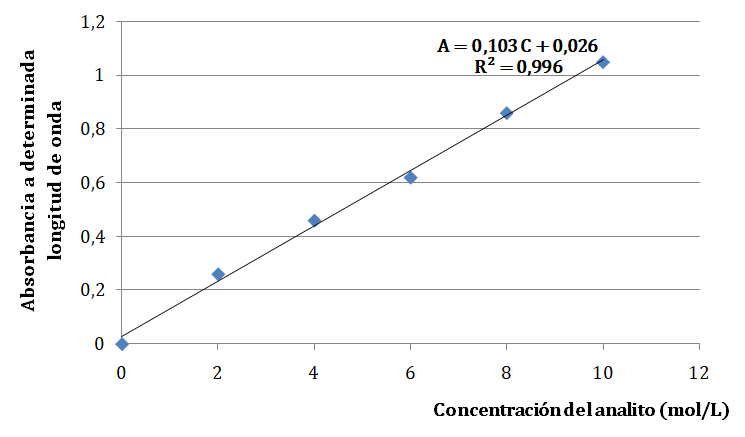
Si se sigue la ley de Bouguer-Lambert-Beer y l se mantiene constante, la gráfica de A = f (C) da una recta que pasa por el origen como puedes observar en la siguiente imagen.
La absorbancia es la variable medida o dependiente y la concentración (expresada en mol/L) la variable independiente o modificada. De la gráfica se obtiene la ecuación de la recta de mejor ajuste por el método de mínimos cuadrados, en este caso y = 0,103 x + 0,026. Luego se cambia la notación de y por la absorbancia, y la notación de x por la concentración.
En el siguiente ejemplo la ecuación es A = 0,103 C + 0,026. Si se desea conocer la concentración de la muestra problema se puede medir su absorbancia y luego sustituir ese valor en la ecuación anterior despejando la concentración.
![]()
