¿Qué son las enzimas?
2. Modelos de acción enzimática
2.1. Energía de fijación y energía de activación
![]()
La energía requerida para disminuir la energía de activación proviene generalmente de interacciones débiles no covalentes entre el sustrato y la enzima, las mismas interacciones que estabilizan la estructura de la proteína (enlaces de hidrógeno, interacciones iónicas, hidrofóbicas y de van der Waals).
La formación de cada interacción débil en el complejo ES (enzima-sustrato) viene acompañada de una pequeña liberación de energía libre que proporciona estabilidad a la interacción.
La energía proveniente de la interacción enzima-sustrato se llama energía de fijación y es la fuente usada para disminuir la energía de activación.
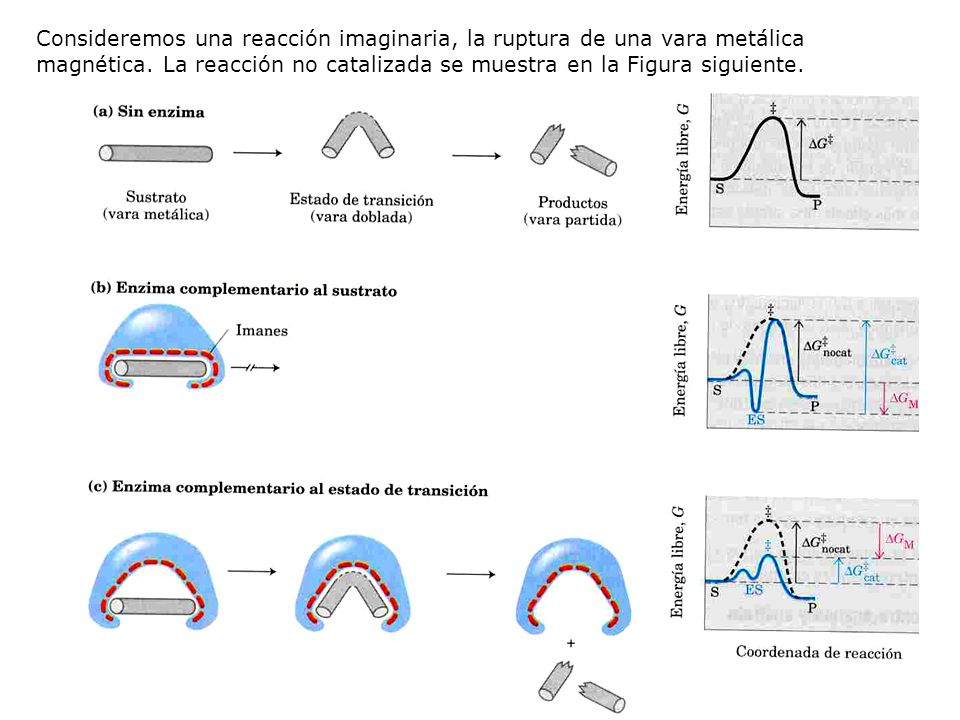
![]()
Si la enzima fuera perfectamente complementaria al sustrato, se impediría la reacción ya que el sustrato se estabilizaría tanto que sería muy difícil salir de allí. Tal enzima no tendría ninguna utilidad.
Una enzima ha de ser complementaria al estado de transición de la reacción. Esto significa que las interacciones óptimas (mediante enlaces débiles o también llamados enlaces de baja energía) entre enzima y sustrato solo pueden tener lugar en el estado de transición.