¿Qué son las enzimas?
3. Factores que afectan la actividad enzimática
![]()
La actividad de una enzima describe qué tan rápido esta cataliza la reacción que convierte un sustrato en producto. Esta actividad depende en gran medida de las condiciones de la reacción, que incluyen temperatura, pH, concentración de la enzima y concentración del sustrato.
![]()
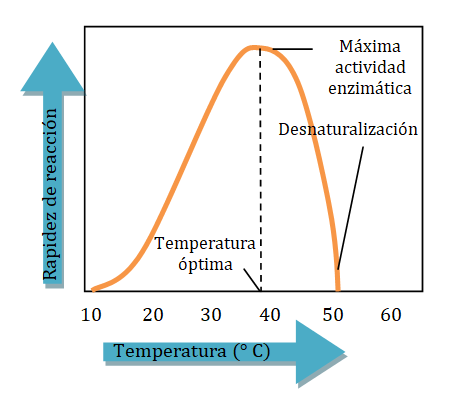
Las enzimas son muy sensibles a los cambios de temperatura. A bajas temperaturas, la mayor parte de las enzimas muestra poca actividad porque no hay suficiente cantidad de energía para que tenga lugar la reacción catalizada. A temperaturas más altas, la actividad enzimática aumenta a medida que las moléculas reactantes se mueven más rápido para generar más colisiones con las enzimas. La mayoría de las enzimas humanas son más activas a temperatura óptima, que es de 37 °C, o temperatura corporal. A temperaturas superiores a 50 °C, la estructura terciaria, y por ende la forma de la mayor parte de las proteínas, se destruye, lo que causa una pérdida de actividad enzimática. Por esta razón, el equipo en los hospitales y laboratorios se esteriliza en autoclaves donde las temperaturas altas desnaturalizan las enzimas que existen en las bacterias dañinas. Una fiebre corporal alta puede ayudar a desnaturalizar las enzimas existentes en las bacterias que causan la infección.
Ciertos microorganismos, conocidos como termófilos, viven en ambientes donde las temperaturas varían de 50 °C a 120 °C. Para poder sobrevivir en estas condiciones extremas, los termófilos deben tener enzimas con estructuras terciarias que no se destruyen por dichas temperaturas. Algunas investigaciones demuestran que sus enzimas son muy similares a las enzimas ordinarias, excepto que contienen más arginina y tirosina. Estos leves cambios permiten a las enzimas de los termófilos formar más enlaces de hidrógeno y puentes salinos que estabilizan sus estructuras terciarias a altas temperaturas, y resisten el desdoblamiento y la pérdida de actividad enzimática.
![]()
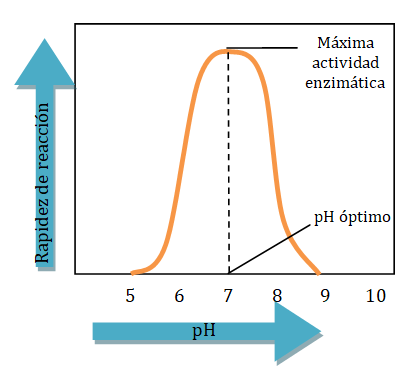
Las enzimas son más activas a su pH óptimo, el pH que mantiene la estructura terciaria adecuada de la proteína. Si un valor de pH está arriba o abajo del pH óptimo, se alteran las interacciones de los grupos R, lo que destruye la estructura terciaria y el sitio activo. Como resultado, la enzima ya no puede unirse a un sustrato de manera adecuada y no ocurren reacciones. Si se revierte un pequeño cambio en el pH, una enzima puede recuperar su estructura y actividad. Sin embargo, grandes variaciones respecto del pH óptimo destruyen de manera permanente la estructura de la enzima.
Las enzimas en la mayor parte de las células humanas tienen valores de pH óptimos a un pH fisiológico de más o menos 7,4. Sin embargo, las enzimas en el estómago tienen un pH óptimo bajo porque hidrolizan las proteínas en el medio ácido del estómago. Por ejemplo, la pepsina, una enzima digestiva que se encuentra en el estómago, tiene un pH óptimo de 1,5 - 2,0. Entre comidas, el pH en el estómago es de 4 o 5, y la pepsina muestra poca o ninguna actividad digestiva. Cuando el alimento entra al estómago, la secreción de ácido clorhídrico (HCl) baja el pH a aproximadamente 2, lo que activa la pepsina.
![]()
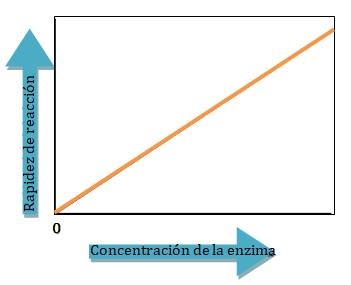
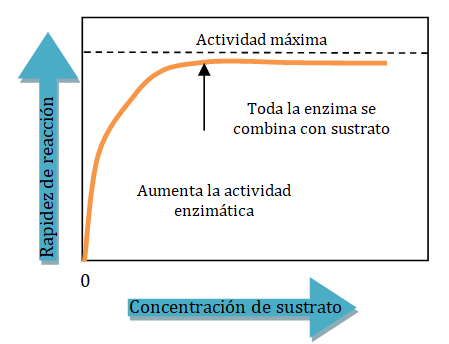
En cualquier reacción catalizada, el sustrato debe unirse primero con la enzima para formar el complejo enzima-sustrato. Para una concentración de sustrato particular, un aumento en la concentración enzimática aumenta la rapidez de la reacción catalizada. A concentraciones enzimáticas más altas, más moléculas están disponibles para unirse al sustrato y catalizar la reacción. Mientras la concentración de sustrato sea mayor que la concentración de la enzima, hay una relación directa entre la concentración de la enzima y la actividad enzimática. En muchas reacciones catalizadas por enzimas, la concentración del sustrato es mucho mayor que la concentración de la enzima.
Cuando la concentración de enzima se mantiene constante, la adición de más sustrato aumentará la rapidez de la reacción. Si la concentración del sustrato es alta, puede saturar todas las moléculas de la enzima. Entonces la rapidez de la reacción alcanza su máximo y la adición de más sustrato no aumenta más la rapidez de la reacción.