¿Qué factores y variables modifican la rapidez de una reacción química?
3. Factores que afectan la rapidez de una reacción química
![]()
Como venimos analizando la rapidez de una reacción se puede expresar como el
producto de tres factores:
- frecuencia de las colisiones,
- factor energético y
- factor de dirección u orientación apropiada.
![]()
Es el número de colisiones que ocurren por unidad de tiempo. Depende de:
➔ Cuán aglomeradas están las partículas (se relaciona con la concentración o la presión en el caso de los sistemas gaseosos).➔ Cuán rápidamente se mueven las partículas.
➔ Cuán grandes son las partículas, ya que por lo general las partículas más grandes, también tienen mayor masa y se mueven más lento.
➔ Qué cantidad de partículas pueden interactuar.
![]()
Es la fracción de colisiones suficientemente energéticas. El factor energético es el más importante en determinar la rapidez de reacción. Depende de:
➔ La energía de activación (es
característica de cada reacción).
➔ La temperatura (se puede controlar).
![]()
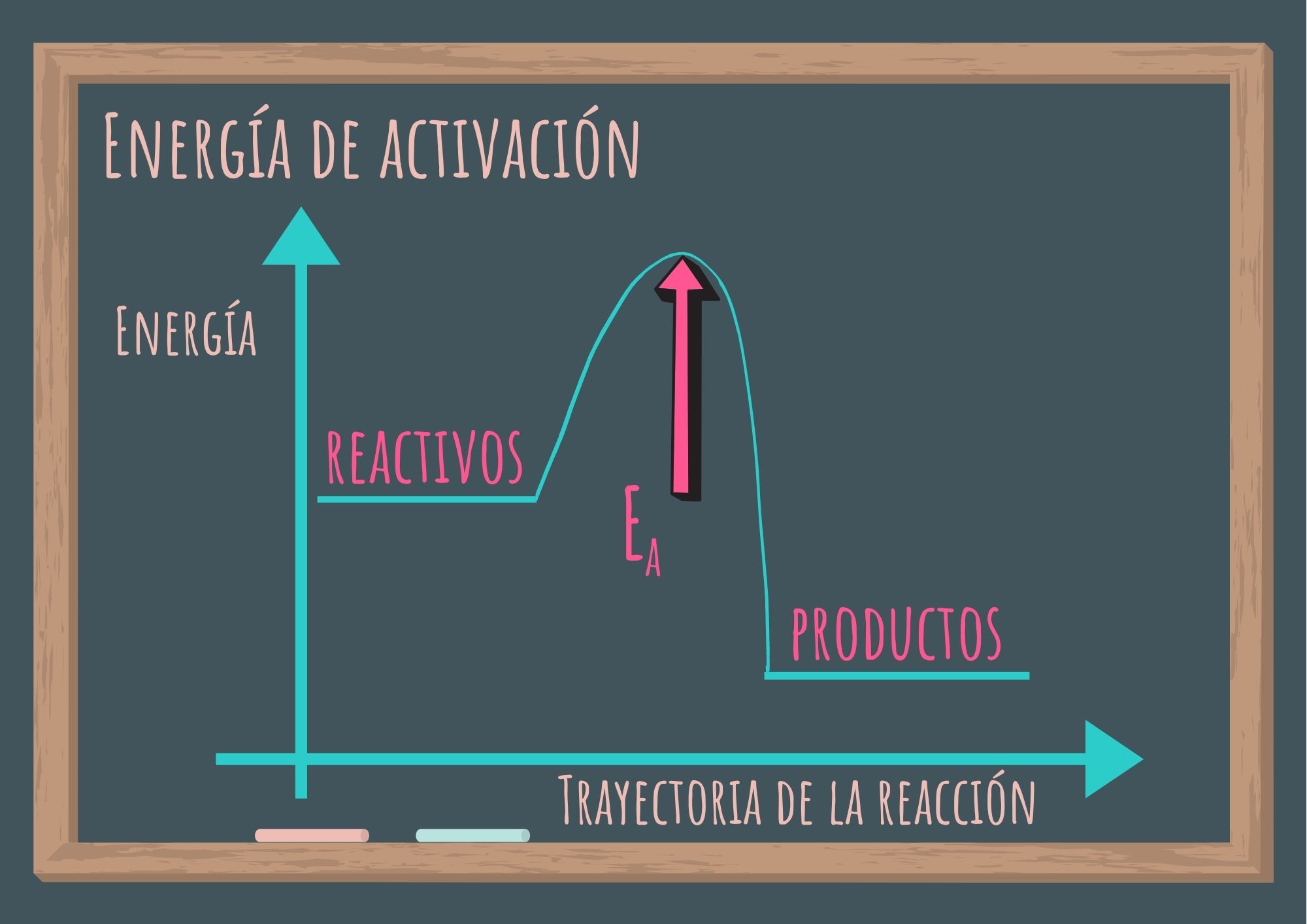
Es la energía mínima que se le debe dar a una colisión para que produzca una reacción química. Esta energía es característica de cada reacción. Se representa como Ea.
Una fuente para alcanzar la energía de activación proviene de la energía cinética de las partículas en movimiento. Las partículas que chocan deben tener una energía cinética total, igual o mayor que la energía de activación. Cuanto mayor sea la Ea menor es la fracción de colisiones que tienen esa energía.
![]()
Expresa la probabilidad de que una colisión tenga la orientación adecuada. Depende de:
➔ La geometría de las partículas.
➔ La dirección del choque.
➔ El tipo de reacción que se está realizando.