¿Qué es el equilibrio químico?
5. Reacciones que habitualmente se completan
Analicemos dos ejemplos de cambios químicos desde los diferentes niveles de representación con el objetivo de diferenciar las reacciones que habitualmente se completan de las que habitualmente no se completan o también denominadas incompletas.
El término habitualmente hace referencia a las condiciones en que tienen lugar estas reacciones en la vida cotidiana o en el trabajo cotidiano en el laboratorio.
Se observa la combustión completa del metano (principal componente del gas natural).

A nivel de partículas, se puede interpretar que en este proceso 1 molécula de metano reacciona con 2 moléculas de dioxígeno; se forman 1 molécula de dióxido de carbono y 2 moléculas de agua. Se rompen los enlaces covalentes que mantienen unidos al átomo de carbono con los átomos de hidrógeno, en el caso del metano, y a los dos átomos de oxígeno entre sí, en el caso de la molécula de dioxígeno, formándose nuevos enlaces entre los átomos de carbono y de oxígeno así como entre los átomos de oxígeno e hidrógeno.
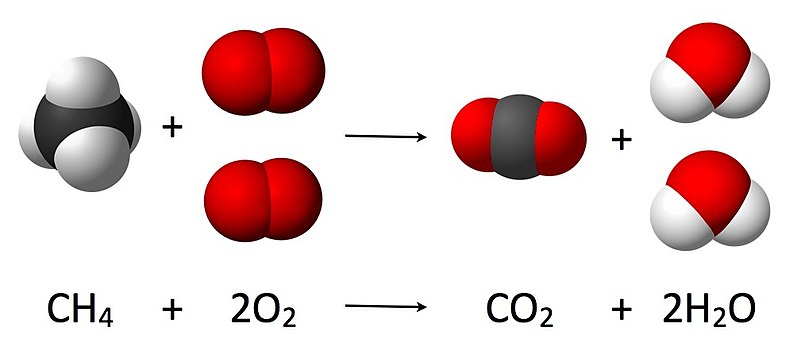
Esta expresión se puede complementar con más información, como el estado físico de las sustancias que intervienen:
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l)
En este caso es necesario recurrir a la magnitud cantidad química (expresada en mol) realizando la interpretación cuantitativa; por lo tanto los
coeficientes estequiométricos permiten establecer la proporción molar
en que se combinan los reactivos y se forman los productos. En este ejemplo: un mol de metano gaseoso reacciona con dos moles de dioxígeno gaseoso; formándose un mol de dióxido
de carbono gaseoso y dos moles de agua en estado líquido.
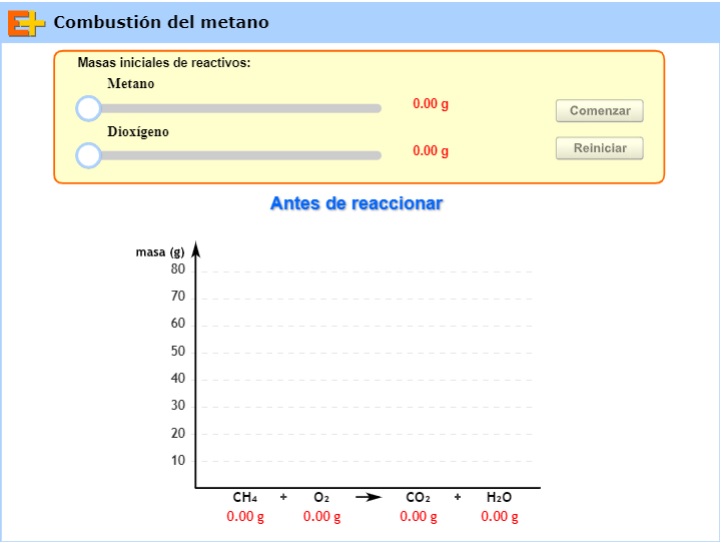
En el siguiente simulador puedes analizar la relación estequiométrica en la que se combinan los reactivos y se forman los productos.
1. Modifica la masa inicial de metano y de dioxígeno, regístrala, haz clic en comenzar y registra los resultados finales para los cuatro compuestos.
2. Repite el procedimiento tres veces más.
3. Crea una tabla para organizar los resultados, incluye los datos expresados en mol para cada compuesto y relaciona las cantidades químicas que realmente reaccionaron o se formaron de dos compuestos (por ejemplo la cantidad química de los dos reactivos, los dos productos, un reactivo y un producto, etc.).
- ¿A qué conclusión llegas?
- ¿Cómo se relaciona tu conclusión con la siguiente frase: "la información aportada por las ecuaciones químicas, en términos de cantidad química, permite establecer la proporción molar en que se combinan las sustancias reaccionantes y se forman las sustancias resultantes. Estas proporciones no se modifican aunque se cambien las cantidades de sustancias que se colocan a reaccionar."?
- ¿Qué entiendes por reactivo en exceso y reactivo limitante? ¿Cómo se aplican estos términos a los datos que has obtenido?
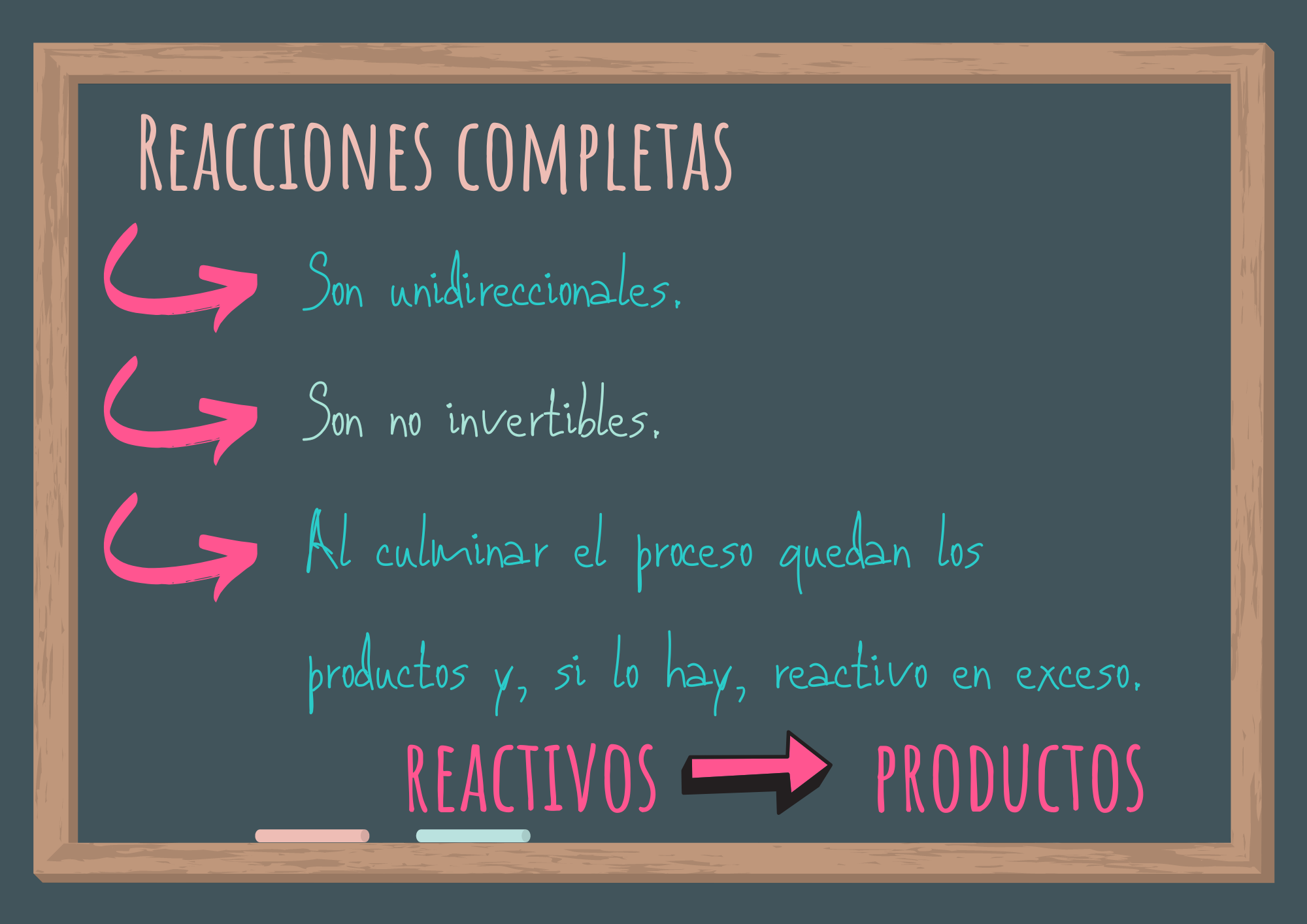
Algunas reacciones transcurren hasta que por los menos uno de los reactivos se consume o transforma totalmente (si hay reactivo limitante). Son unidireccionales o completas y no se pueden invertir si se mantienen las mismas condiciones de temperatura y presión. Son llamadas reacciones no invertibles. Transcurren de reactivos a productos y en la ecuación las representamos con una sola flecha.
Al culminar el proceso, en el recipiente de reacción quedarán los productos y reactivo en exceso (si hay reactivo limitante, habrá reactivo en exceso).
* Recuerda que las categorías reacciones completas e incompletas no son absolutas, dependen de las condiciones del sistema. Por ejemplo, una reacción puede ser completa en un sistema abierto, pero no serlo si el sistema está cerrado.