¿Qué es el equilibrio químico?
6. Reacciones incompletas o que habitualmente no se completan
Observa lo que ocurre al colocar una ampolla sellada que contiene en su interior dióxido de nitrógeno en un baño de María.
A partir del siguiente simulador completa lo que ocurre a nivel de partículas, nivel simbólico y nivel gráfico. Intenta replicar lo observado en el video aumentando la temperatura del sistema.
NNO2 y NN2O4 controla la cantidad de moléculas de cada compuesto, V controla el volumen del sistema y T (K) la temperatura expresada en grados Kelvin.
Para comenzar haz clic en el botón start.
Para realizar otro experimento haz clic en reset y modifica las variables según consideres, luego haz clic nuevamente en start.
- ¿Qué ocurre a nivel de partículas en un sistema formado inicialmente por dióxido de nitrógeno al transcurrir el tiempo? ¿Y si se parte de ambos compuestos?
- ¿Cómo simbolizas el cambio químico ocurrido?
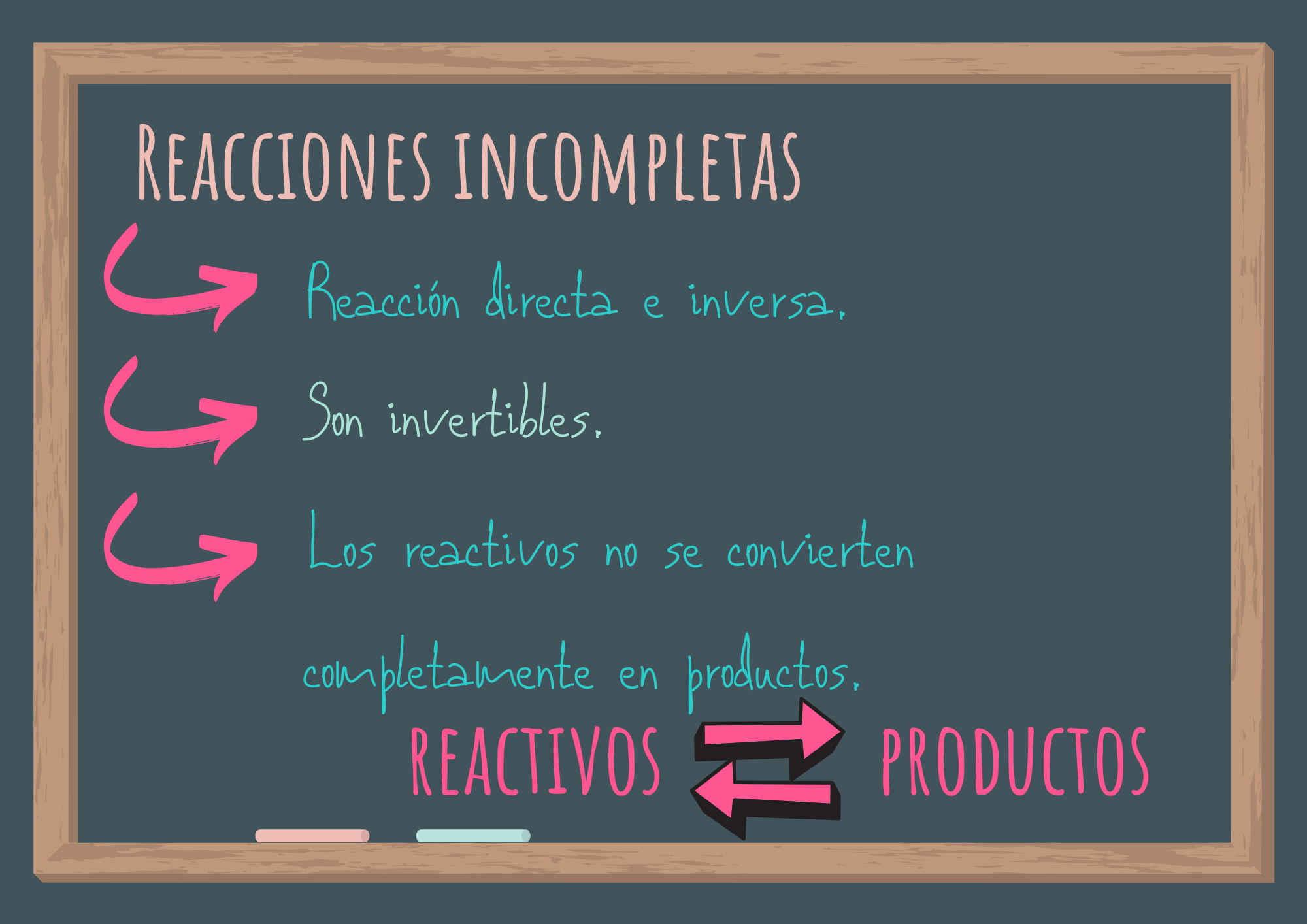
Otras reacciones, que en realidad son la mayoría, no llegan a completarse, son incompletas. Aunque se coloquen a reaccionar los reactivos en cantidades estequiométricas, no se convierten completamente en productos. Estos procesos pueden transformarse en reactivos si se dan la condiciones que se produzca una reacción directa (de reactivos a productos) y otra inversa (de productos a reactivos) simultáneamente. Son llamadas reacciones invertibles. En el estado de equilibrio estos procesos se representan con dos flechas (⇄).
* Recuerda que las categorías reacciones completas e incompletas no son absolutas, dependen de las condiciones del sistema. Por ejemplo, una reacción puede ser incompleta si el sistema se encuentra cerrado y no abierto.