¿Qué es el equilibrio químico?
9. "Pan a partir del aire"
![]()
En 1912 el químico alemán Fritz Haber (1868–1934) descubrió un proceso para sintetizar amoníaco directamente a partir de dinitrógeno y dihidrógeno. El proceso se conoce también proceso Haber-Bosch, en honor a Karl Bosch, el ingeniero que ideó el equipo para la producción industrial de amoníaco (denominado azano según la IUPAC). La ingeniería necesaria para poner en práctica el proceso Haber exige el uso de altas temperaturas y presiones (aproximadamente 500 °C y 200 atm) que eran difíciles de alcanzar en aquella época.

Imagen. Retrato de Haber y Bosch respectivamente.
El proceso Haber ofrece un ejemplo de interés histórico de las complejas repercusiones de la química en nuestra vida. Al comenzar la Primera Guerra Mundial, en 1914, Alemania dependía de los depósitos de nitrato de Chile para abastecerse de los compuestos nitrogenados que necesitaba para fabricar explosivos. Durante la guerra el bloqueo naval aliado de Sudamérica cortó este suministro. Sin embargo, fijando nitrógeno del aire, Alemania pudo continuar produciendo explosivos. Los expertos han estimado que la Primera Guerra Mundial habría terminado antes de 1918 de no ser por el proceso Haber.
De estos infortunados inicios como factor decisivo en las guerras internacionales, el proceso Haber ha llegado a ser la principal fuente mundial de nitrógeno fijado. El mismo proceso que prolongó la Primera Guerra Mundial ha permitido a los científicos fabricar fertilizantes que han incrementado el rendimiento de los cultivos y salvado así a millones de personas de la inanición. El amoníaco se aplica directamente al suelo como fertilizante. También se convierte en sales de amonio como, por ejemplo, sulfato de amonio (NH4)2SO4, o hidrógenofosfato de amonio (NH4)2HPO4, las que a su vez se emplean como fertilizantes.
![]()
El siguiente diagrama indica los pasos seguidos en una industria que produce amoníaco a través del proceso Haber-Bosch.
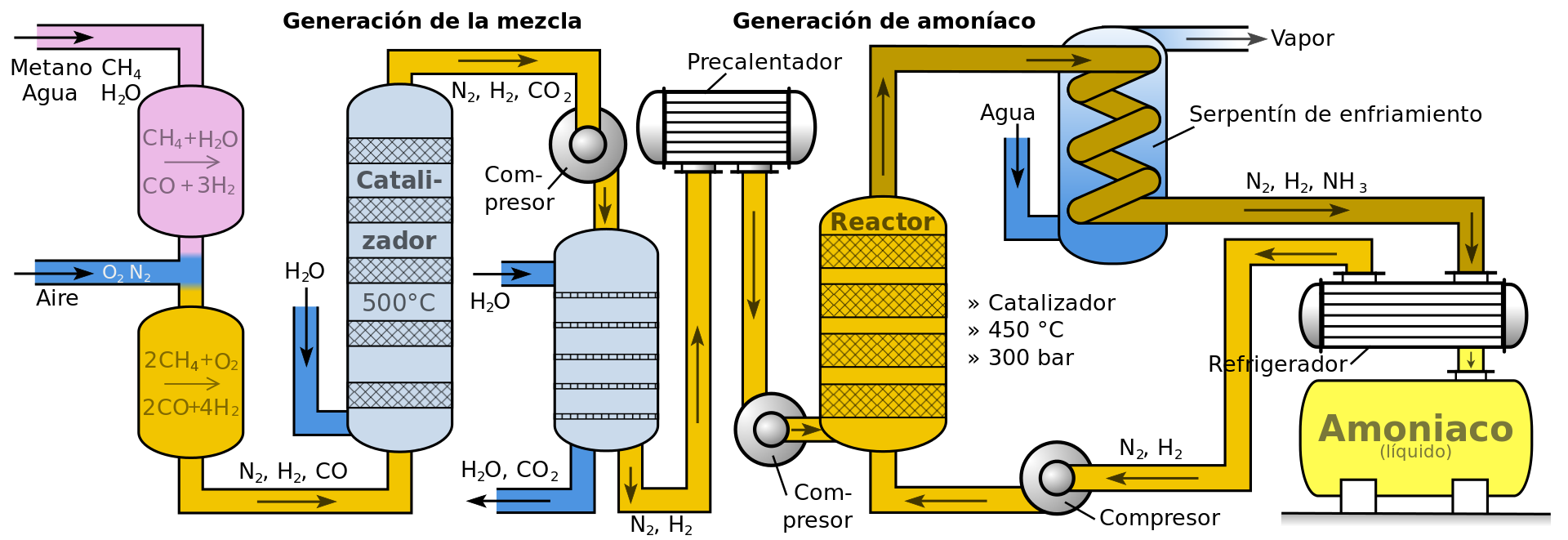
![]()
Observa qué ocurre a nivel de las partículas en el siguiente simulador. Puedes revisar el capítulo sobre reacciones incompletas para saber cómo utilizarlo.
![]()
N2 (g) + 3 H2 (g) ⇄ 2 NH3 (g)
![]()
Se han realizado tres experimentos. En el primero se colocó un mol de dinitrógeno y un mol de dihidrógeno en un contenedor de 1 L y se selló el envase. Se permitió que el sistema alcanzara el estado de equilibrio químico y se midieron las concentraciones de cada especie. Los datos obtenidos aparecen en la tabla que se encuentra a continuación.
En el segundo experimento se partió de un mol de amoníaco en un recipiente sellado de 1 L. Y en el tercer experimento se colocaron dos moles de dinitrógeno, un mol de dihidrógeno y tres moles de amoníaco en un recipiente sellado de 1 L de capacidad.
Todos los experimentos se realizaron a 500 °C.
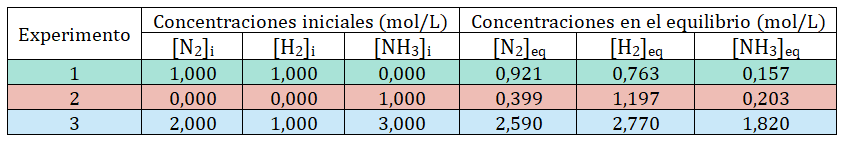
Referencias: [ ] indican concentración, i representa inicial y eq equilibrio.
La siguiente gráfica representa de forma esquemática el experimento 1.
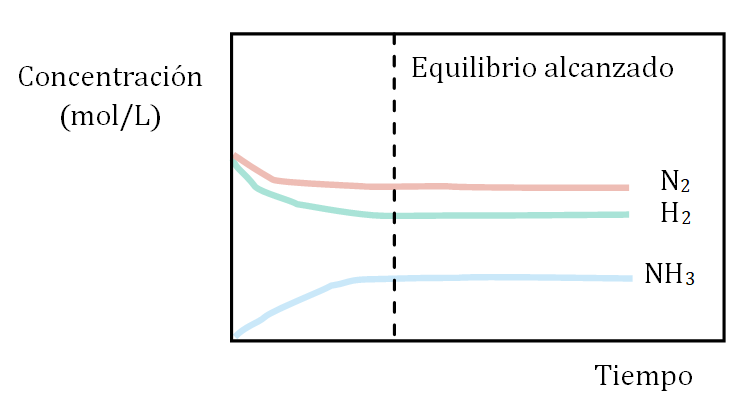
![]()
1. Realiza dos gráficas sencillas (a modo de esquema), que representen los datos obtenidos de los experimentos 2 y 3.
2. Diseña tres experimentos en base al simulador variando el número de partículas iniciales de cada una de las especies y analiza la gráfica de concentración en función del tiempo obtenida en cada ejemplo. ¿En qué se asemejan y se diferencian las tres gráficas?