Profundizando en las propiedades y estructura de los sólidos
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 2º B.D. |
| Libro: | Profundizando en las propiedades y estructura de los sólidos |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:54 |
Tabla de contenidos
1. Introducción
![]()
Todos los objetos están hechos de materia pero de diferentes materiales.
Los objetos se construyen para cumplir una función determinada. Los materiales que componen un objeto son elegidos en función de sus propiedades.
Cada material se distingue porque tiene características propias. Sus propiedades dan información sobre cómo se comporta y para qué puede ser usado.A continuación podrás repasar algunas propiedades de los materiales sólidos.

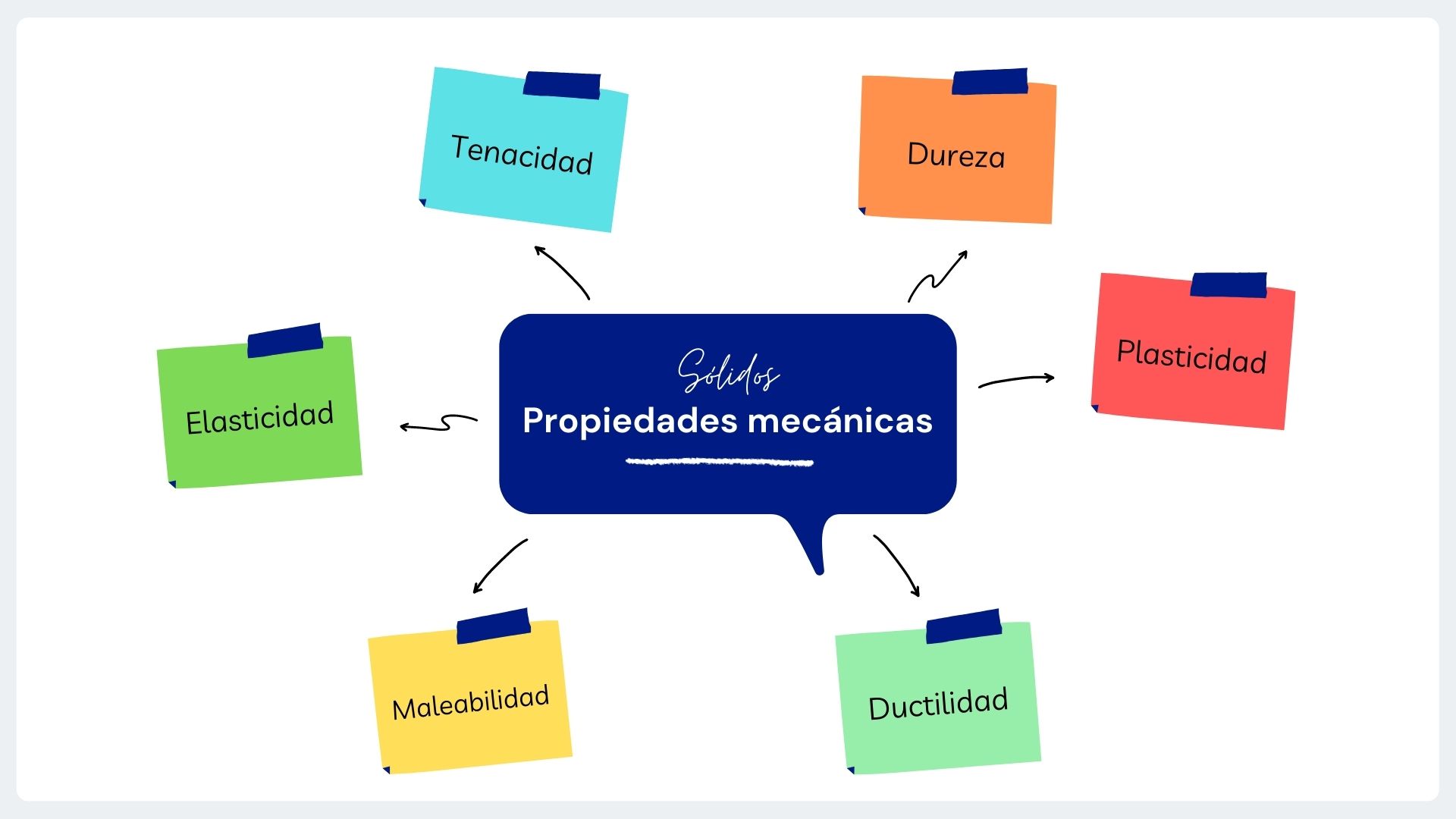
2. Propiedades mecánicas
![]()
Son propiedades físicas que describen el comportamiento de un material sólido al aplicarle fuerzas. Por ejemplo, de tracción, compresión o torsión.
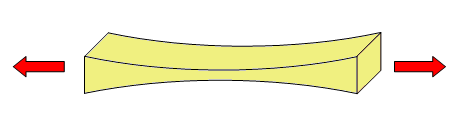 |
Las fuerzas de tracción buscan alargar un objeto. |
|---|---|
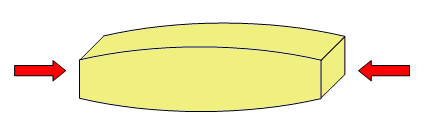 |
Las fuerzas de compresión intentan acortarlo. |
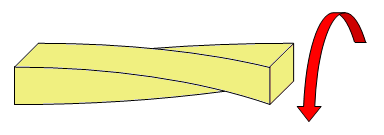 |
Las fuerzas de torsión tienen el objetivo de torcer el objeto a lo largo de un eje. |
Son ejemplos de propiedades mecánicas:
A continuación analizaremos la dureza.
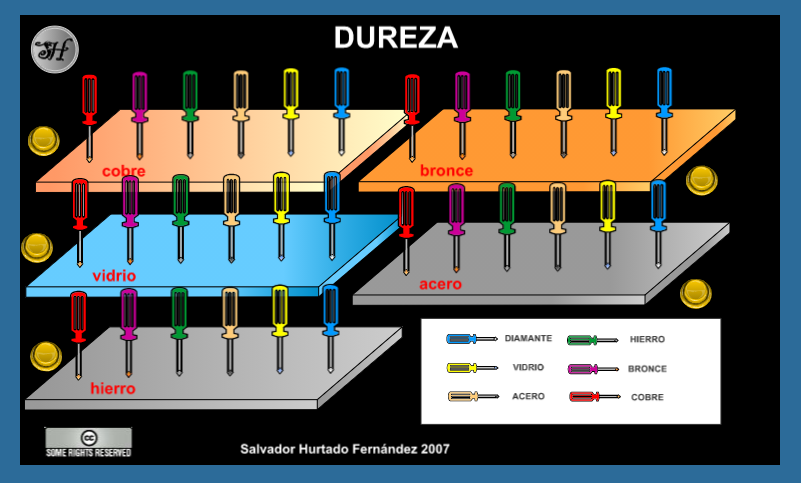
2.1. Dureza
![]()
Parte 1 - Predicciones
- ¿Qué piensas que ocurrirá al intentar rayar una placa de acero con un destornillador hecho de hierro, otro de bronce, y uno de diamante?
- ¿Existen diferencias si la placa que se está utilizando es de vidrio?
Parte 2 - Experimentando
Visita el siguiente enlace para acceder al simulador.
- Selecciona una de las placas con las que comenzar a trabajar.
- Oprime el botón amarillo correspondiente a dicha placa.
- Registra tus observaciones en una tabla que deberás crear.
- Continúa con la siguiente placa y repite los pasos anteriores.
- Repite todos los pasos anteriores para las demás placas.
Parte 3 - Analizando los datos
- ¿Existen similitudes y diferencias entre lo observado? ¿Cómo lo explicas?
- ¿A qué conclusiones llegas?
- ¿Cómo puedes definir la dureza?
Parte 4 - Revisando las predicciones
- Luego de realizar el experimento, ¿cambias alguna de tus respuestas en la parte 1? Si así es, ¿cómo lo explicas?
Sube tus respuestas en el siguiente enlace.
2.2. ¿Qué es la dureza?
![]()
Se puede definir a la dureza como la resistencia que opone un material a ser rayado o atravesado por otro. Por ejemplo, el acero es más duro que la madera, ya que el acero puede cortar a la madera mientras que la madera no puede cortar, ni rayar al acero. El material conocido de mayor dureza es el diamante.
Observa el siguiente video:
Luego de ver el video completa la siguiente tabla, busca la información faltante:
| Escala de Mohs | Ejemplo | Composición química | Fórmula química |
|---|---|---|---|
| 1 | Talco | Silicato de magnesio hidratado | Mg3Si4O10(OH)2 |
| 2 | |||
| 3 | |||
| 4 | |||
| 5 | |||
| 6 | |||
| 7 | |||
| 8 | |||
| 9 | |||
| 10 |
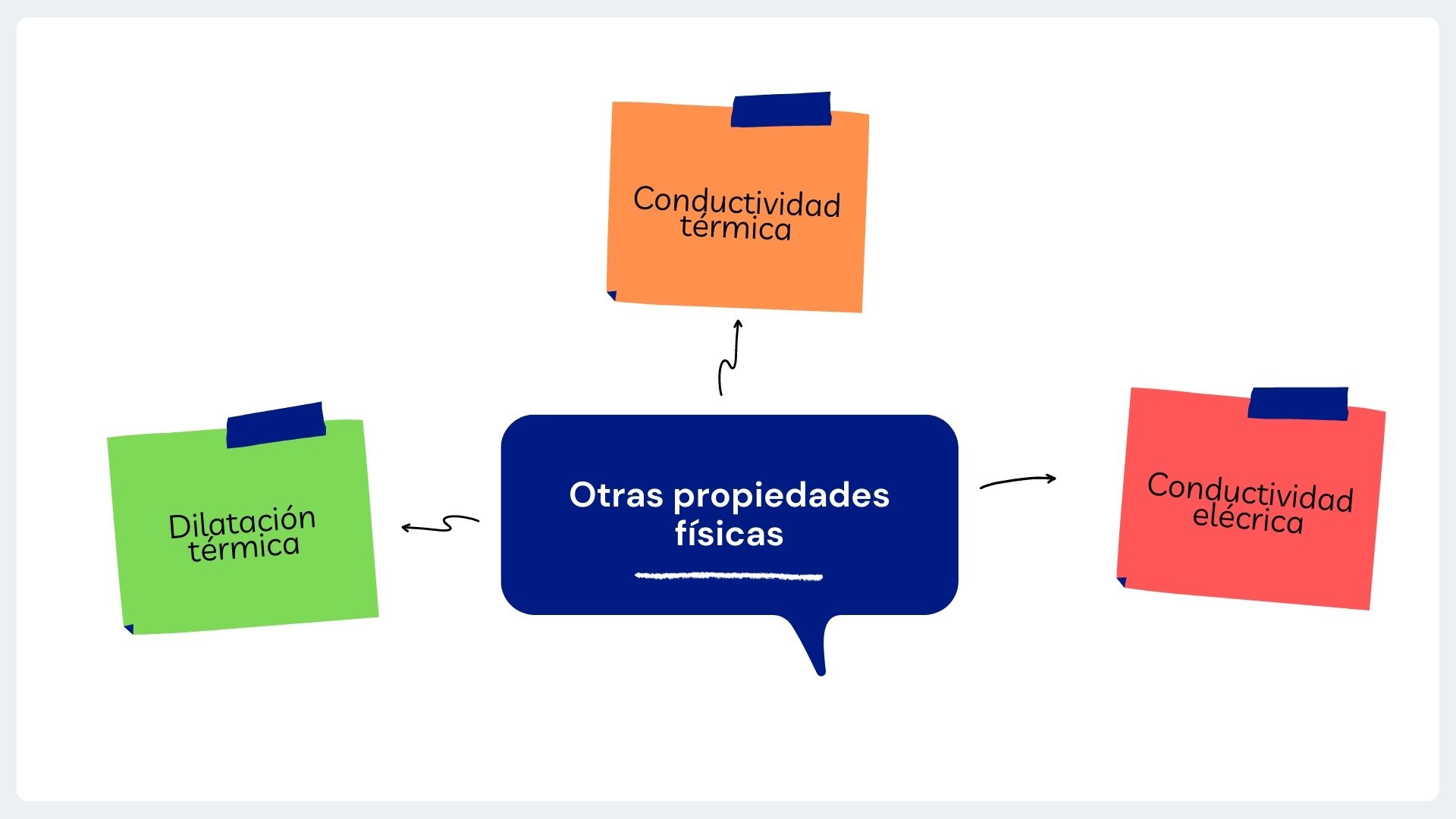
3. Otras propiedades físicas
![]()
Existen otras propiedades físicas que no se relacionan con las fuerzas que actúan sobre el material y son medibles en sistemas en diferentes estados físicos y no solo en sólidos.
Tres de ellas son la dilatación térmica, la conductividad térmica y la conductividad eléctrica.
3.1. Conductividad térmica
![]()
Parte 1 - Predicciones
- ¿Qué piensas que ocurrirá al colocar barras de materiales diferentes (madera, plástico y diferentes metales) que tienen pegados tornillos iguales con un trozo de vela si se colocan en contacto con un recipiente que contiene agua hirviendo?
Parte 2 - Experimentando
Simulador 1: Visita el siguiente enlace para acceder al simulador.
- Oprime el botón anaranjado para comenzar el experimento.
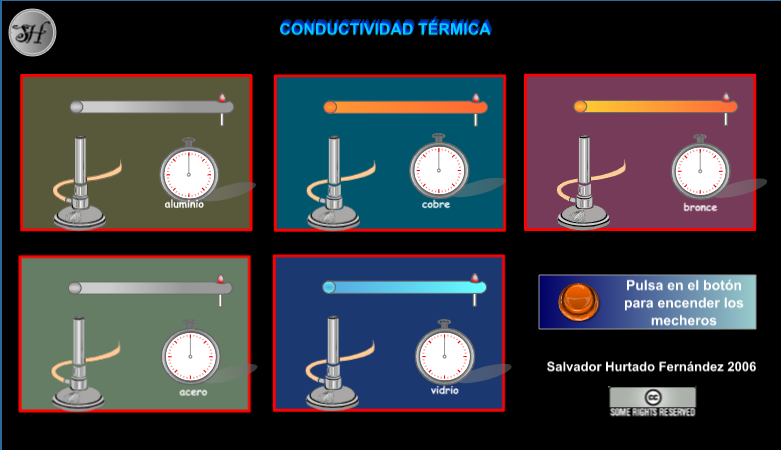
- Registra tus observaciones en una tabla que deberás crear.
Simulador 2: Visita el siguiente enlace para acceder al simulador.
- Haz clic en iniciar.
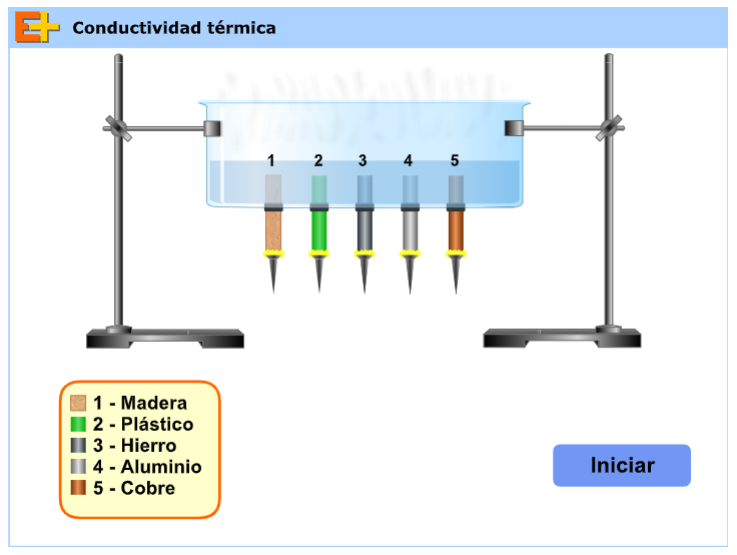
- Registra tus observaciones en la tabla anterior.
Parte 3 - Analizando los datos
- ¿Existen similitudes y diferencias entre lo observado? ¿Cómo lo explicas?
- ¿A qué conclusiones llegas?
- ¿Cómo puedes definir la conductividad térmica?
Parte 4 - Revisando las predicciones
- Luego de realizar el experimento, ¿cambias alguna de tus respuestas en la parte 1? Si así es, ¿cómo lo explicas?
Sube tus respuestas en el siguiente enlace.
3.2. ¿Qué es la conductividad térmica?
![]()
La conductividad térmica es la propiedad de un material que mide la capacidad de conducir calor a través del mismo.
Se pueden clasificar a los materiales según su comportamiento térmico en:
- buenos conductores: son aquellos materiales que permiten la rápida transferencia de energía a través de ellos. También reciben el nombre de materiales diatérmicos. Son buenos conductores térmicos los metales, por esto se utilizan para construir radiadores de calefacción o refrigeración, ollas, asaderas y sartenes, entre otros.

- malos conductores o aislantes térmicos: son aquellos materiales donde la transferencia de energía a través de ellos es muy lenta. También reciben el nombre de materiales adiabáticos. La madera, el plástico, el aire, el corcho y la fibra de vidrio, son ejemplos de materiales aislantes y se utilizan cuando se quiere evitar la transferencia de energía, como es el caso de los materiales empleados para construir termos o conservadoras, mangos de cucharones, espumaderas o calderas que se fabrican de madera o plástico evitando una transferencia de calor que dañe nuestras manos.

3.3. Conductividad eléctrica
![]()
Parte 1 - Predicciones
- ¿Qué piensas que ocurrirá al colocar trozos de diferentes materiales (madera, plástico, diferentes metales, grafito, papel, vidrio) para cerrar un circuito eléctrico compuesto por una fuente, pinzas, conectores y una lámpara?
Parte 2 - Experimentando
Simulador 1: Visita el siguiente enlace para acceder al simulador.
- Ubica el ratón sobre cada material a probar y llévalo hasta la zona del circuito eléctrico donde se encuentran las pinzas.
- Observa qué ocurre con la lámpara.
- Registra tus observaciones en una tabla que deberás crear.
Parte 3 - Analizando los datos
- ¿Existen similitudes y diferencias entre lo observado? ¿Cómo lo explicas?
- ¿A qué conclusiones llegas?
- ¿Cómo puedes definir la conductividad eléctrica?
Parte 4 - Revisando las predicciones
- Luego de realizar el experimento, ¿cambias alguna de tus respuestas en la parte 1? Si así es, ¿cómo lo explicas?
Sube tus respuestas en el siguiente enlace.
3.4. ¿Qué es la conductividad eléctrica?
![]()
La conductividad eléctrica es la propiedad de un material que mide la capacidad de conducir la corriente eléctrica a través del mismo.
Los cables que comúnmente se utilizan para las instalaciones eléctricas están hechos de cobre. El cobre es un buen conductor de la corriente eléctrica, sin embargo el plástico que lo recubre es un aislante eléctrico.
Aquellos materiales que permiten la circulación de la corriente eléctrica con facilidad, se denominan buenos conductores eléctricos, o simplemente conductores eléctricos (como los metales y el grafito) y aquellos materiales que dificultan la circulación de la corriente eléctrica se denominan malos conductores eléctricos o aislantes (como la madera, el plástico y la goma).

Observa el siguiente mapa mental que lo resume:
Mapa Mental creado con GoConqr por Anarella Gatto4. Sólidos cristalinos y amorfos
![]()
Los materiales sólidos pueden pertenecer al grupo de los sólidos cristalinos o los amorfos.
En la naturaleza existen sustancias como el cloruro de sodio (NaCl), el azufre y la sacarosa (C12H22O11 - azúcar de mesa) que son sólidos en las condiciones ambientales y por lo tanto poseen las propiedades de poca compresibilidad y rigidez, además los encontramos en la naturaleza con formas geométricas características. Estas sustancias con formas características los denominamos sólidos cristalinos y los distinguimos de los no cristalinos que los denominamos amorfos.
Las propiedades de los cristales reflejan su gran ordenamiento interno. Existen en la naturaleza muchos minerales cristalinos que muestran sus caras y ángulos bien definidos como el cuarzo natural. Otras veces muchas sustancias sólidas se presentan en polvo y se puede pensar que son amorfas, pero si se examina la partícula individual bajo el microscopio, los ángulos cristalinos se pueden visualizar. Por ello debemos distinguir entre sólidos policristalinos (metales, en general) y amorfos.
El tamaño de los cristales de una sustancia puede variar dependiendo de las condiciones en que se forma el cristal.
Para distinguir claramente sólidos cristalinos de los amorfos es fundamental determinar su punto de fusión, ya que los cristalinos tienen puntos de fusión bien definidos y los amorfos no tienen puntos de fusión definidos.
Los sólidos amorfos no tienen una estructura bien definida y ordenada. Como ejemplos se incluyen la goma, algunos tipos de plásticos y el azufre amorfo.
La ruptura de un sólido cristalino produce fragmentos que tienen los mismos (o relacionados) ángulos interfaciales y las mismas características estructurales que la muestra original. Los sólidos amorfos con estructuras irregulares se rompen irregularmente para rendir piezas con aristas curvas y ángulos irregulares.
En la siguiente figura se pueden observar las diferencias en la estructura de un sólido cristalino y uno amorfo:
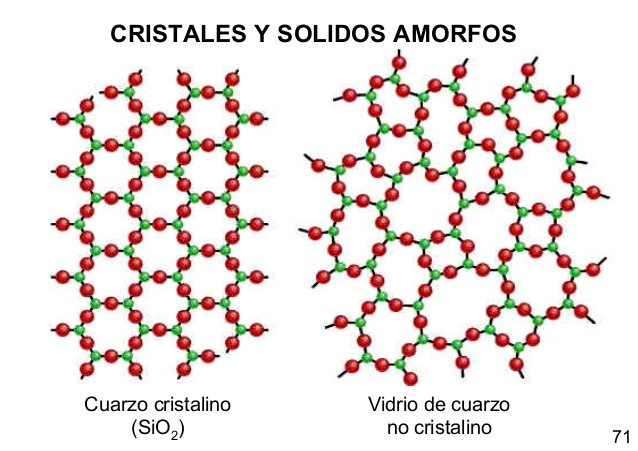
![]()
Los sistemas cristalinos dependen de la disposición simétrica y repetitiva de las caras que forman el cristal. Dicha disposición se debe al ordenamiento interno de las partículas que forman al cristal. Los cristales poseen la misma simetría que las unidades que los constituyen, porque los cristales son múltiplos repetitivos de tales celdas. Existen 7 sistemas cristalinos:
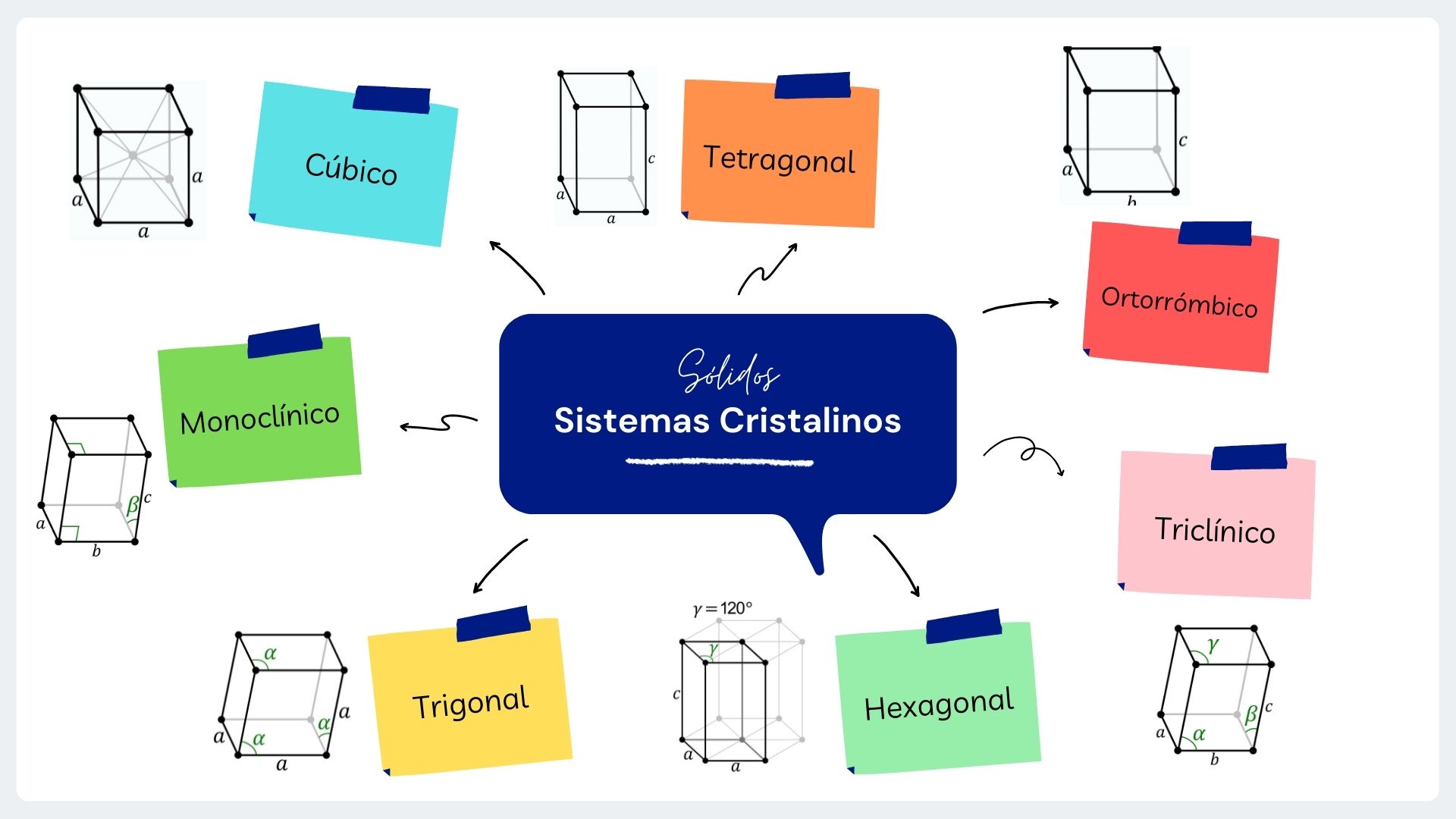
A continuación podrás observar un cuadro en el que se muestran ejemplos de los sistemas cristalinos:
| Sistema cristalino | Ejemplos | Imágenes |
|---|---|---|
| Cúbico | NaCl |  |
| Tetragonal | TiO2 (rutilo) |  |
| Ortorrómbico | KNO3 (imagen), MgSO4.7H2O |  |
| Triclínico | K2Cr2O7, CuSO4.5H2O (imagen) |  |
| Hexagonal | SiO2 (sílice) |  |
| Trigonal o romboédrico | CaCO3 (calcita) |  |
| Monoclínico | CaSO4.2H2O (caliza) |  |
4.1. Cristalografía
![]()
La cristalografía es la ciencia que estudia los cristales. El año 2014 ha sido proclamado Año Internacional de la Cristalografía. Hace exactamente un siglo, se descubrió que los rayos X podrían ser utilizados para "ver" la estructura de la materia de una manera no intrusiva.

Hoy en día, la cristalografía de rayos X se ha convertido en la técnica principal para el estudio de la estructura de la materia a nivel atómico o molecular. El Año Internacional conmemora el centenario del descubrimiento de la cristalografía de rayos X, gracias a los trabajos de William Henry Bragg, William Lawrence Bragg y Max von Laue.

Retratos de William Henry Bragg, William Lawrence Bragg y Max von Laue
La cristalografía ha hecho una contribución vital para nuestra comprensión de las bases de la vida misma especialmente a través de la obra de Francis Crick y James Watson, quienes, con una valiosa contribución de la cristalógrafa Rosalind Franklin, revelaron hace unos 60 años que la estructura del ADN era una doble hélice. En los últimos 50 años, las estructuras de más de 90.000 moléculas biológicas han sido reveladas por cristalógrafos, con grandes ramificaciones para el cuidado de la salud.
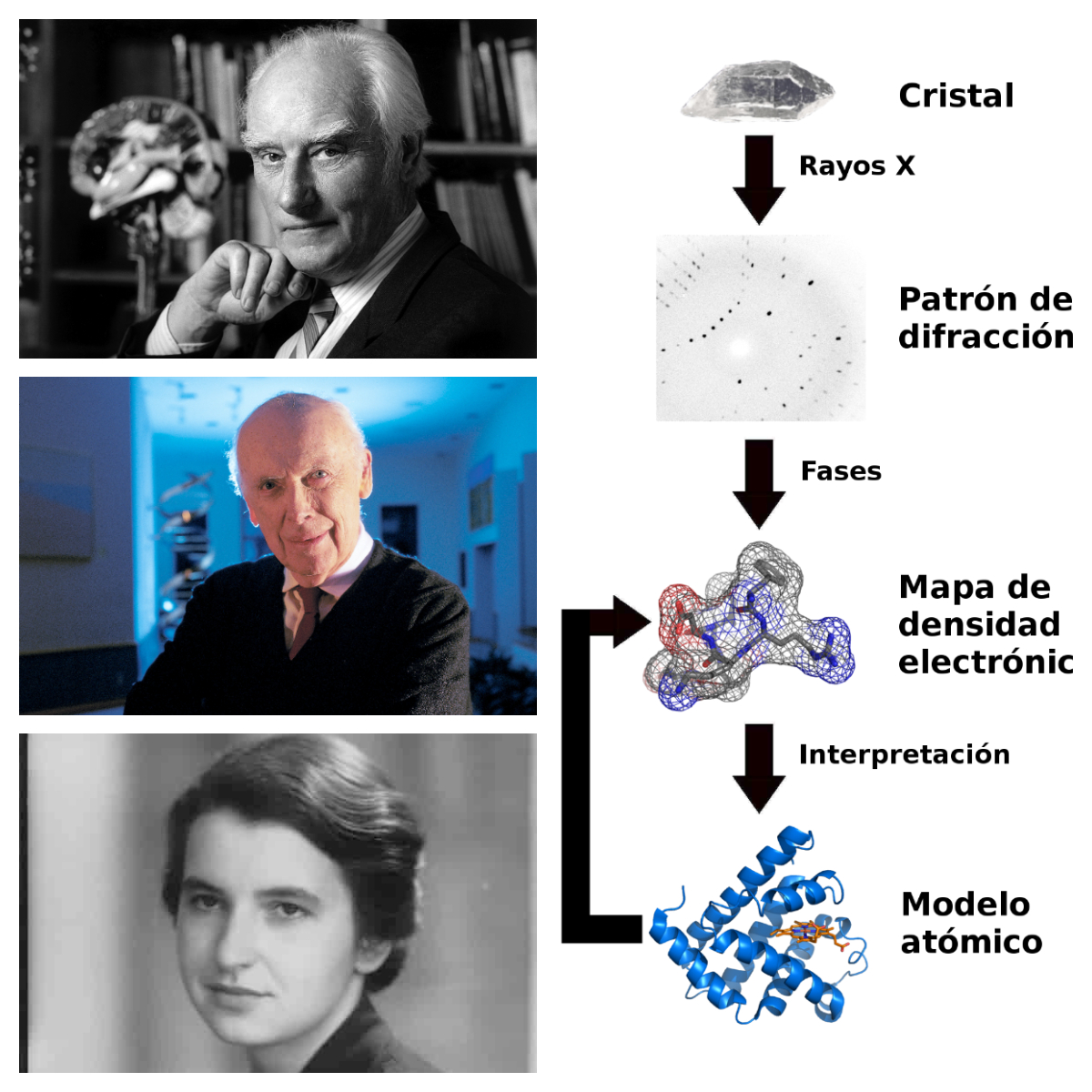
Retratos de Francis Crick, James Watson y Rosalind Franklin. Esquema de difracción de los rayos X para estudiar la estructura de un cristal
En el siguiente video puedes profundizar al respecto (el video se encuentra en inglés, recuerda activar los subtítulos y traducirlos al español, puedes repasar cómo hacerlo en el siguiente enlace):
El próximo video muestra cómo se aplica esta técnica en nuestro país:
4.2. ¿Cómo se relacionan las propiedades de los sólidos cristalinos con su composición química?
![]()
En el siguiente recurso se aborda el tema sobre la relación entre las propiedades de los sólidos cristalinos con la composición química de los mismos.
5. Para saber más... Cristalización
![]()
El siguiente recurso te permitirá:
- identificar la cristalización como una operación básica de laboratorio.
- saber cuándo aplicar esta operación.
- clasificar los tipos de cristalización en tres grupos: por variación de la temperatura de la solución saturada de la sustancia a cristalizar, por evaporación de solvente, por disminución de la solubilidad (uso de una sustancia que incorpore un ion común con la sal a precipitar o por acción de un nuevo solvente).
- conocer los diferentes pasos que se deben seguir para realizar una cristalización.
- saber cuál es el tipo de cristalización más adecuado según las características de la sustancia a cristalizar.
6. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Portal Uruguay Educa - Septiembre 2021.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Referencias bibliográficas:
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Brown, T., Le May, E., Bursten, B. y Burdge, J. (2004). Química. La Ciencia Central. (9na edición). México: Pearson Educación.
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill.
- Mahan, B. y Myers, R. (1990). Química Curso Universitario. (4ta edición). Estados Unidos: Addison Wesley Iberoamericana.
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2010). Todo se transforma. Química- 3º Año CB. Montevideo, Uruguay: Contexto.
- Segurola, B., Saravia, G., Szwarcfiter, M., Amoedo, A. y Uzal, C. (2010). Ciencias Físicas 2. Montevideo, Uruguay: Contexto.
- Unesco. (2014). Año Internacional de la Cristalografía. http://www.unesco.org/new/es/unesco/events/prizes-and-celebrations/celebrations/international-years/crystallography/
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (5ta edición). Madrid, España: Mc Graw Hill.
Videos y sitios:
- Academia Play. (28 de junio de 2017). Escala de Mohs | Dureza de los minerales [Archivo de Video]. Youtube. https://youtu.be/pv5h9K7eOwI
- Hurtado, S. (2007). Dureza. https://po4h36.wixsite.com/laboratoriovirtual/dureza
- Hurtado, S. (2006). Conductividad térmica. https://po4h36.wixsite.com/laboratoriovirtual/blank-16
- Hurtado, S. (2015). Conductividad eléctrica. https://labovirtual.blogspot.com/2015/06/conductividad-electrica.html
- Peñas. J. (2011). Conductividad térmica. Educaplus. http://www.educaplus.org/game/conductividad-termica
- Calvo, R. y Gatto, A. (2017). Conductividad eléctrica de los materiales. Portal Uruguay Educa. https://uruguayeduca.anep.edu.uy/recursos-educativos/1041
- International Union of Crystallography. (2013, 12 de diciembre). International Year of Crystallography [Archivo de Video]. Youtube. https://youtu.be/m2maeeA9z84?list=PL6UK2yPUlpxp00fAA59_Fsp_JlBKDhXpp
- PEDECIBA. (2014, 29 de octubre). ¿Qué es un cristal? [Archivo de Video]. Youtube. https://youtu.be/wDAE0pKhowI
Imágenes:
- Esfuerzo-traccion. Autor: Adre-es. Licencia: CC BY-SA 4.0.
- Esfuerzo-compresion. Autor: Adre-es. Licencia: CC BY-SA 4.0.
- Esfuerzo-torsion. Autor: Adre-es. Licencia: CC BY-SA 4.0.
- Metal. Autor: Vikki8 Pixabay. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Cerámica. Autor: sharonang Pixabay. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Botellas de vidrio. Autor: AlLes Pixabay. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Plástico. Autor: stux Pixabay. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Goma. Autor: MasterTux Pixabay. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Alambre de cobre. Autor: PublicDomainPictures Pixabay. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Madera. Autor: kaptoor Pixabay. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Corchos. Autor: pxfuel. Licencia: Free for commercial use. DMCA.
- Cables. Autor: pxfuel. Licencia: Free for commercial use. DMCA.
- Fibra de vidrio. Autor: Remux. Licencia: CC BY-SA 3.0.
- Cámara de aire. Autor: Petur p. Licencia: CC BY-SA 3.0.
- Grafito. Autor: pxhere. Licencia: CC0 Dominio público. Gratis para uso personal y comercial.
- Objetos de metal. Autor: Piqsels. Licencia: Fotos sin royalties bajo la licencia CC0, gratis para uso personal y comercial, no se requiere atribución.
- Sólidos amorfos y cristalinos. Autor: Julenkarlasaray. Licencia: CC BY-SA 4.0.
- Sistema cristalino. Autor: Daniel Mayer, Original PNGs by DrBob, traced in Inkscape by User:Stannered, Bor75. Licencia: CC BY-SA 3.0.
- Cristales de NaCl. Autor: Alessandro e Damiano. Licencia: CC BY 4.0.
- Cristales de rutilo. Autor:Materialscientist. Licencia: CC BY-SA 3.0.
- Cristales de nitrato de potasio. Autor:Adam Rędzikowski. Licencia: CC BY-SA 4.0.
- Cristal de sulfato de cobre pentahidratado. Autor: Gladys Guedes. Licencia: CC BY-SA 4.0.
- Cristal de sílice. Autor: Jan Helebrant. Licencia: CC BY-SA 2.0.
- Cristal de calcita. Autor: James St. John. Licencia: CC BY 2.0.
- Cristal de caliza. Autor: James St. John. Licencia: CC BY 2.0.
- William Bragg. Autor: Nobel foundation. Licencia: Dominio Público.
- Lawrence Bragg. Autor: Nobel foundation. Licencia: Dominio Público.
- Max von Laue. Autor: Nobel foundation. Licencia: Dominio Público.
- Francis Crick. Autor: Marc Lieberman - Siegel RM, Callaway EM: Francis Crick's Legacy for Neuroscience: Between the α and the Ω. PLoS Biol 2/12/2004: e419. https://dx.doi.org/10.1371/journal.pbio.0020419. Licencia: CC BY 2.5.
- James Watson. Autor: Cold Spring Harbor Laboratory derivative work: Jan Arkesteijn. Licencia: Dominio Público.
- Rosalind Franklin. Autor: Av Elliott & Fry/National Portrait Gallery. Licencia: CC BY-NC-ND 3.0 NO.
- Proceso de determinación de la estructura de una molécula por cristalografía de rayos X. Autor: Thomas Splettstoesser derivative work: XanaG. Licencia: CC BY-SA 3.0.
- Salt close up | Autor: André Karwath aka Aka | Licencia: CC BY-SA 2.5
- Alambre de cobre | Autor: Bicanski | Licencia: CC0 Public Domain
- Cobreado 1 | Autor: J Pimentel
- A Tube | Autor: Pslawinski | Licencia: CC BY-SA 2.5
- Silicio metálico | Autor: Rdamian1234 | Licencia: CC BY-SA 4.0
- Diodo | Autor: Willtron | Licencia: CC BY-SA 3.0