CANTIDAD QUÍMICA
| Sitio: | Aulas | Uruguay Educa |
| Curso: | LSU QUÍMICA |
| Libro: | CANTIDAD QUÍMICA |
| Imprimido por: | Invitado |
| Día: | sábado, 5 de abril de 2025, 07:05 |
1. Parte 1
SIRVASE UN MOL, POR FAVOR
En nuestra vida cotidiana estamos familiarizados con el concepto de docena, término
que se refiere a cantidad de materia, específicamente 12 unidades.
Así por ejemplo cuando compramos una docena de bizcochos o una docena de huevos,
una docena de rosas, sabemos que aunque las unidades son diferentes (bizcochos,
huevos, rosas) en los tres casos lo que es igual es la cantidad de dichas unidades
presentes.
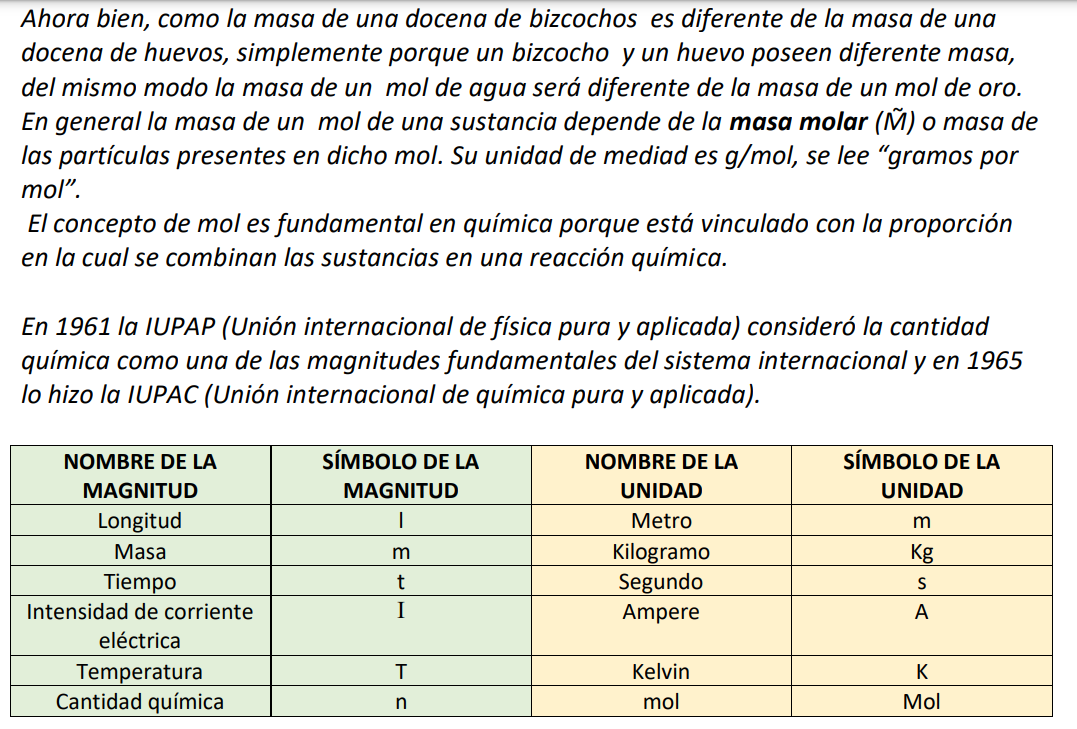
2. Parte 2
Cuando trabajamos con átomos, moléculas o iones a menudo también necesitamos
contar partículas, pero la unidad de docena es poco práctica, debido a que en general
estamos hablando de un número muy grande de partículas. En este caso se define el mol
como unidad de la magnitud “cantidad química” que cuantifica la materia. Un mol
contiene 6,02x1023
partículas (número de Avogadro). Así, por ejemplo, en un mol de
moléculas de agua (H2O) hay 6,02x1023 moléculas de agua; en un mol de oro (Au) hay
6,02x1023
átomos de oro; en un mol de iones Ca2+
hay 6,02x1023
iones de Ca2+.