Profundizando en los procesos de fusión y solidificación
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 2º B.D. |
| Libro: | Profundizando en los procesos de fusión y solidificación |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:54 |
Tabla de contenidos
1. Introducción
![]()
Como ya has repasado en el módulo Repasando los estados de agregación de la materia, las fuerzas interpartícula son responsables de la existencia de estados de agregación diferentes de la materia.
La conversión de una sustancia de un estado de agregación a otro, como la fusión del hielo, la vaporización del agua o la conversión de grafito en diamante, se denomina transición o cambio de estado de agregación. Las transiciones de fase tienen lugar a temperaturas y presiones específicas que dependen de la pureza de la sustancia.
Estos cambios de estado de agregación son cambios físicos, que se denominan como se cita a continuación:
- Sólido a líquido: Fusión
- Líquido a sólido: Solidificación
- Líquido a gaseoso: Vaporización
- Gaseoso a líquido: Condensación
En este módulo profundizaremos en los procesos de fusión y solidificación.
1.1. Ejemplo 1: Fusión y solidificación del agua
![]()
Como ya has visto en otros cursos de Química, el agua está formada por moléculas triatómicas, angulares y polares (dipolos). Las atracciones que se dan entre sus moléculas, o interacciones interpartícula, son los enlaces de hidrógeno (también conocidos como puentes de hidrógeno) que determinan las propiedades físicas del agua. Estas interacciones interpartícula hacen que el agua presente diferencias en sus propiedades frente a otras sustancias en la naturaleza y nos permite explicar por qué el hielo flota en el agua líquida.
![]()

¿Qué ocurre a nivel de partículas? Inicialmente las moléculas de agua que forman al hielo se encuentran vibrando. Cuando el hielo se funde, un 15 % de los enlaces de hidrógeno se rompen y la red rígida colapsa. Algunas moléculas están libres, en fase líquida, para entrar en los huecos de dicha red. Puedes observar esto en el siguiente video.
Cuando la temperatura alcanza el punto de fusión, las moléculas tienen energía suficiente para moverse unas por delante de otras. A esta temperatura, toda la energía agregada se usa para superar las fuerzas de atracción entre las moléculas. A nivel macroscópico se observa que el sistema va aumentando su temperatura gradualmente, luego por unos instantes la temperatura se mantiene constante, para luego comenzar a aumentar nuevamente.
Así, aunque el sistema continúe absorbiendo energía, la temperatura de la muestra de agua permanecerá constante en el punto de fusión hasta que todo el hielo se haya fundido. Solo entonces la temperatura se elevará nuevamente y la elevación continuará en ascenso hasta alcanzar el punto de ebullición. En este punto la elevación de la temperatura se detiene otra vez. Ahora las moléculas de agua tienen energía suficiente para escapar en el estado de vapor y toda la energía absorbida se emplea para formar el vapor. Después de que la muestra se ha vaporizado y continúa la absorción de energía, la temperatura del vapor se eleva nuevamente.
![]()
Por encima de 4 ºC la energía cinética de las moléculas de agua permite que se formen y rompan los enlaces de hidrógeno entre las mismas rápidamente. Pero por debajo de esta temperatura, la energía cinética de las moléculas de agua decae por debajo de la energía necesaria para formarse un enlace de hidrógeno, por tanto estos enlaces se forman con mucho más frecuencia de los que se rompen y esto hace que las moléculas adopten una estructura de huecos hexagonales entre las mismas, como puedes ver en la siguiente figura,
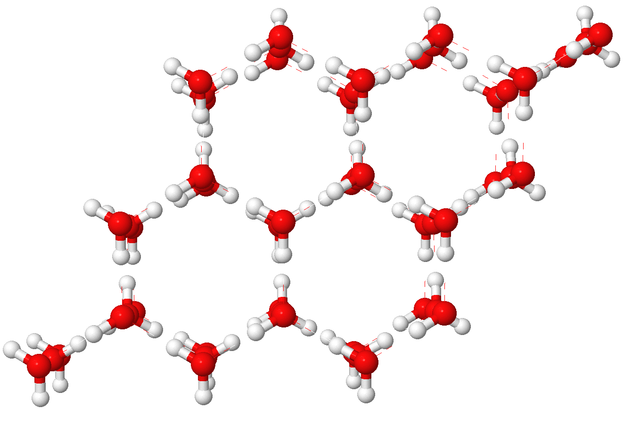
Un líquido se solidifica (congela) cuando sus partículas tienen energías tan bajas que son incapaces de deslizarse por fuera de los límites de sus vecinas. En el sólido, las partículas vibran en torno a sus posiciones promedio pero rara vez se mueven de un lugar a otro.
1.2. Ejemplo 2: Fusión y solidificación del naftaleno
![]()
Seguramente habrás escuchado hablar de la bolitas de naftalina que se usa para ahuyentar polillas. Están compuestas por naftaleno, un sólido cristalino del tipo sólido molecular (puedes repasar los tipos de sólidos cristalinos en el siguiente recurso), cuya fórmula química es C10H8. Uno de los principales usos del naftaleno actualmente es la manufactura de un polímero sintético o plástico llamado cloruro de polivinilo (PVC).

![]()
Observa en el siguiente video como inicialmente se funde el naftaleno y luego se solidifica con la ayuda de un cono de papel.
A continuación se puede observar la estructura de una molécula de naftaleno.
Las fuerzas interpartícula presentes entre las moléculas de naftaleno son dipolo instantáneo - dipolo instantáneo (también conocidas como fuerzas de dispersión o de London). Estas interacciones son bastante débiles en comparación con otras fuerzas interpartícula (entre 1 y 3 kcal son necesarias para romper un mol de estas interacciones). Esto explica porqué, a pesar de tener una masa molar considerable (128 g/mol), el PF normal del naftaleno es de solamente 80,3 °C.
2. Curvas de calentamiento y enfriamiento
Es posible estudiar cuantitativamente el proceso de fusión o solidificación de una muestra e ir registrando la temperatura del sistema a distintos intervalos de tiempo. Con los datos obtenidos se puede construir una gráfica que represente estos procesos.
![]()
Una curva de calentamiento es una gráfica que permite observar la variación de la temperatura de una muestra a medida que el sistema absorbe energía a un ritmo y presión constantes (proceso endotérmico).
![]()
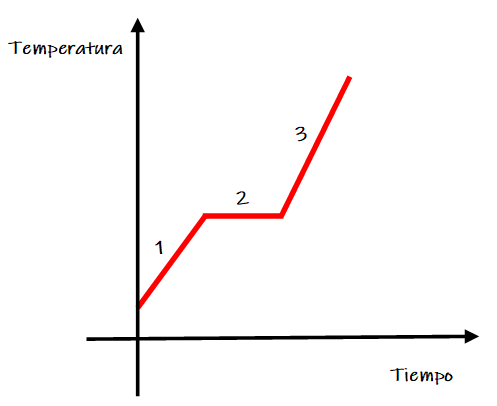
- Análisis macroscópico:
Al observar la gráfica de fusión se observan las siguientes zonas:
Zona 1. Aumenta la temperatura de la muestra sólida.
Zona 2. Se produce el cambio de estado de agregación de sólido a líquido, durante este intervalo de tiempo coexisten ambos estados físicos (sólido y líquido) y la temperatura permanece constante.
Zona 3. La muestra se encuentre en estado líquido y aumenta su temperatura.
La temperatura de la zona 2 se corresponde al punto de fusión de la sustancia. Por encima o por debajo de esta temperatura, todo el sistema se encuentra en un único estado de agregación.
- Análisis a nivel de partículas:
Zona 2. En el momento que algunas de las partículas del sólido tienen suficiente energía para vencer las fuerzas de atracción que las mantienen unidas, comienza el cambio de estado, es decir la fusión. Macroscópicamente la temperatura no varía porque la energía absorbida por las partículas es usada para vencer dichas fuerzas atractivas y no para aumentar su movimiento.
Zona 3. Las partículas continúan aumentando su energía cinética y pueden realizar movimientos de vibración, rotación y traslación.
![]()
Una curva de enfriamiento es una gráfica que permite observar la variación de la temperatura de una muestra a medida que el sistema libera energía a un ritmo y presión constantes (proceso exotérmico).
![]()
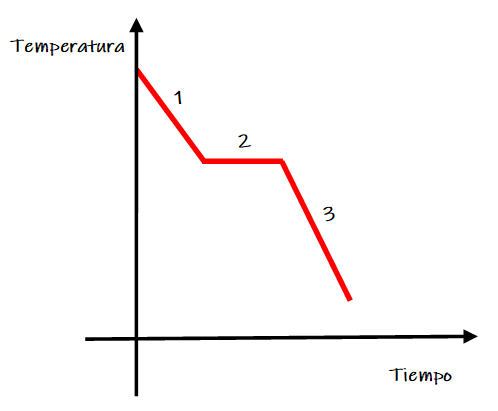
- Análisis macroscópico:
Al observar la gráfica de solidificación se observan las siguientes zonas:
Zona 1. Disminuye la temperatura de la muestra líquida.
Zona 2. Se produce el cambio de estado de agregación de líquido a sólido, denominado solidificación. Durante este intervalo de tiempo coexisten ambos estados físicos (líquido y sólido) y la temperatura permanece constante.
Zona 3. La muestra se ha solidificado y su temperatura desciende.
La temperatura de la zona 2 se denomina punto de solidificación.
- Análisis a nivel de partículas:
Zona 2. En el momento que algunas de las partículas de la muestra disminuyen su energía cinética por debajo de la energía necesaria para formarse las interacciones interpartícula, estas interacciones se forman con más frecuencia de lo que se rompen.
Zona 3. Las partículas continúan disminuyendo su energía cinética y pueden realizar movimientos de vibración sin cambiar su posición.
![]()
El punto de fusión (PF) de un sólido cristalino es la temperatura a la que un sólido se encuentra en equilibrio dinámico con su propio líquido a cierta presión.
El punto de solidificación (PS) o congelación es la temperatura a la cual los estados líquidas y sólidas están en equilibrio dinámico, varía levemente a medida que cambia la presión.
Para una misma sustancia, en iguales condiciones de presión, el punto de fusión es igual al punto de solidificación. El nombre solamente depende de en qué sentido se está dando el cambio.
Si la presión es de 1 atm (atmósfera) se denomina punto de fusión normal. Lo mismo ocurre para el caso del punto de solidificación normal.
Para conocer el punto de fusión o solidificación de una sustancia se puede recurrir a una curva de calentamiento o enfriamiento e identificar la zona de la gráfica denominada meseta, en la que la temperatura de la muestra no varía.
3. ¿Cambios de estado o cambios de fase?
Como ya has estudiado en cursos anteriores de Química podemos clasificar a los sistemas en homogéneos y heterogéneos según el número de fases. Una fase es cualquier porción de un sistema en la que cada propiedad intensiva tiene un único valor. Analicemos los siguientes ejemplos.
Ejemplo 1:

El sistema se encuentra formado por dos fases: aceite y agua. Ambas fases se encuentran en estado de agregación líquido, formando un sistema heterogéneo.
Ejemplo 2:

El sistema se encuentra formado por dos fases: hielo y agua líquida. Las fases se encuentran en estado de agregación sólido en el caso del hielo y líquido en el caso del agua.
Ejemplo 3:

En este caso el sistema está formado por dos fases del carbono (grafito y diamante) en un mismo estado de agregación, sólido.
Muchas sustancias tienen más de una fase sólida, con arreglos
diferentes de sus partículas. Por ejemplo, el carbono tiene varias fases
sólidas; una es el diamante y otra es el grafito.
Hemos analizado que se puede pasar de la fase sólida a la líquida de una sustancia y viceversa, y cuando ambas se encuentran en equilibrio dinámico se denomina fusión o solidificación, según sea la dirección del cambio. También existe la posibilidad de transformar una fase de carbono, como el grafito, a otra, como el diamante, en ciertas condiciones de temperatura y presión.
![]()
¿Es lo mismo un cambio de fase que un cambio de estado de agregación? Un cambio de estado es siempre un cambio de fase, pero un cambio de fase puede no ser un cambio de estado. Por ejemplo la transformación que analizamos anteriormente, de carbono grafito a diamante, es un cambio de fase pero no un cambio de estado de agregación, ya que ambas son fases sólidas del carbono.
4. Cambios de fases en relación con la temperatura y la presión: Diagramas de fases
![]()
Un diagrama de fases es un mapa que muestra cuál es la fase más estable a diferentes presiones y temperaturas en un sistema cerrado.
Las líneas que separan las regiones en el diagrama se denominan límites de fase, en cualquier punto sobre un límite entre dos regiones, las dos fases vecinas coexisten en equilibrio dinámico.
El diagrama es una gráfica bidimensional, con presión y temperatura en los ejes, y contiene tres curvas importantes, cada una de las cuales representa las condiciones de temperatura y presión en las que las distintas fases pueden coexistir en equilibrio. La única sustancia presente en el sistema es aquella cuyo diagrama de fases se está considerando. La presión que se indica en el diagrama es la que se aplica al sistema o la que la sustancia misma genera.
Comúnmente el diagrama de fases no se encuentra a escala.
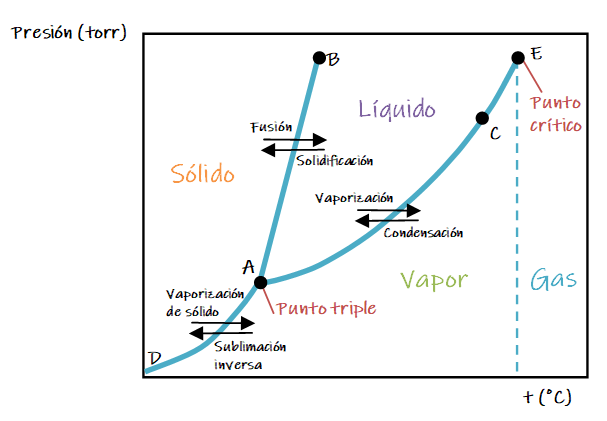
A continuación se representa una diagrama de fases general.
![]()
Las curvas pueden describirse como sigue:
1. La línea de A a C (AC) es la curva de presión de vapor del líquido; representa el equilibrio entre las fases líquida y vapor. El punto de esta curva en el que la presión de vapor es de 1 atm es el punto de ebullición normal de la sustancia. La curva de presión de vapor termina en el punto crítico (E), que está en la temperatura crítica y la presión crítica de la sustancia. Más allá del punto crítico, no es posible distinguir las fases líquida y gaseosa.
2. La línea AD representa la variación de la presión de vapor del sólido al sublimarse a diferentes temperaturas.
3. La línea AB representa el cambio del punto de fusión del sólido al aumentar la presión. Esta línea suele tener una pequeña pendiente hacia la derecha al aumentar la presión porque, para la mayoría de las sustancias, el sólido es más denso que el líquido. Un aumento en la presión por lo regular favorece la fase sólida, más compacta; por ello, se requieren temperaturas más altas para fundir el sólido a presiones más altas. El punto de fusión de una sustancia es igual a su punto de solidificación. La única diferencia entre los dos es la dirección desde la que nos aproximamos al cambio de fase. El punto de fusión a 1 atm es el punto de fusión normal.
El punto A, donde se intersecan las tres curvas, se conoce como punto triple. A esta temperatura y presión, las tres fases están en equilibrio.
Cualquier otro punto de las tres curvas representa un equilibrio entre dos fases. Cualquier punto del diagrama que no cae en una línea corresponde a condiciones en las que solo está presente una fase. La fase vapor, por ejemplo, es estable a baja presión y alta temperatura, mientras que la fase sólida es estable a temperaturas bajas y presiones altas. Los líquidos son estables en la región entre las otras dos.
4.1. Ejemplo 1: Diagrama de fases parcial del agua
![]()
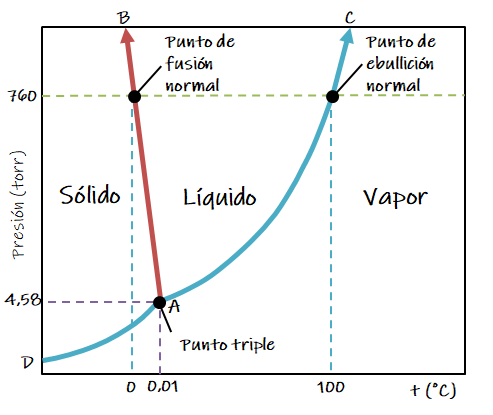
El límite sólido-líquido muestra las presiones y temperaturas a las cuales el agua sólida y líquida coexisten en el equilibrio (AB). En otras palabras, cómo el punto de fusión varía con la presión. La pendiente de las líneas indica que incluso grandes cambios en la presión provocan una variación pequeña del punto de fusión.
En el caso del agua y de unos pocos líquidos en los cuales el sólido es menos denso que el líquido, la línea de equilibrio sólido-líquido (AB) tiene pendiente negativa; esto es, hacia arriba y a la izquierda.
Un punto triple es un punto donde se encuentran los límites de tres fases. Para el agua, el punto triple para las fases sólidas, líquidas y vapor está a 4,6 torr y 0,01 °C. En el punto triple, las tres fases (hielo, líquido y vapor) coexisten en equilibrio dinámico. Un cambio en la temperatura o la presión trae aparejada la pérdida de una de las fases. Observa el siguiente video:
4.2. Ejemplo 2: Diagrama de fases parcial del dióxido de carbono
![]()
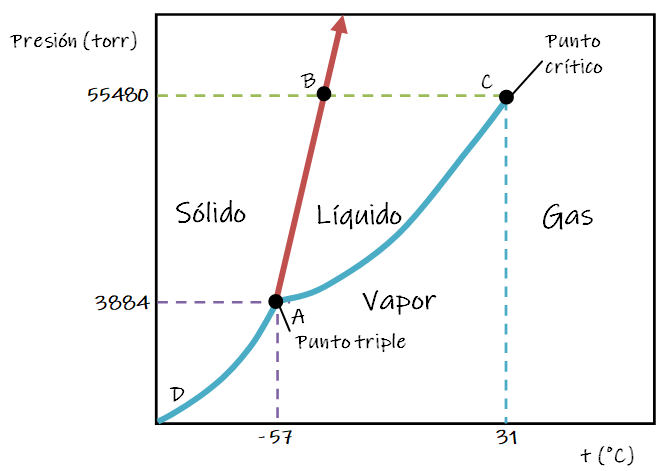
En el diagrama de fases parcial del dióxido de carbono, es posible ver que la curva (AB) corresponde a las diferentes condiciones de equilibrio dinámico entre sólido y líquido, o lo que es lo mismo, distintas temperaturas de fusión a diferentes presiones. La curva (AC), corresponde a diferentes condiciones de equilibrio dinámico entre líquido y vapor, es decir distintas temperaturas de ebullición a diferentes presiones. La curva (AD), corresponde a diferentes condiciones de equilibrio dinámico entre sólido y vapor, o lo que es lo mismo distintas temperaturas de sublimación a diferentes presiones. El punto de corte de las tres curvas, (A), corresponde a las condiciones del punto triple sólido-líquido-vapor.
En el caso del dióxido de carbono el sólido es más denso que el líquido, la línea de equilibrio sólido-líquido (AB) tiene pendiente positiva, esto es, arriba y a la derecha. Esto es cierto para casi todas las sustancias.
A presiones por debajo de la presión del punto triple, la fase líquida no existe; en su lugar, la sustancia pasa de manera directa de sólido a vapor o bien ocurre lo contrario (se depositan cristales del gas). A temperaturas y presiones a lo largo de AD, el sólido y el vapor están en equilibrio. En el siguiente video puedes observar lo que ocurre cuando se coloca un trozo de hielo seco (dióxido de carbono sólido) en un matraz Erlenmeyer que contiene agua a temperatura ambiente.
El punto triple tiene lugar a una presión de 3884 torr y - 57 °C. Esta presión es superior a la presión atmosférica, por lo que el dióxido de carbono líquido no puede existir
a presión atmosférica.
El punto C, cuyas coordenadas son: P = 55480 torr y t = 31°C, se denomina punto crítico, y sus coordenadas se denominan presión crítica y temperatura crítica respectivamente. Ambas corresponden a las máximas presión y temperatura a la que pueden coexistir en equilibrio dinámico un líquido con su propio vapor. En dichas condiciones, el vapor se encuentra tan comprimido que su densidad se iguala con la del líquido, por lo cual la interfase líquido-vapor desaparece.
4.3. ¿Gas o vapor?
![]()
A temperaturas inferiores a la temperatura crítica se habla de vapor, y a temperaturas superiores a la crítica se habla de gas.
Macroscópicamente, la diferencia entre ambos radica en que el vapor es pasible de ser llevado a una fase condensada por compresión, mientras que el gas no. En el caso del gas, superada la presión crítica se ingresa en el fluido supercrítico, cuya densidad es similar a la de un líquido, fruto de la alta compresión, pero su fluidez o viscosidad es similar a la de un gas.
A nivel de partículas, la temperatura crítica marca una frontera energética. Por encima de esta, la energía cinética que poseen las partículas ya es tan elevada, que resulta imposible que actúen las fuerzas de atracción entre ellas, por más que se las aproxime mecánicamente. De ahí las propiedades tan particulares de los fluidos supercríticos.
Cuando un sólido o un líquido pasa a estado gaseoso, inicialmente lo que genera es un vapor, y dependerá de su temperatura crítica y de la temperatura a la que llegue si permanece como tal o termina como un gas.
5. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Portal Uruguay Educa - Septiembre 2022.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Referencias bibliográficas:
- Amy, J. (2021). Imprecisiones conceptuales en el abordaje de los cambios de fases.
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Atkins. P. y Jones, L. (2012). Principios de Química. Los caminos del descubrimiento. (5ta edición). Editorial Panamericana.
- Brown, T., Le May, E., Bursten, B. y Burdge, J. (2004). Química. La Ciencia Central. (9na edición). Pearson Educación.
- Gatto, A. y García, M. (2017). Módulo 3: Molécula de agua. Portal Uruguay Educa. http://aulas.uruguayeduca.edu.uy/course/view.php?id=98§ion=5
- Gatto, A. y García, M. (2017). Módulo 4: Puente de hidrógeno. Portal Uruguay Educa. http://aulas.uruguayeduca.edu.uy/course/view.php?id=98§ion=6
- Gatto, A. y García, M. (2017). Módulo 5: Fases del agua. Portal Uruguay Educa. http://aulas.uruguayeduca.edu.uy/course/view.php?id=98§ion=7
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2010). Todo se transforma. Química- 3º Año CB. Contexto.
- Segurola, B., Saravia, G., Szwarcfiter, M., Amoedo, A. y Uzal, C. (2010). Ciencias Físicas 2. Contexto.
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (5ta edición). Mc Graw Hill.
- Whitten, K., Davis, R., Peck, M. y Stanley, G. (2015). Química. (10a edición). Cengage Learning
Videos y sitios:
- Amy, J. Cátedra Alicia Goyena. (13 de octubre de 2020). IMPRECISIONES CONCEPTUALES ACERCA DEL TEMA CAMBIOS DE ESTADO [Archivo de Video]. Youtube. https://youtu.be/v-GxOitQvok
- Scott Warren (15 de enero de 2020). Melting of ice to liquid water - molecular dynamics simulation [Archivo de Video]. Youtube. https://youtu.be/3xaZwbKyYdM
- TED-Ed en Español. (3 de noviembre de 2015). ¿Por qué el hielo flota en el agua? - George Zaidan y Charles Morton [Archivo de Video]. Youtube. https://youtu.be/iqeaKpAEbyA
- UCSC Physics. (13 de mayo de 2018). Triple Point of Water [Archivo de Video]. Youtube. https://youtu.be/Juz9pVVsmQQ
- Edelvives Argentina (2 de marzo de 2016). Notas de laboratorio 2. Cambios de estado de la naftalina [Archivo de Video]. Youtube. https://youtu.be/nTswg6e2544
- Turtle Rock Scientific. (19 de agosto de 2017). Dry Ice Sublimating [Archivo de Video]. Youtube. https://youtu.be/8Gj8dr6AsYg. Copyright 2017 Turtle Rock Scientific.
- Lerma. J. R. (2018). Temperatura de molde (V). Interempresas. https://www.interempresas.net/Plastico/Articulos/227098-Temperatura-de-molde-(V).html
Imágenes:
- Estados de agregación. Autor: Freepik. Licencia: Free for personal and commercial purpose with attribution.
- Gif Fusión del hielo. Autor: Giphy.
- Agua y aceite. Autor: Victor Blacus. Licencia: CC BY-SA 4.0.
- Hielo y agua. Autor: PPD Pixinio. Licencia: Libre de usar CC0.
- Grafito y diamante. Autor: Uxueq. Licencia: CC BY-SA 4.0.
Diamante. Autor: 52663. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Grafito. Autor: Robert Lavinsky. Licencia: CC BY-SA 3.0.
- Ice XI View along c axis. Autor: Danski14. Licencia: CC BY-SA 3.0.
- Diagrama de fases general. Autora: Anarella Gatto. Licencia: CC BY-SA 4.0. Elaborado en base a figura 11.26 de Brown, T., Le May, E., Bursten, B. y Burdge, J. (2004). Química. La Ciencia Central. (9na edición). Pearson Educación.
- Diagramas de fases parcial del agua y del dióxido de carbono. Autora: Anarella Gatto. Licencia: CC BY-SA 4.0. Elaborado en base a figura 13.17 de Whitten, K., Davis, R., Peck, M. y Stanley, G. (2015). Química. (10a edición). Cengage Learning.
- Naftalina. Autor: Farmercarlos. Licencia: Dominio Público.
- Estructura del naftaleno. Autor: Ben Mills. Licencia: Dominio público.
- Estructura del naftaleno 2. Autor: Emeldir. Licencia: Dominio público.