Profundizando en las variables de estado
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 2º B.D. |
| Libro: | Profundizando en las variables de estado |
| Imprimido por: | Invitado |
| Día: | miércoles, 2 de abril de 2025, 22:30 |
1. ¿Aire comprimido como combustible?
![]()
Seguramente, ninguno de los químicos que investigaron las características del aire en el siglo XVIII sospecharon que, apenas dos siglos después, el aire (pero comprimido) era capaz de hacer funcionar el motor de un auto.
En 1991, el ingeniero francés Guy Négre creó la sociedad Moteur Development International (MDI) y desarrolló lo que en un futuro inmediato podría convertirse en uno de los mayores avances tecnológicos del siglo XX: el motor de aire comprimido.
Observa el siguiente video (se encuentra en inglés, para activar los subtítulos y traducirlos al español visita el siguiente enlace).
¿Cómo funciona ese motor? Simplemente con el aire extraído de la atmósfera, previamente comprimido y alojado en cilindros. Las condiciones de utilización son una presión efectiva máxima de 300 bares (1 atm = 1,013 bares) a una temperatura entre - 40 y 60 °C.
Cuando el motor esté popularizado, las posibilidades para comprimir el aire serán dos: en una estación de servicio equipada con un compresor de alta presión. Allí, y en apenas dos o tres minutos el cilindro de aire comprimido estará recargado. La segunda alternativa será comprar un auto con compresor incorporado que permitirá conectarlo a la red eléctrica y cargar el depósito en tres o cuatro horas.

En ambos casos, antes de comprimir el aire será necesario filtrarlo para quitarle todo tipo de impurezas que podrían dañar el compresor o el motor. Para ello, pueden usarse filtros de tipo carbónico que eliminan la suciedad, humedad, polvo y las numerosas partículas abrasivas que contiene el aire de nuestras ciudades. Por otra parte, el caño de escape de los vehículos Compressed Air Techonology Systems, CAT´s, en vez de emitir suciedad y gases quemados a la atmósfera, producirán aire limpio que saldrá entre -15 y 0 °C, lo que permitirá reutilizarlo para el aire acondicionado interior sin necesidad de gases ni pérdida de potencia.
En definitiva, la aplicación de motores MDI a los vehículos CAT´s aportará grandes ventajas económicas y ambientales. Con la incorporación de la bioenergía (aire comprimido y combustible), además de la monoenergía (solo aire comprimido), estos vehículos tendrán su autonomía hasta cerca de los 2000 km, con una contaminación nula en la ciudad y muy reducida en las rutas.

2. Introducción a las variables de estado
El estado de agregación más estudiado es el gaseoso. Ya hemos analizado qué características presenta a simple vista (nivel macroscópico) así como a nivel de partículas (corpuscular). En este módulo abordaremos las variables de estado.
![]()
Las variables de estado son las magnitudes que se emplean para describir el estado de un sistema termodinámico. Dependiendo de la naturaleza del sistema termodinámico objeto de estudio, pueden elegirse distintos conjuntos de variables termodinámicas para describirlo. En el caso de un gas, estas variables son:
- temperatura,
- cantidad química,
- volumen y
- presión.
A continuación analizaremos cada una de ellas.
2.3. Volumen
![]()
El volumen de un cuerpo es una magnitud que nos permite conocer cuánto "lugar" ocupa en el espacio. Todos los cuerpos presentan esta propiedad así sean sólidos, líquidos o gaseosos, es decir, sin importar su estado físico tienen volumen.
A esta magnitud la representamos como V y en el Sistema Internacional de Unidades su unidad de medida es el metro cúbico (m3).
![]()
dm3 - decímetro cúbico
cm3 - centímetro cúbico
L - litro
mL - mililitro
1 m3 = 1000 dm3
1 m3 = 1.000.000 cm3
Generalmente cuando queremos medir volúmenes de sustancias líquidas o gaseosas se utiliza como unidad el litro (L). Cuando se expresa la capacidad de un recipiente, por ejemplo una heladera o un microondas, también se utiliza el litro.
1 m3 = 1000 L
1 dm3 = 1 L
1 cm3 = 1 mL
En nuestro país solemos utilizar comúnmente el litro como unidad de volumen, pero es común que en otros países se emplee el galón. ¿Cuál es la equivalencia entre ambas unidades? 1 gal = 3,785 L (aproximadamente). En la imagen que se encuentra a continuación puedes ver un envase que contiene un galón de agua y un galón de leche.

![]()
En el caso de sustancias en estado gaseoso es posible establecer una relación entre la cantidad química y el volumen. Existe una relación de proporcionalidad directa entre el volumen de un cuerpo en estado gaseoso y la cantidad química que lo constituye.
Considerando que el volumen de las sustancias en estado gaseoso varía según la temperatura y la presión se han fijado ciertos valores de esas magnitudes como referencia. Se denominan condiciones normales (CN) o presión y temperatura normal (PTN) a la temperatura de 0 °C y a la presión de 1 atm. En esas condiciones el volumen de un mol de cualquier gas es 22,4 L, llamado Volumen Molar (![]() ).
).
El Volumen Molar es el volumen ocupado por 1 mol de gas a la presión de 1 atm y a la temperatura de 0 ºC (273 K). Su valor es el mismo para cualquier gas o mezcla gaseosa (22,4 L/mol) y se simboliza V.
La proporcionalidad directa entre cantidad química y volumen de un gas a PTN queda determinada en la expresión matemática:
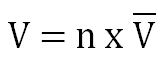
donde V representa el volumen, n la cantidad química y V el Volumen Molar a PTN.
Es posible calcular cantidad química con la expresión matemática:
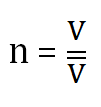
2.4. Presión
![]()
Recorre el siguiente recurso interactivo que incluye actividades breves que puedes ir resolviendo.
3. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Portal Uruguay Educa - Octubre 2022.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Referencias bibliográficas:
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Atkins. P. y Jones, L. (2012). Principios de Química. Los caminos del descubrimiento. (5ta edición). Editorial Panamericana.
- Brown, T., Le May, E., Bursten, B. y Burdge, J. (2004). Química. La Ciencia Central. (9na edición). Pearson Educación.
- Martín Blas, T. y Serrano Fernández, A. (2014). Variables termodinámicas. Universidad Politécnica de Madrid (UPM). https://www2.montes.upm.es/dptos/digfa/cfisica/termo1p/variables.html#:~:text=Las%20variables%20termodin%C3%A1micas%20o%20variables,de%20variables%20termodin%C3%A1micas%20para%20describirlo.
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2010). Todo se transforma. Química- 3º Año CB. Contexto.
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Contexto.
- Segurola, B., Saravia, G., Szwarcfiter, M., Amoedo, A. y Uzal, C. (2010). Ciencias Físicas 2. Contexto.
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (5ta edición). Mc Graw Hill.
- Whitten, K., Davis, R., Peck, M. y Stanley, G. (2015). Química. (10a edición). Cengage Learning
Videos y sitios:
- UN DESA Sustainable Development (16 de diciembre de 2016). Motor Development International SA (MDI SA), Finalist for UN Energy Grant 2016 [Archivo de Video]. Youtube. https://youtu.be/ZHmUmqxXeQ0
Imágenes:
- Tata/MDI OneCAT. Autor: Deepak Gupta. Licencia: CC BY-SA 4.0.
- MDI AirPod at the 2009 Geneva Motor Show. Autor: El monty. Licencia: CC BY-SA 3.0.
- Milk jugs in a row. Autor: ChildofMidnight. Licencia: CC BY-SA 3.0.
- Bidón de agua. Autor: pxhere. Licencia: CC0 Dominio publico. Gratis para uso personal y comercial.