¿Qué es el equilibrio químico?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué es el equilibrio químico? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 00:55 |
Tabla de contenidos
- 1. Berthollet y su viaje a Egipto
- 2. Introducción
- 3. Algunas características de los cambios químicos
- 4. Ejemplo 1: Cromato y dicromato
- 5. Reacciones que habitualmente se completan
- 6. Reacciones incompletas o que habitualmente no se completan
- 7. ¿Equilibrio?
- 8. Equilibrio químico
- 9. "Pan a partir del aire"
- 10. Créditos
1. Berthollet y su viaje a Egipto
![]()
En su viaje a Egipto, como miembro de la expedición organizada por Napoleón en 1798, Berthollet observó la formación de carbonato de sodio (conocido como sosa Solvay, natrón, sosa Ash, ceniza de soda o simplemente sosa) en las orillas de los lagos localizados cerca de El Cairo.

Imagen 1. Natrón observado en el suelo en una caldera del Monte Emi Koussi en Chad.
Interpretó la inesperada formación de esa sustancia a partir de carbonato de calcio, según la reacción representada por la ecuación (opuesta al sentido establecido por las tablas de afinidad):
CaCO3 + 2 NaCl → CaCl2 + Na2CO3
considerando como factores determinantes de la reacción las grandes cantidades presentes de los dos reactivos, así como la continua separación de los dos productos (el carbonato de sodio formaba una costra en la orilla del lago y el cloruro de calcio se filtraba por el suelo). Es decir, introdujo el factor masa como nueva circunstancia a tener en cuenta, señalando que grandes cantidades de reactivos podían compensar y, por tanto, invertir, el orden establecido por la teoría de las afinidades químicas. Así, si dos sustancias compiten para combinarse con una tercera sustancia por la que tienen afinidades desiguales, una cantidad relativamente grande de la sustancia con afinidad más débil puede ejercer una fuerza que puede superar la fuerza de la sustancia con mayor afinidad. Además, estimó que una reacción química de desplazamiento nunca era completa, ya que se ponían en juego dos elementos contrapuestos: la afinidad y las cantidades de las sustancias puestas a reaccionar, llegándose a alcanzar finalmente un equilibrio estático entre estas dos “fuerzas” opuestas. Se trataba, en definitiva, de extender el paradigma newtoniano al caso de las reacciones químicas.
Berthollet enseñó estas nuevas ideas en sus clases de la École Normale y las publicó en varios artículos y en dos libros: Recherches sur les lois de l’affinité (1801) y Essai de Statique Chimique (1803). Su pretensión (newtoniana) de establecer relaciones cuantitativas a la hora de explicar y de predecir el curso de una reacción química no lo pudo culminar con éxito. En cualquier caso, entre los factores que no permitieron el desarrollo inicial de las ideas de Berthollet destaca la amplia adhesión a las tablas de afinidad de los químicos de la época, el escaso número inicial de reacciones en las que se podía poner de manifiesto el factor masa, así como el pequeño interés que despertó esta línea de investigación.
- ¿Qué fue lo que sorprendió a Berthollet en su viaje a Egipto?
- Busca información sobre la tabla de afinidad creada por Geoffroy y presentada en 1718 a la Academia de Ciencias en París. ¿Para qué la usaban los científicos de la época?
- ¿Cómo explicas la siguiente frase: "Berthollet consideró que el factor masa podía invertir el sentido establecido por las tablas de afinidad"?
- ¿Qué obstáculos tuvo la propuesta de Berthollet?
- ¿Qué influencia piensas que tuvo la política en el desarrollo de las ideas de Berthollet? ¿Piensas que actualmente la política influye en las investigaciones científicas? ¿Cómo lo explicas?
2. Introducción
![]()
La producción industrial del amoníaco a partir de dinitrógeno y dihidrógeno les valió el premio Nobel a los inventores (Fritz Haber y Carl Bosch) dada la relevancia desde un punto de vista agronómico. El amoníaco es utilizado para la fabricación de fertilizantes nitrogenados como la urea y el nitrato de amonio. La ecuación que representa la formación del compuesto es la siguiente: N2 (g) + 3 H2 (g) → 2 NH3 (g). Desde un principio, los creadores del proceso Haber-Bosch tuvieron que enfrentarse a lo que en un principio pareció un problema: no todo el dihidrógeno y dinitrógeno que colocaban como reactivos se transformaba en producto.
- ¿Cuál piensas que es la razón por la que se daba esta situación? Escribe tu respuesta incluyendo dos razones que la fundamenten.
- Si tienes la posibilidad de compartirla con otro compañero, comparen ambas respuestas y analicen las razones que han planteado, ¿coinciden?, ¿se complementan?, ¿se contradicen?, ¿a qué conclusiones llegan luego de intercambiar sus ideas?
3. Algunas características de los cambios químicos
![]()
Como ya has visto en cursos anteriores, podemos clasificar a los cambios o transformaciones que sufre la materia como físicos o químicos. Siendo los cambios físicos aquellos en los que la composición química del sistema sigue siendo la misma, por ejemplo la fusión del hielo, mientras que en los cambios químicos se transforma la composición del sistema, formándose nuevas sustancias, por ejemplo la corrosión del hierro.

En esta oportunidad profundizaremos en los cambios químicos.
![]()
Analicemos un ejemplo: la electrólisis del agua. Mediante el pasaje de corriente eléctrica se produce la descomposición del agua líquida y se obtienen dos sustancias diferentes en estado gaseoso: dihidrógeno y dioxígeno. Observa este proceso en el siguiente video.
En los cambios químicos las sustancias cambian pero los elementos se conservan. Es decir las sustancias iniciales y las finales están formadas por los mismos elementos. Los átomos de los elementos que intervienen se reordenan dando lugar a la formación de sustancias distintas a las iniciales. En el ejemplo analizado se parte inicialmente de agua H2O, en donde cada molécula está formada por 2 átomos de hidrógeno y 1 de oxígeno, y luego de la descomposición se obtienen dos sustancias simples denominadas dihidrógeno H2 y dioxígeno O2, en las que cada molécula está formada por dos átomos de hidrógeno y dos átomos de oxígeno respectivamente.
A nivel macroscópico en un sistema cerrado la masa se conserva aunque se produzcan cambios físicos o químicos (Ley de Lavoisier). Realizando un análisis de la Ley de Lavoisier en base al modelo de partículas, si la masa se conserva en los cambios químicos podemos suponer que se conserva el número de átomos de cada elemento. Esto implica que se rompen las uniones entre los átomos en las moléculas iniciales, en el ejemplo analizado los enlaces oxígeno-hidrógeno, se produce luego un reordenamiento de estos átomos y por último se establecen uniones entre ellos (enlace oxígeno-oxígeno y enlace hidrógeno-hidrógeno), formando moléculas diferentes.
Las transformaciones o cambios químicos suelen denominarse reacciones químicas. Algunos autores prefieren esta expresión para referirse a las interpretaciones de estos cambios realizadas con el modelo de partículas.
![]()
Las ecuaciones químicas simbolizan los cambios en la materia y aportan información de las sustancias que intervienen en dos aspectos:
- cualitativo: indica cuáles reaccionan (denominados reactivos) y cuáles se producen (llamados productos), y sus estados de agregación.
- cuantitativo: expresa las proporciones entre ellas (a partir de los coeficientes estequiométricos).
La siguiente ecuación química representa la electrólisis del agua:
2 H2O (l) → 2 H2 (g) + O2 (g)
En este caso el agua líquida es el reactivo y los productos son dihidrógeno y dioxígeno gaseosos.
La información aportada por las ecuaciones químicas, en términos de cantidad química (n), permite establecer la proporción molar en que se combinan las sustancias reaccionantes y se forman las sustancias resultantes. Estas proporciones no se modifican aunque se cambien las cantidades que se colocan a reaccionar. A partir de los coeficientes estequiométricos del ejemplo, podemos afirmar que dos moles de agua líquida se descomponen formando dos moles de dihidrógeno gaseoso y un mol de dioxígeno gaseoso. En el video se puede observar esta relación en el volumen de gas recogido por desplazamiento de agua en cada tubo invertido.
4. Ejemplo 1: Cromato y dicromato
A continuación podrás analizar cuatro ejemplos de cambios químicos.
![]()
El ion cromato (CrO42-) se puede transformar en dicromato (Cr2O72-) según el pH del medio y este cambio se puede observar macroscópicamente ya que la solución cambia de color amarillo a anaranjado respectivamente. Observa el próximo video y luego contesta las preguntas que se encuentran a continuación.
4.1. Ejemplo 2: Complejos de cobalto
![]()
El ion cobalto Co (II) se encuentra en soluciones acuosas como un ion complejo coordinado con seis moléculas de agua dando lugar al ion denominado hexaacuocobalto (II) [Co(H2O)6]2+, observándose la solución de color rosado. En presencia de iones cloruro, el Co (II) forma otro ion complejo distinto llamado tetraclorocobaltato (II) [CoCl4]2- , dando un color azul al sistema.
Observa el siguiente video:
![]()
Esta reacción es utilizada en la construcción de higrómetros químicos que permiten determinar la humedad ambiente. Si el porcentaje de humedad es alto se observa de color rosado el "adorno del tiempo" como se puede ver en la siguiente imagen, mientras que si este porcentaje es bajo el adorno presenta color azul.

Además de su aplicación en higrómetros también puede utilizarse el cloruro de cobalto (II) para escribir mensajes mágicos: se escribe un
mensaje con la solución rosa hidratada y cuando el papel se
seca calentándolo suavemente cambia de color a azul correspondiente a la forma deshidratada.
Es común que los desecadores (contenedor hermético al aire que mantiene una atmósfera de baja humedad) empleados en los laboratorio de Química se encuentren rellenos en el fondo con un agente desecante que absorbe la humedad de su interior. El agente desecante más comúnmente utilizado es la sílica gel con indicador que suele contener una sal de cobalto de color azul en forma anhidra y rosa cuando está hidratada (esto permite observar su estado de hidratación). Dentro del desecador se mantienen recipientes que contienen muestras de diferentes sólidos que se usan como patrones por ejemplo, como se puede observar en la siguiente imagen. Cuando la sílica se encuentra de color rosado indica que debe secarse (deshidratarse con la ayuda de un horno o estufa, por ejemplo) para que pueda reutilizarse absorbiendo la humedad dentro del desecador.

4.2. Ejemplo 3: Complejos de cobre
![]()
El catión cobre Cu (II) interactúa con seis moléculas de agua formando el complejo llamado hexaacuocobre (II) [Cu(H2O)6]2+ y cuando se agrega al sistema ácido clorhídrico concentrado se forma el anión conocido como tetraclorocuprato [CuCl4]2- que da un color verde a la solución.
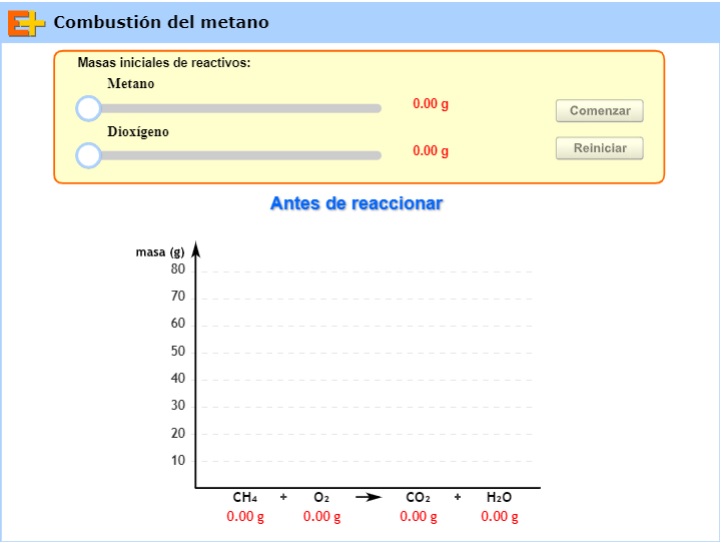
4.3. Ejemplo 4: Óxidos de nitrógeno
![]()
Observa en el siguiente video qué ocurre.
4.4. ¿Incompleto e invertible?
Como ya analizaste al inicio de este módulo, Berthollet introdujo dos nuevos conceptos en el estudio de las reacciones químicas: las ideas de "reacción incompleta" y de "invertibilidad", que serían esenciales en la posterior construcción del concepto de equilibrio químico.- ¿Cómo aplican estos dos términos a los ejemplos que has observado en los videos anteriores?
- ¿Cómo definirías, utilizando tus palabras, los conceptos de "reacción incompleta" e "invertibilidad"?
![]()
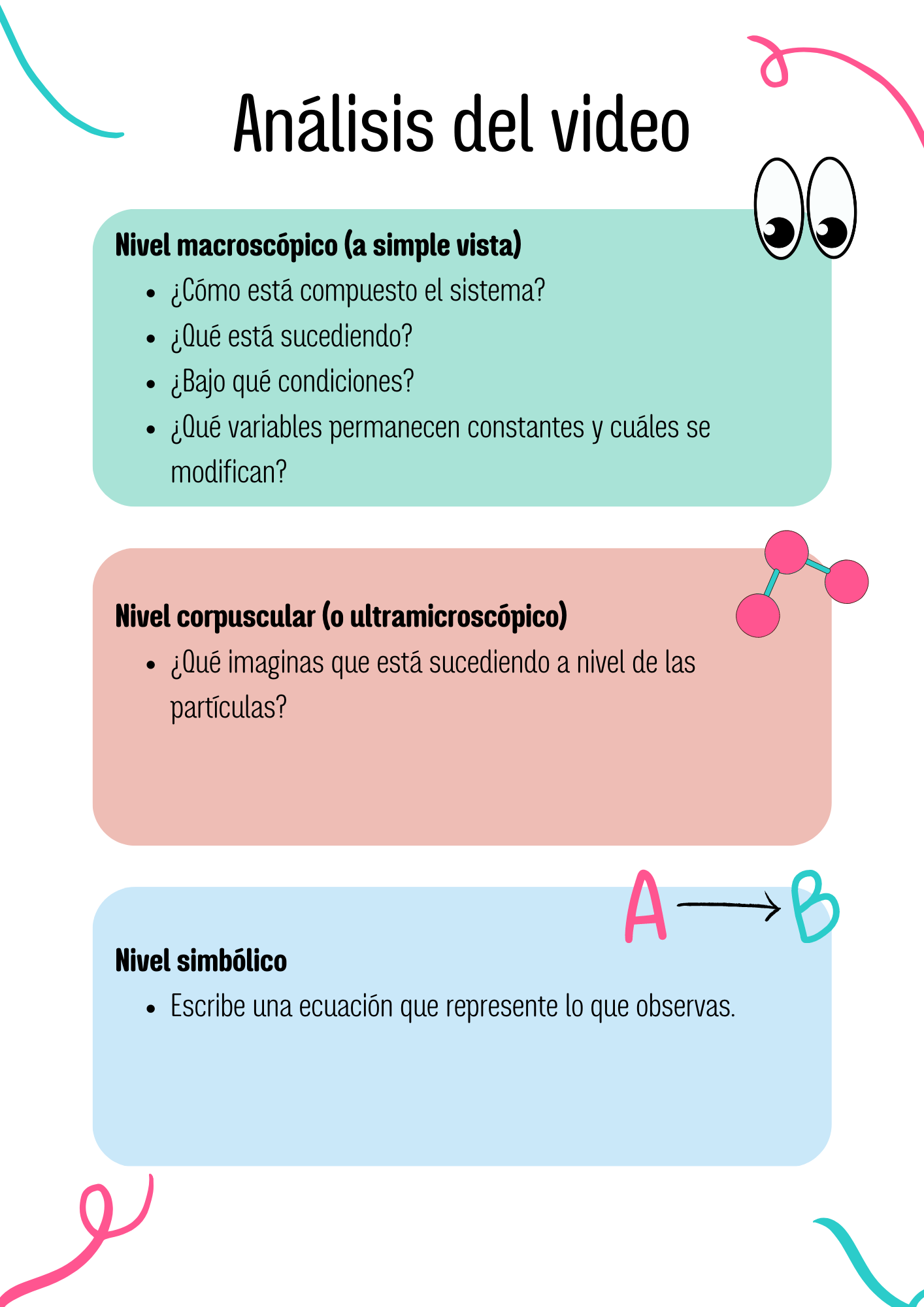
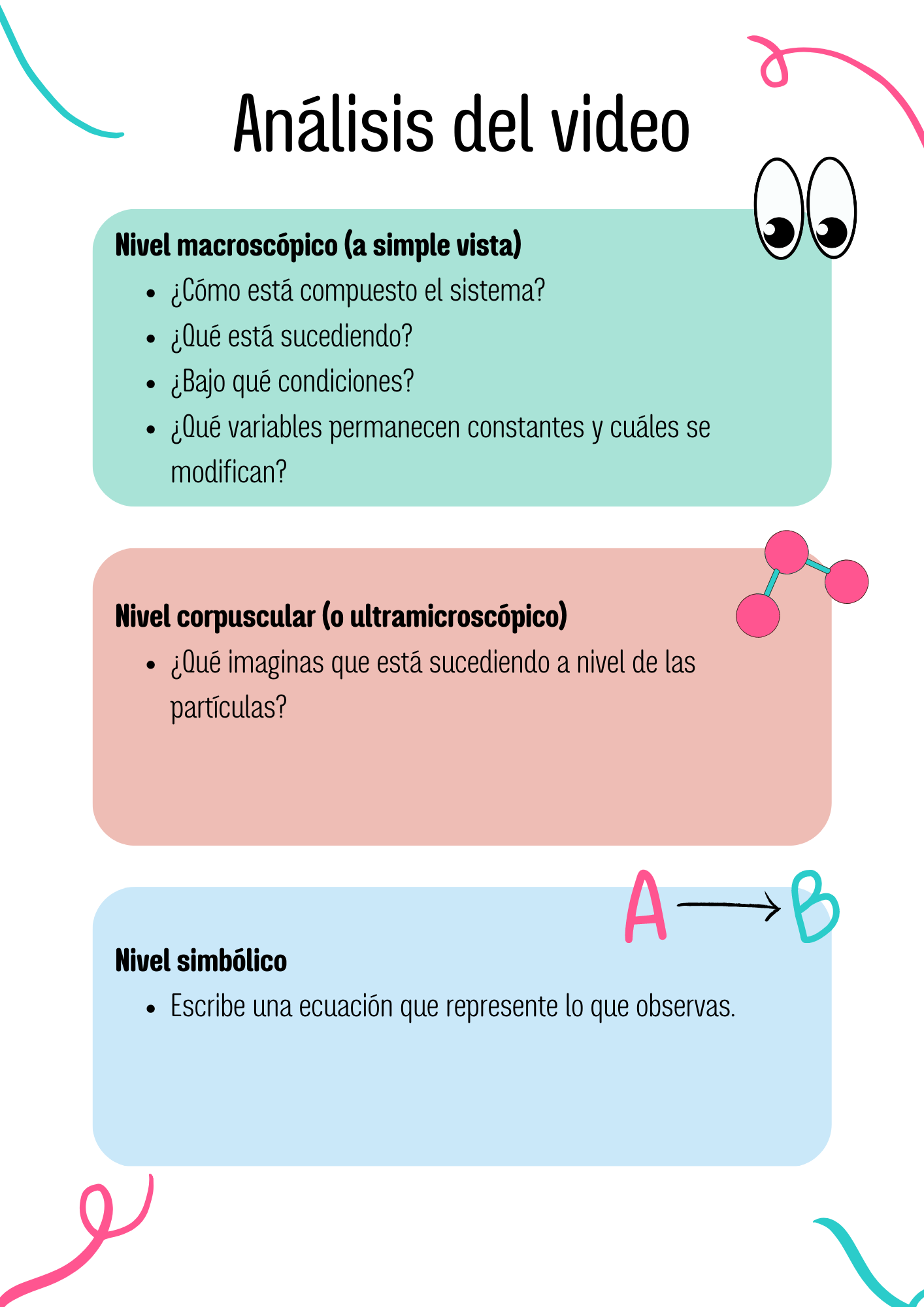
Imagina que un cambio químico es la transformación de una sustancia A y en una B como se observa el siguiente simulador.
![]()
Forward probability refiere a la probabilidad de la reacción directa (reactivo → producto).
Backward probability refiere a la probabilidad de la reacción inversa (producto → reactivo).
NA controla el número inicial de partículas de A.
NB controla el número inicial de partículas de B.
![]()
- ¿Qué ocurre si ambas reacciones tienen una probabilidad igual de ocurrir y el sistema inicialmente está formado únicamente por partículas de A? ¿Y sí inicialmente se encuentran partículas de A y B? ¿Qué cambia al modificar la probabilidad de las reacciones directa e inversa?
- ¿Qué ocurre a nivel de partículas en los cambios analizados?
- ¿Cómo explicas lo ocurrido usando los conceptos de "reacción incompleta" e "invertibilidad"?
- ¿Qué observas en la gráfica de concentración en función del tiempo?
- ¿Cómo piensas que se aplican las siguientes características a lo observado en el simulador: "coexisten todas las especies en el proceso y este proceso es dinámico"?
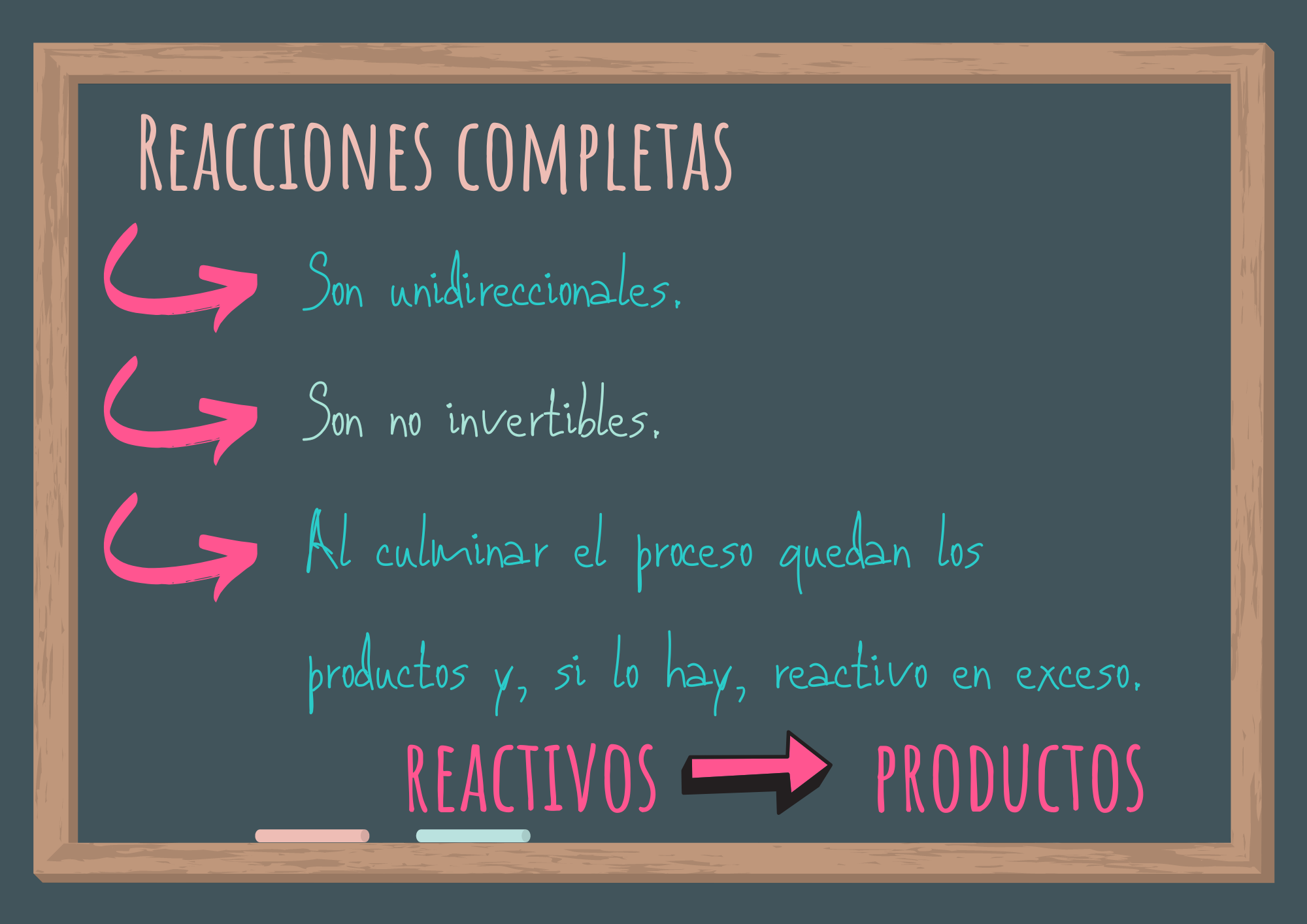
5. Reacciones que habitualmente se completan

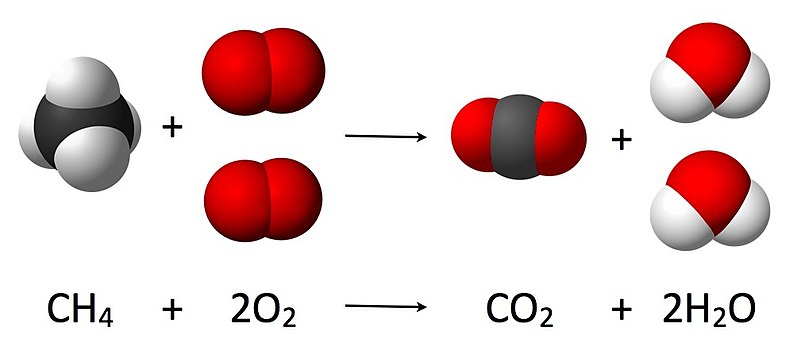
- ¿A qué conclusión llegas?
- ¿Cómo se relaciona tu conclusión con la siguiente frase: "la información aportada por las ecuaciones químicas, en términos de cantidad química, permite establecer la proporción molar en que se combinan las sustancias reaccionantes y se forman las sustancias resultantes. Estas proporciones no se modifican aunque se cambien las cantidades de sustancias que se colocan a reaccionar."?
- ¿Qué entiendes por reactivo en exceso y reactivo limitante? ¿Cómo se aplican estos términos a los datos que has obtenido?
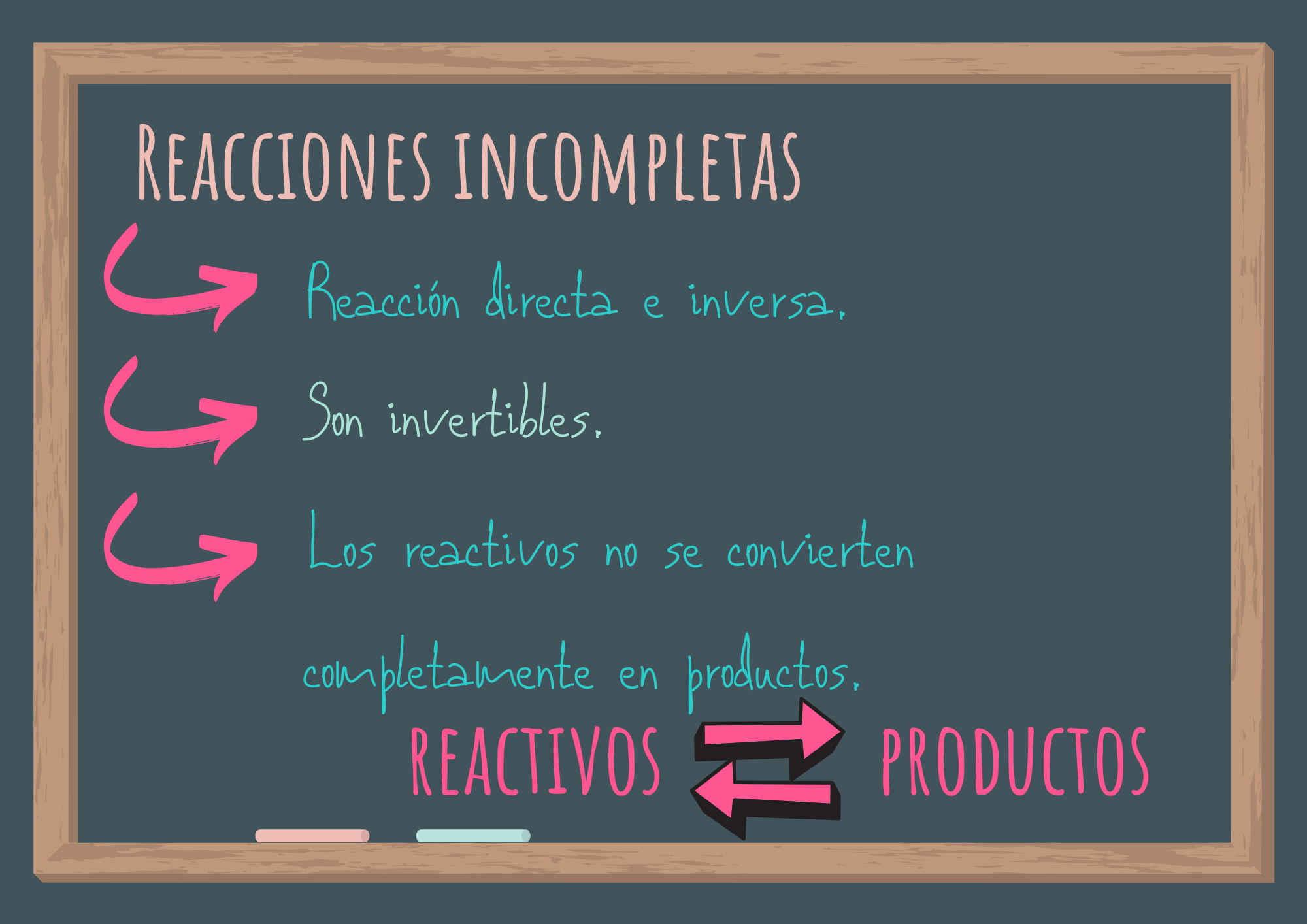
6. Reacciones incompletas o que habitualmente no se completan
- ¿Qué ocurre a nivel de partículas en un sistema formado inicialmente por dióxido de nitrógeno al transcurrir el tiempo? ¿Y si se parte de ambos compuestos?
- ¿Cómo simbolizas el cambio químico ocurrido?
7. ¿Equilibrio?
![]()
El término equilibrio en la vida cotidiana se relaciona con la mesura y sensatez en los actos y juicios. O también con un cuerpo que, a pesar de tener poca base de sustentación, se mantiene sin caerse. Quizás venga a tu mente una balanza de dos platos o un atleta entrenando. En la siguiente imagen se muestran algunos ejemplos cotidianos con lo que asociamos este término.

En las situaciones anteriormente mencionadas se da un equilibrio estático, en el que la invariancia del sistema se da por la sumatoria cero de las fuerzas. A continuación se analizan dos ejemplos de equilibrios dinámicos, en los que se dan dos procesos contrapuestos de forma simultánea: equilibrio físico y equilibrio químico.
![]()
Otro ejemplo que ya seguramente ya has analizado en cursos anteriores de Química es el equilibrio físico de fases, por ejemplo cuando se tiene agua líquida en un recipiente cerrado a una temperatura determinada, el número de moléculas de agua que dejan la fase líquida y vuelven a ella es el mismo (nivel de partículas) como puedes observar en el siguiente gif.
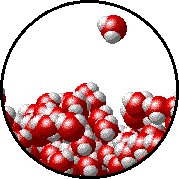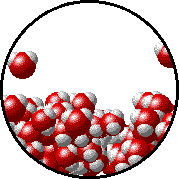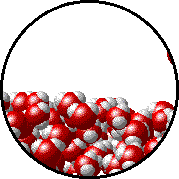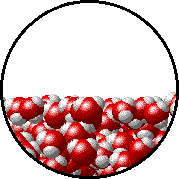
Este proceso se puede simbolizar como se muestra a continuación (nivel simbólico):
H2O (l) ⇄ H2O (v)
La doble flecha indica que ambos procesos se están dando simultáneamente.
A continuación analizaremos las características del equilibrio químico.
8. Equilibrio químico
- El sistema debe poder considerarse cerrado para las sustancias que participan en la reacción.
- La temperatura debe ser constante.
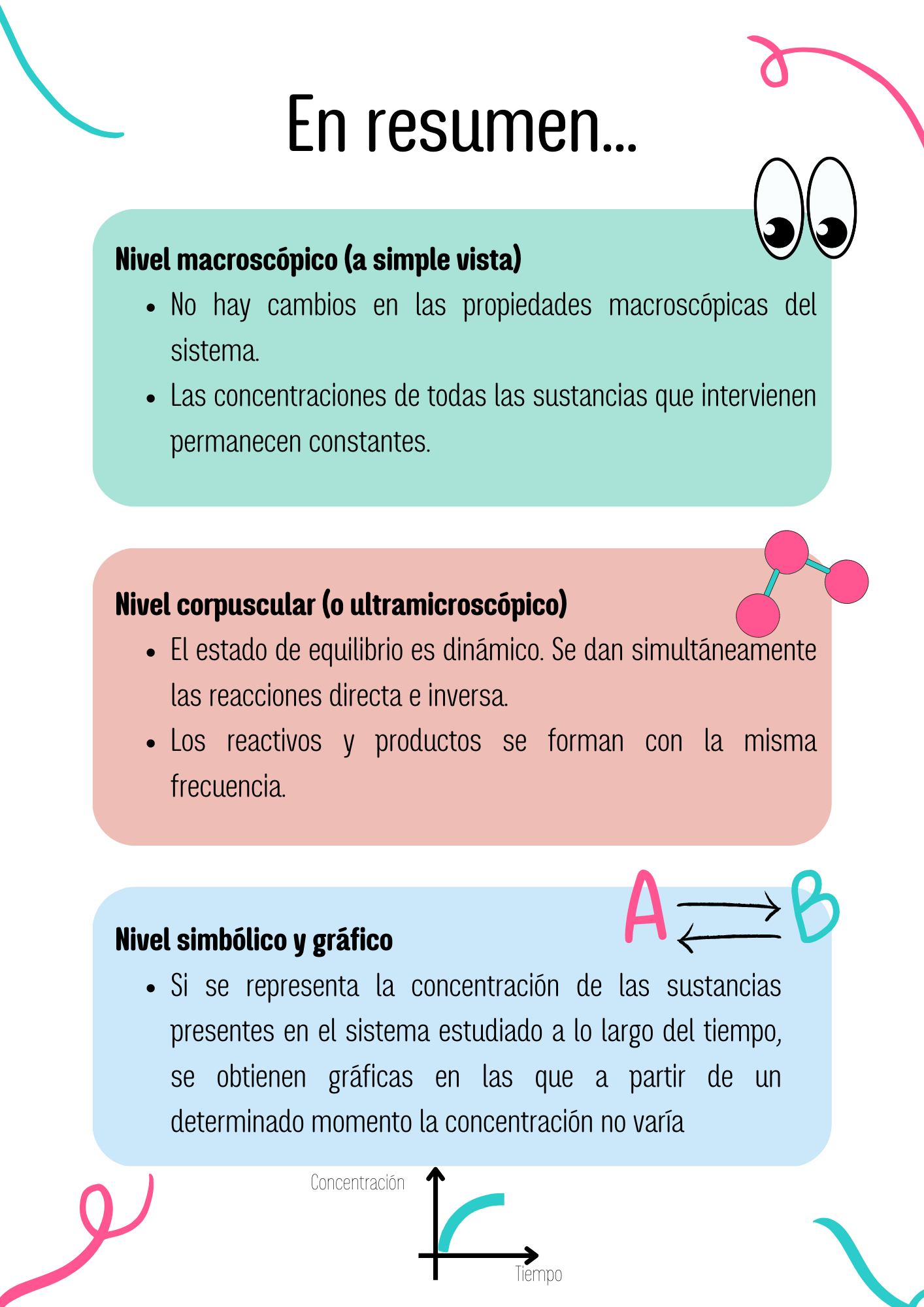
No se aprecia ningún cambio en las propiedades macroscópicas del sistema:
- La temperatura, color, densidad, presión, etc., no varían.
- La composición química del sistema se mantiene (las concentraciones de reactivos y productos permanecen constantes).
El estado de equilibrio es dinámico.
- Las reacciones directa e inversa siguen produciéndose simultáneamente.
- Los reactivos forman productos y los productos reactivos a la misma frecuencia (número de choques efectivos por unidad de tiempo).
- Se mantiene constante el número de partículas de cada una de las especies que intervienen, cambian la posición espacial de las partículas (aspecto cinético) y los átomos que las forman (aspecto dinámico).
A nivel gráfico:
Si se representa la concentración de las sustancias presentes en el sistema estudiado a lo largo del tiempo, se obtienen gráficas en las que a partir de un determinado momento la concentración no varía (se ha alcanzado el equilibrio químico).
![]()
- ¿Qué diferencias y semejanzas encuentras entre el equilibrio químico y el uso que hacemos del término de forma cotidiana?
- ¿Qué diferencias y semejanzas puedes citar si comparas al equilibrio físico con el equilibrio químico?
9. "Pan a partir del aire"
![]()
En 1912 el químico alemán Fritz Haber (1868–1934) descubrió un proceso para sintetizar amoníaco directamente a partir de dinitrógeno y dihidrógeno. El proceso se conoce también proceso Haber-Bosch, en honor a Karl Bosch, el ingeniero que ideó el equipo para la producción industrial de amoníaco (denominado azano según la IUPAC). La ingeniería necesaria para poner en práctica el proceso Haber exige el uso de altas temperaturas y presiones (aproximadamente 500 °C y 200 atm) que eran difíciles de alcanzar en aquella época.

Imagen. Retrato de Haber y Bosch respectivamente.
El proceso Haber ofrece un ejemplo de interés histórico de las complejas repercusiones de la química en nuestra vida. Al comenzar la Primera Guerra Mundial, en 1914, Alemania dependía de los depósitos de nitrato de Chile para abastecerse de los compuestos nitrogenados que necesitaba para fabricar explosivos. Durante la guerra el bloqueo naval aliado de Sudamérica cortó este suministro. Sin embargo, fijando nitrógeno del aire, Alemania pudo continuar produciendo explosivos. Los expertos han estimado que la Primera Guerra Mundial habría terminado antes de 1918 de no ser por el proceso Haber.
De estos infortunados inicios como factor decisivo en las guerras internacionales, el proceso Haber ha llegado a ser la principal fuente mundial de nitrógeno fijado. El mismo proceso que prolongó la Primera Guerra Mundial ha permitido a los científicos fabricar fertilizantes que han incrementado el rendimiento de los cultivos y salvado así a millones de personas de la inanición. El amoníaco se aplica directamente al suelo como fertilizante. También se convierte en sales de amonio como, por ejemplo, sulfato de amonio (NH4)2SO4, o hidrógenofosfato de amonio (NH4)2HPO4, las que a su vez se emplean como fertilizantes.
![]()
El siguiente diagrama indica los pasos seguidos en una industria que produce amoníaco a través del proceso Haber-Bosch.
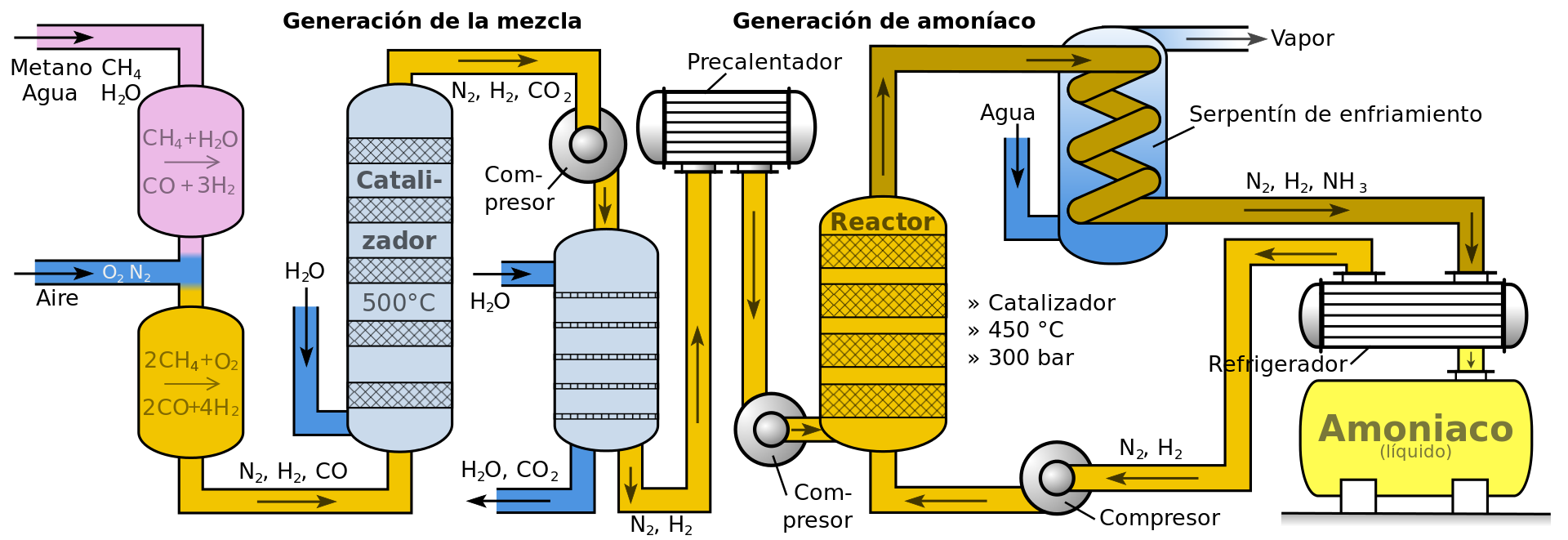
![]()
Observa qué ocurre a nivel de las partículas en el siguiente simulador. Puedes revisar el capítulo sobre reacciones incompletas para saber cómo utilizarlo.
![]()
N2 (g) + 3 H2 (g) ⇄ 2 NH3 (g)
![]()
Se han realizado tres experimentos. En el primero se colocó un mol de dinitrógeno y un mol de dihidrógeno en un contenedor de 1 L y se selló el envase. Se permitió que el sistema alcanzara el estado de equilibrio químico y se midieron las concentraciones de cada especie. Los datos obtenidos aparecen en la tabla que se encuentra a continuación.
En el segundo experimento se partió de un mol de amoníaco en un recipiente sellado de 1 L. Y en el tercer experimento se colocaron dos moles de dinitrógeno, un mol de dihidrógeno y tres moles de amoníaco en un recipiente sellado de 1 L de capacidad.
Todos los experimentos se realizaron a 500 °C.
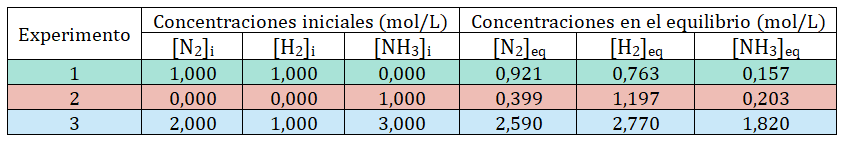
Referencias: [ ] indican concentración, i representa inicial y eq equilibrio.
La siguiente gráfica representa de forma esquemática el experimento 1.
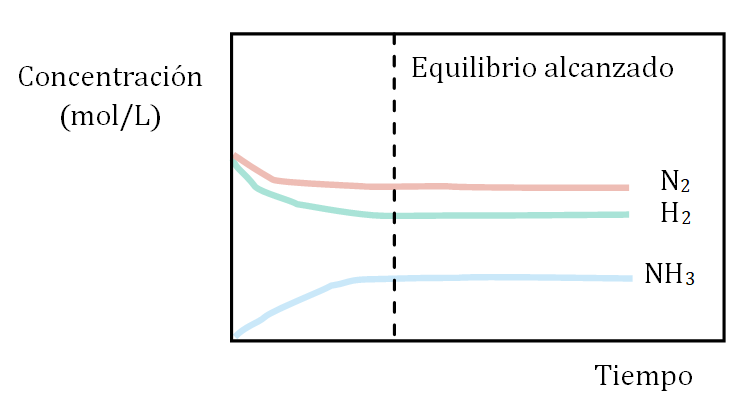
![]()
1. Realiza dos gráficas sencillas (a modo de esquema), que representen los datos obtenidos de los experimentos 2 y 3.
2. Diseña tres experimentos en base al simulador variando el número de partículas iniciales de cada una de las especies y analiza la gráfica de concentración en función del tiempo obtenida en cada ejemplo. ¿En qué se asemejan y se diferencian las tres gráficas?
10. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Portal Uruguay Educa - Diciembre 2022.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Atkins. P. y Jones, L. (2012). Principios de Química. Los caminos del descubrimiento. (5ta edición). Editorial Panamericana.
- Bermudez, G. y De Longhi, A. (2013). Niveles de comprensión del equilibrio químico en estudiantes universitarios a partir de diferentes estrategias didácticas. Revista Electrónica de Enseñanza de las CIencias. 10. 264-288.
- Brown, T., Le May, E., Bursten, B. y Burdge, J. (2004). Química. La Ciencia Central. (9na edición). Pearson Educación.
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill.
- Cuadro, J. (2021). Equilibrio químico - Complejos de cobalto. https://chemcollective.org/iqs/vlab/cobaltES.htm
- Darré, L. (2022). Equilibrio químico. Primera parte.
- Quílez Pardo, J. (2002). Aproximación a los orígenes del concepto de equilibrio químico: algunas implicaciones didácticas. Profesores al día (FísicoQuímica). Educación Química, 13(2), 101-112. https://www.researchgate.net/publication/234169702_Aproximacion_a_los_origenes_del_concepto_de_equilibrio_quimico_Algunas_implicaciones_didacticas
- Quílez, J. (2017). Acerca de los Orígenes de la Ley de Equilibrio Químico. Historia de la Química. Anales de Química, 113(3), 191-197. https://www.researchgate.net/publication/320183115_Acerca_de_los_Origenes_de_la_Ley_de_Equilibrio_Quimico
- Quílez, J. (2004). A HISTORICAL APPROACH TO THE DEVELOPMENT OF CHEMICAL EQUILIBRIUM THROUGH THE EVOLUTION OF THE AFFINITY CONCEPT: SOME EDUCATIONAL SUGGESTIONS. CHEMISTRY EDUCATION: RESEARCH AND PRACTICE, 5(1), 69-87. https://www.researchgate.net/publication/233791411_A_historical_approach_to_the_development_of_chemical_equilibrium_through_the_evolution_of_the_affinity_concept_some_educational_suggestions
- Quílez Pardo, J. y Castelló Hernández, M. (1996). La enseñanza del equilibrio químico con ayuda de la computadora. Educación Química 7(1), 50-54.
- Raviolo, A., Gennari, F. y Andrade, J. (2000). Interesantes problemáticas en el tema equilibrio químico. Educación Química, 11(4), 408-411.
- Raviolo, A. (2016). LAS IMÁGENES EN LIBROS DE TEXTO UNIVERSITARIOS: EL CAPÍTULO EQUILIBRIO QUÍMICO. Educación en la Química en Línea ISSN 2344-9683, 22(1), 26-38.
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2010). Todo se transforma. Química- 3º Año CB. Contexto.
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Contexto.
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (Quinta edición). Madrid, España: Mc Graw Hill.
- Whitten, K., Davis, R., Peck, M. y Stanley, G. (2015). Química. (10a edición). Cengage Learning.
Vídeos, páginas y/o simuladores utilizados:
- ANIMATED SCIENCE. (26 de octubre de 2021). Methane combustion reaction animation [Archivo de Video]. Youtube. https://youtu.be/ntQM6f6bQVw
- BerkeleyChemDemos. (8 de marzo de 2021). NO2 N2O4 [Archivo de Video]. Youtube. https://youtu.be/LHq9hTrdwM8
- Carlos Ponce Gómez. (28 de mayo
de 2021). Equilibrio de dióxido de
nitrógeno y tetraóxido de dinitrógeno [Archivo de Video]. Youtube. https://youtu.be/FdOluxGzkjY
- ChemToddler. (16 de agosto de 2008). Chromate - dichromate equilibrium [Archivo de Video]. Youtube. https://youtu.be/zP9qEiaL4kQ
- ChemToddler. (16 de agosto de 2008). Equilibrium in cobalt(II) chloride solution [Archivo de Video]. Youtube. https://youtu.be/GS9kIj9n-BU
- ChemToddler. (16 de agosto de 2008). Equilibrium in copper(II) chloride solution [Archivo de Video]. Youtube. https://youtu.be/fjfm0MTDtx8
- Science Bits. (27 de junio de 2014).
Video experimento: Electrólisis del agua [Archivo de Video]. Youtube. https://youtu.be/d9YiX5dY86Y
- Department of Chemistry and Biochemistry. University of Arizona. (s.f.). Equilibrium A-B for-back (H5 CT). CT Interactives. https://chemicalthinking.xyz/probiso/probiso.html
- Department of Chemistry and Biochemistry. University of Arizona. (s.f.). Equilibrium 2 NO2 - N2O4 (H5 CT). CT Interactives. https://chemicalthinking.xyz/NOX/equilnox.html
- Department of Chemistry and Biochemistry. University of Arizona. (s.f.). Equilibrium N2 + 3 H2 - 2 NH3 (H5 CT). CT Interactives. https://chemicalthinking.xyz/ammonia/amm.html
- Peñas, J. (2022). Combustión del metano. Educaplus. https://www.educaplus.org/game/combustion-del-metano.
- Real Academia Española. (2022). Definición de equilibrio. https://dle.rae.es/equilibrio
Las imágenes utilizadas fueron tomadas de:
- Adornos del tiempo. Autora: Anarella Gatto. Licencia: CC BY-SA 4.0.
- Andar en bicicleta. Autora: Andrea Piacquadio. Pexels. Licencia: Uso gratuito.
- Balanza de dos platillos. Autor: Coleccionando Camaras. Flickr. Licencia: CC BY-NC-ND 2.0.
- Carl Bosch. Autor: BASF Corporate History. Licencia: CC BY-SA 3.0.
- Caminando en una cuerda. Autor: xavo_rob. Flickr. Licencia: CC BY-NC-SA 2.0.
- Combustion reaction of methane. Autor: JSquish|. Licencia: CC BY-SA 3.0.
- Cubos de hielo. Autor: George Hodan. Licencia: CC0 Public Domain.
- Diagrama del proceso de Haber-Bosch. Autor: Sven. Licencia: CC BY-SA 4.0.
- Fritz Haber. Autor: Photographisches Institut der ETH Zürich. Licencia: CC BY-SA 4.0.
- Hierro herrumbrado. Autor: Waugsberg. Licencia: CC BY-SA 3.0.
- Hombre en equilibrio sobre piedras. Autor: Vlad Chetan. Pexels. Licencia: Uso gratuito.
- Metano. Autor: Conan. Licencia: Creative Commons Atribución 2.0 Genérica (CC BY 2.0)
- Molecules Gif. Autor: Bladestone Gifer.
- Mujer haciendo ejercicio. Autora: Marta Wave. Licencia: Uso gratuito.
- Naturaleza parada de manos. Autor: mohamed mahmoud hassan. PublicDomainPictures.net. Licencia: CC0 Public Domain.
- Piedras en equilibrio. Autor: George Hodan. PublicDomainPictures.net. Licencia: CC0 Public Domain.
- Silicagel getrocknet PICT3047. Autor: Asb. Licencia: CC BY-SA 3.0.
- The inner crater (caldera) of Mount Emi Koussi (Tibesti, Chad). Mineral precipitation (natron) on the ground is visible. Autor: Stefan Thüngen. Licencia: Dominio Público.
- Vacuum desiccator chemical storage. Autor: Bamrsykp. Licencia: CC BY-SA 4.0.