Estados de agregación de la materia y sus cambios
Estados físicos de la materia
En primer lugar es necesario definir Materia. La materia se define como es constituyente de todos los cuerpos del universo, es todo aquello que posee masa y ocupa un lugar en el espacio.
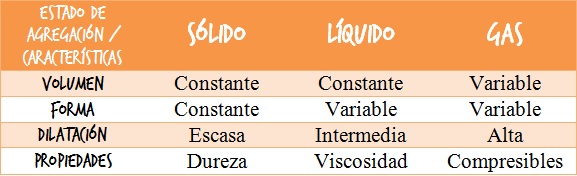
La misma se presenta en 3 estados físicos: Sólido, líquido y gaseoso
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Ciencias Físicas - 2º C.B. |
| Libro: | Estados de agregación de la materia y sus cambios |
| Imprimido por: | Invitado |
| Día: | jueves, 21 de noviembre de 2024, 22:05 |
1. Introducción
Estados de agregación de la materia
En primer lugar repasaremos qué es la materia.
La materia se define como el constituyente de todos los cuerpos del universo, es todo aquello que posee masa y ocupa un lugar en el espacio.
La misma se presenta comúnmente en 3 estados físicos:
- sólido,
- líquido y
- gaseoso.
2. Estado sólido
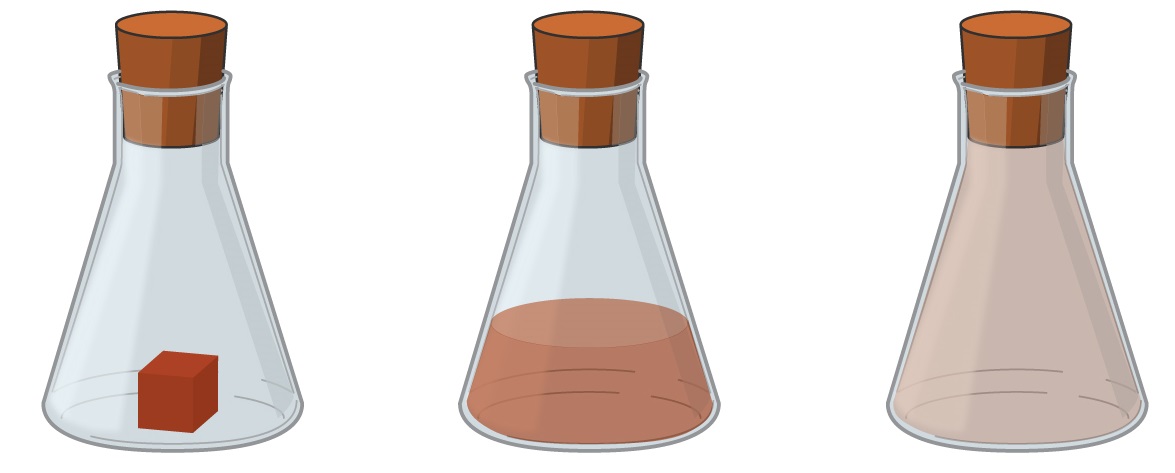
 Los cuerpos en estado sólido se caracterizan por tener forma y volumen propios.
Los cuerpos en estado sólido se caracterizan por tener forma y volumen propios.
Otra característica es la escasa dilatación, es decir que experimentan variaciones de volumen poco apreciables a simple vista al recibir energía.
3. Estado líquido

Los cuerpos en estado líquido poseen un volumen determinado, pero su forma es variable y en general fluyen con facilidad.
Si un litro de agua está contenido en una jarra, el líquido adopta la forma de la jarra. Sin embargo, si se derrama, tiene el mismo volumen (un litro) pero cambia notoriamente su forma.
En este estado los cuerpos pueden comprimirse poco al ejercerles presión.
Experimentan mayor variación de volumen por efecto del calor que los cuerpos en estado sólido. Esta propiedad. la dilatación, se utiliza como fundamento para la construcción de algunos termómetros.
4. Estado gaseoso

Los cuerpos en estado gaseoso no tienen forma propia y ocupan todo el espacio disponible. Por eso, es frecuente decir que no tienen forma ni volumen propios.
Si hay una pérdida de gas de una garrafa, éste ocupará todo el volumen del armario donde se encuentra o todo el volumen de la cocina.
En comparación con los sólidos y los líquidos, en las mismas condiciones, los cuerpos en estado gaseoso experimentan mayores dilataciones.
Al ser sometidos a presión su volumen se reduce considerablemente: son muy compresibles.
6. Cambios de estado
La materia experimenta cambios constantemente, como por ejemplo si colocamos agua en el congelador, se transforma en hielo. En esta transformación, la composición de la materia que experimenta el cambio no se modifica, la sustancia es la misma antes y después de la transformación, solo se aprecia un cambio en su aspecto.
Un cambio físico es una transformación de la materia en la cual su composición no se modifica.
Los cambios de estado, son cambios físicos.
El siguiente esquema indica los nombres de los diferentes cambios de estado:
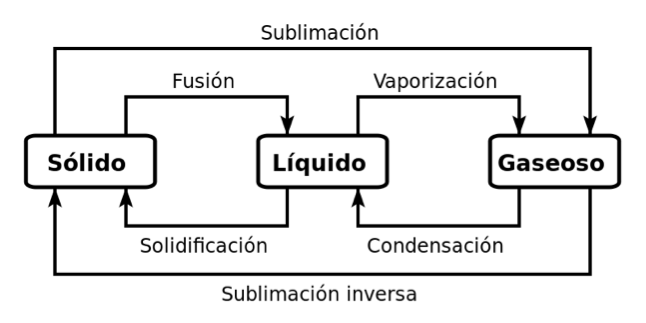
Los cambios de estado que ocurren con la absorción de energía son denominados procesos endotérmicos, en este caso son:
- fusión,
- vaporización y
- sublimación.
En cambio aquellos que ocurren con la liberación de energía son llamados procesos exotérmicos, en este caso son:
- solidificación,
- condensación y
- sublimación inversa.
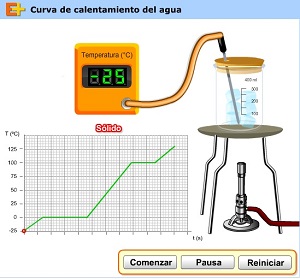
7. Curvas de calentamiento y de enfriamiento
Los cambios de estado se pueden representar mediante la construcción de una gráfica.
Si graficamos la temperatura en función del tiempo para la fusión y la vaporización, obtenemos la siguiente gráfica, en este caso se le llama curva de calentamiento (dado que aumenta la temperatura a medida que transcurre el tiempo)
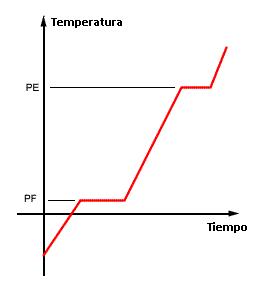
Hay dos zonas en la gráfica, en la que la temperatura se mantiene constante (PF, PE), a la misma se le denomina "Meseta" y en la misma se representa los cambios de estado.
A partir de dicha gráfica, se puede determinar el punto de fusión y de ebullición (PF; PE).
Los mismos son la temperatura a la que ocurren dichos cambios (fusión y ebullición).
Ambos (PF; PE), son propiedades intensivas y características de cada sustancia. Son intensivas porque no dependen de la cantidad de materia y son características, porque permiten saber de qué sustancia se trata.
Podemos representar la condensación y la solidificación, mediante una curva de enfriamiento:
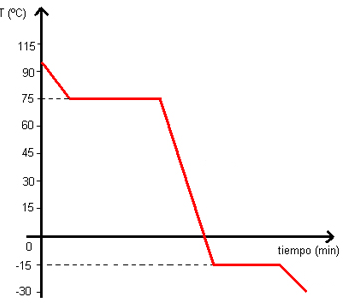
8. Ejemplo de curva de calentamiento para el agua
Visita el siguiente simulador y haz clic en comenzar.
Observa lo que va ocurriendo.
9. Vaporización
Si bien sabemos que la vaporización es el nombre del cambio de estado de líquido a gaseoso, debemos establecer las diferencias entre ebullición y evaporación.
La ebullición es un fenómeno que ocurre en todo el líquido y a temperatura constante.
En cambio la evaporación, es un fenómeno que ocurre en la superficie del líquido y a cualquier temperatura.
10. Créditos
Bibliografía consultada/Sitios:
- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2010). Todo se transforma. Química- 3º Año CB. Montevideo, Uruguay: Contexto.
- Segurola, B; Saravia, G; Szwarcfiter, M; Amoedo, A. y Uzal, C. (2010). Ciencias Físicas 2. Montevideo, Uruguay: Contexto.
- Ferreira, D. y Menéndez, M. (2012). Ciencias Físicas 2º. Montevideo, Uruguay: Textos del Sur.
- Chapter 2: Changes of state. Lesson 2.2, 2.3 y 2.5. Middle School Chemistry. ACS. http://www.middleschoolchemistry.com/lessonplans/chapter2.
- Curva de calentamiento del agua. Educaplus. http://www.educaplus.org/game/curva-de-calentamiento-del-agua
Imágenes:
- Introducción: https://opentextbc.ca/chemistry/wp-content/uploads/sites/150/2016/05/CNX_Chem_01_02_StatesMatt.jpg
- Estado sólido: https://encrypted-tbn1.gstatic.com/images?q=tbn:ANd9GcSykPQCvdOthWprwpEUMmbqMQCxBw6V7jGhRZ8hj-JYfm0JJl5L
- Estado líquido: https://encrypted-tbn2.gstatic.com/images?q=tbn:ANd9GcSpQ4vLDo4sIrrRHkXZCyKfPkcFXoGEZciMzhdXCRCSdbyQFMTInA
- Estado gaseoso: http://4.bp.blogspot.com/_SCDOqISgiW0/TA8Zg9m7C9I/AAAAAAAAACE/FM-dH61GqQI/s1600/globos.jpg
- Cambios de estado: https://quimicosas.files.wordpress.com/2015/09/sin-tc3adtulo.png
- Curva de calentamiento y de enfriamiento: http://quimica.laguia2000.com/wp-content/uploads/2012/03/Mezcla-quimica-1.jpg
- Curva de calentamiento y de enfriamiento: http://2.bp.blogspot.com/-aKflTRoDrsY/U0P5O6sbTZI/AAAAAAAAAPg/TF6rMsC311c/s1600/curva+de+enfriamiento.pn
- Vaporización: https://image.slidesharecdn.com/natutema14lamateria-150429130151-conversion-gate01/95/natu-tema-14-la-materia-7-638.jpg?cb=1430312598
- Vaporización: https://schragerscience5.wikispaces.com/file/view/-solid_liquid_gas.png/264547568/-solid_liquid_gas.png
Autoría del Módulo: Profesores Anarella Gatto, Sebastián Mendieta y Silvia Pedreira.
agatto@uruguayeduca.edu.uy
spedreira@uruguayeduca.edu.uy
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Portal Uruguay Educa.
Junio de 2017.