Algunas propiedades de los glúcidos
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | Algunas propiedades de los glúcidos |
| Imprimido por: | Invitado |
| Día: | viernes, 4 de abril de 2025, 09:15 |
Tabla de contenidos
1. Introducción
Experimentalmente podemos realizar una serie de análisis para estudiar a los glúcidos. A continuación profundizaremos en algunas de ellas.
El siguiente esquema resume algunos de dichos análisis.
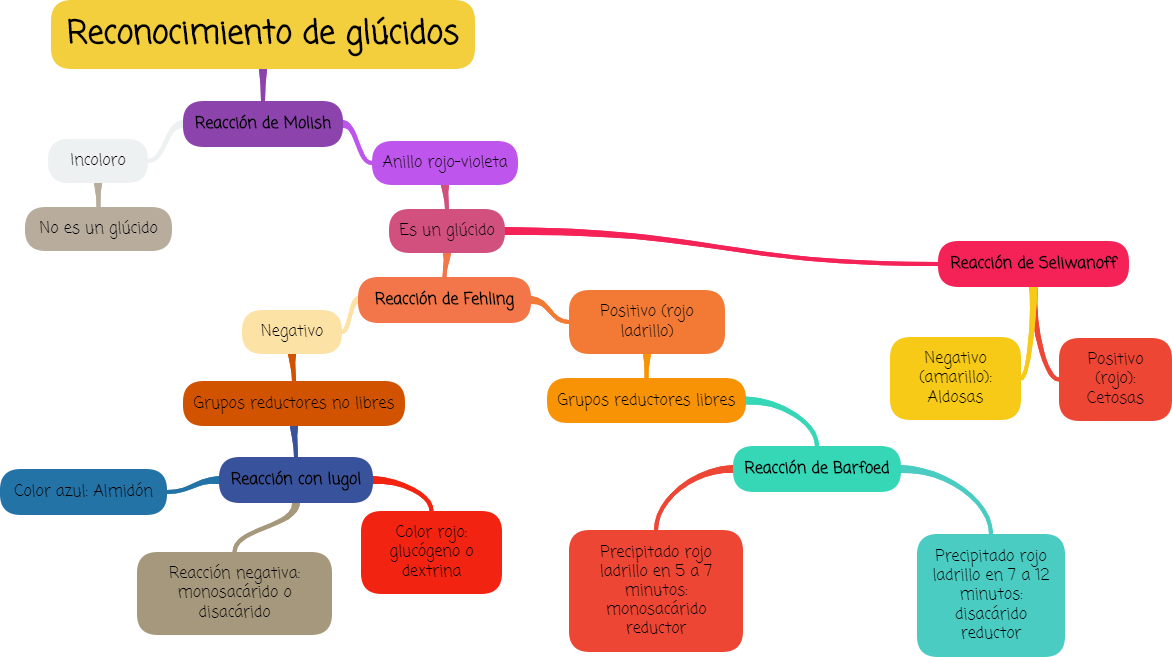
2. Diferenciación de aldosas y cetosas
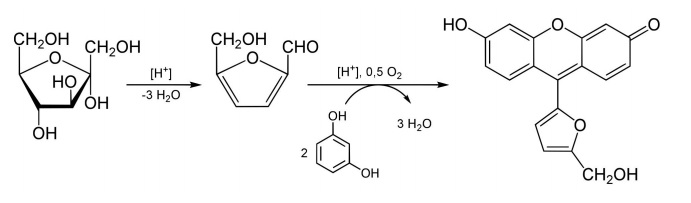
- Ensayo de Seliwanoff:
Este ensayo distingue entre aldosas y cetosas y disacáridos. Se basa en el hecho que, cuando se calientan, las cetosas se deshidratan más rápidamente que las aldosas. Esta reacción entre una cetohexosa y el reactivo de Seliwanoff (resorcinol en ácido clorhídrico - HCl - diluido) ocurre rápidamente (en menos de 1 minuto) en agua hirviendo y resulta en la formación de un precipitado color rojizo. El color se intensifica si se continúa calentando. Otros glúcidos y las aldohexosas dan un color rojo tenue si se prolonga el calentamiento debido a la conversión de la glucosa en fructosa por el HCl o la hidrólisis del disacárido o polisacárido para producir fructosa.
Observa el siguiente video:
3. Diferenciación de monosacáridos y disacáridos
- Ensayo de Barfoed:
Cuando hervidos en agua, los monosacáridos reaccionan entre 5 a 7 minutos, mientras que los disacáridos toman más tiempo 7 a 12 minutos. Si se continúa el calentamiento, los disacáridos darán un resultado positivo debido a la hidrólisis formando monosacáridos.
La reacción primaria es la reducción de los iones Cu2+ a Cu2O que forma un precipitado de color rojo ladrillo.
Observa lo que ocurre en el siguiente video:
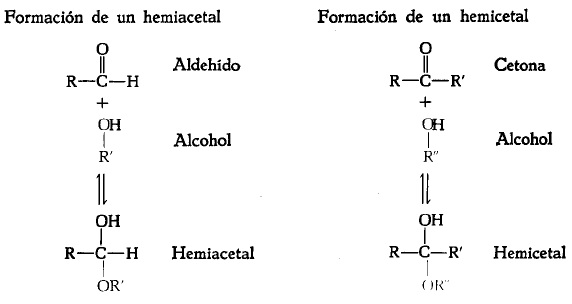
4. Hemiacetal
La formación de piranosas es un caso especial de un tipo más general de reacción entre un aldehído y un alcohol para formar un hemiacetal, que contiene un átomo de carbono asimétrico y puede existir, por tanto, en dos formas esteroisómeras. Un hemicetal es un producto análogo formado por la reacción de una cetona con un alcohol. La D-glucopiranosa es un hemiacetal intrapartícula, en el cual el grupo hidroxilo libre del átomo de carbono 5 ha reaccionado con el átomo de carbono aldehídico 1, convirtiéndolo en asimétrico.
5. Epimerización y reordenamiento enodiol de la glucosa
Observa las siguientes animaciones elaboradas por el docente Marcelo Gurin.
6. Análisis del poder reductor de los glúcidos
La determinación cuantitativa de los monosacáridos se realiza, frecuentemente, basándose en su oxidación en solución alcalina mediante Cu2+, Ag+ o ferricianuro. Los azúcares capaces de reducir a tales oxidantes se denominan azúcares reductores.A continuación analizaremos dos ejemplos.
6.1. Reactivo de Fehling
- Reactivo de Fehling
Los monosacáridos pueden ser oxidados por agentes relativamente suaves como los iones férrico (Fe3+) y cúprico (Cu2+). En estas reacciones el carbono carbonílico se oxida a ácido carboxílico. Estos glúcidos capaces de reducir iones férricos o cúpricos se llaman REDUCTORES.
La siguiente expresión representa lo que está ocurriendo en el caso de que el glúcido sea reductor (ensayo positivo):
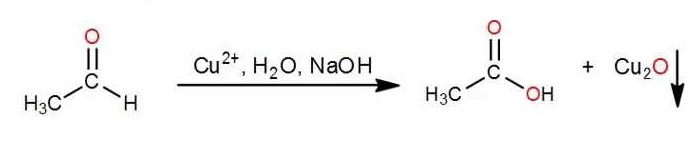
El óxido de cobre (I) - Cu2O- formado es de color ladrillo.
Observa el siguiente video:
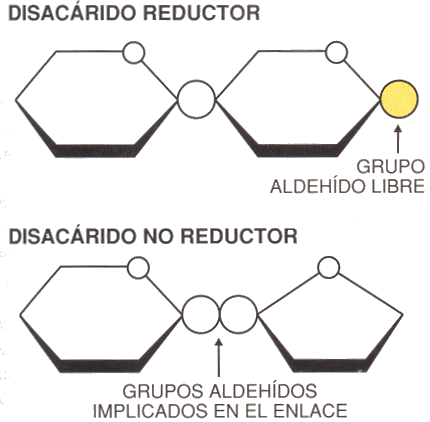
En el caso de los disacáridos, el extremo de la cadena que contiene el carbono anomérico libre (que no forma parte del enlace glucosídico) se conoce como el extremo reductor de la cadena. Los enlaces glucosídicos se hidrolizan con facilidad por acción de ácidos (pero son resistentes a la hidrólisis básica).
6.2. Reactivo de Tollens
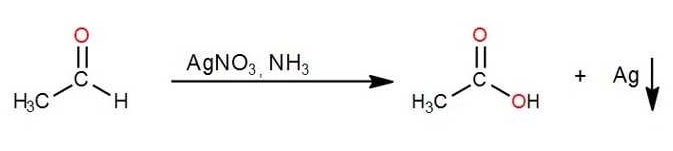
- Reactivo de Tollens:
También se puede analizar el poder reductor de los glúcidos con el reactivo de Tollens. En el caso de que la reacción sea positiva se observa un espejo de plata metálica en las paredes del recipiente (Ag).
La siguiente expresión representa lo que ocurre:
Puedes observar la actividad práctica en el siguiente video:
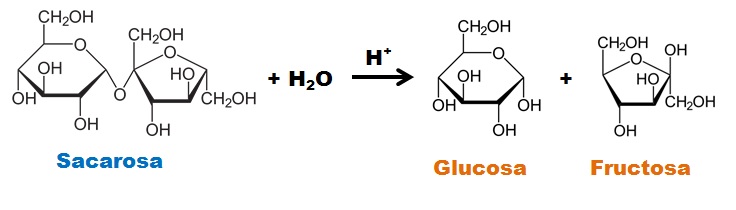
6.3. Hidrólisis de la sacarosa
La sacarosa es un disacárido no reductor ya que ambos carbonos anoméricos (presentan el grupo carbonilo) se encuentran formando parte del enlace glucosídico. En medio ácido la sacarosa se hidroliza, formando glucosa y fructosa. Tanto la glucosa como la fructosa son monosacáridos reductores.
Al estudiar el poder reductor de la sacarosa el resultado es negativo (color azul), pero los productos de su hidrólisis dan positivo al test de Fehling, observándose un color ladrillo.
Observa lo explicado en el siguiente video:
7. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Badui, S. (2006). Química de los alimentos. (Cuarta edición). México: Pearson.
- Lehninger y otros. (2005). Principios de Bioquímica. Omega.
- Laboratory 26: Carbohydrates. Recuperado de: http://www.khalidshadid.com/uploads/3/9/2/0/3920808/carbohydrates_main.pdf
Videos, páginas y/o simuladores utilizados:
- Sebastian Vaca. (2016). REACCION DE SELIWANOFF. [Archivo de video]. Recuperado de: https://www.youtube.com/watch?v=kEqslWNGD9Q
- knust oer. (2012).Barfoed's Test - Qualitative Test in Carbohydrates. [Archivo de video]. Recuperado de: https://www.youtube.com/watch?v=yQfMqvOxPrc
Videotutoriales Informática Educativa . (2019, julio 27). Prueba de Fehling. [Archivo de video]. Recuperado de: https://youtu.be/Loaa_agy5WUkoen2all . (2013, marzo 14). Chemistry experiment 16 - Silver mirror. [Archivo de video]. Recuperado de: https://youtu.be/biV1tzpUAwUviuisomriu . (2011, octubre 30). Hidrolisis de la sacarosa. [Archivo de video]. Recuperado de: https://youtu.be/rQd4ODSjnd0
Las imágenes utilizadas fueron tomadas de:
- Reacción de Seliwanoff. https://upload.wikimedia.org/wikipedia/commons/thumb/7/7d/Seliwanow.svg/600px-Seliwanow.svg.png
- Hemiacetal. Lehninger y otros. (2005). Principios de Bioquímica. Omega.
- Reacción de Fehling. https://1.bp.blogspot.com/-nS5AuuWdfWA/Vuo8NrzoJHI/AAAAAAAAAXk/uUh-kImxBO4scPPAdM1IqeBs1FurqpwfA/s1600/alcoholes%2B19.jpg
- Disacárido reductor y no reductor. https://www.um.es/molecula/gragluci/reduce.gif
- Fórmula de la sacarosa. https://upload.wikimedia.org/wikipedia/commons/thumb/1/1a/Saccharose2.svg/220px-Saccharose2.svg.png
- Fórmula de la glucosa. https://upload.wikimedia.org/wikipedia/commons/thumb/c/c6/Alpha-D-Glucopyranose.svg/157px-Alpha-D-Glucopyranose.svg.png
- Fórmula de la fructosa. https://upload.wikimedia.org/wikipedia/commons/thumb/6/67/Beta-D-Fructofuranose.svg/179px-Beta-D-Fructofuranose.svg.png