¿Qué son los aminoácidos? ¿Qué propiedades presentan?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué son los aminoácidos? ¿Qué propiedades presentan? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 19:38 |
1. Aminoácidos
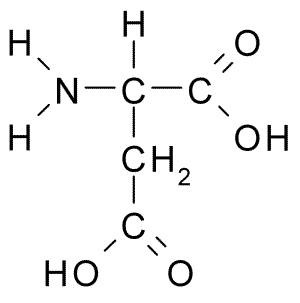
Estructura de un aminoácido
Un aminoácido es la unidad fundamental que constituye a las proteínas (la proteína es un polímero y los aminoácidos son sus monómeros).
Para la mayoría de los seres vivos (como los seres humanos) son 20 aminoácidos los que forman a las proteínas, pero existen otros dos aminoácidos proteicos en algunos seres vivos (selenocisteína y pirrolisina).
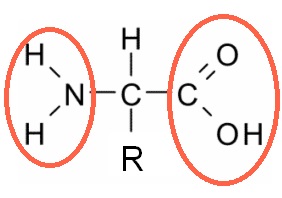
Cada aminoácido está formado por un átomo de carbono unido a:
- un grupo carboxilo
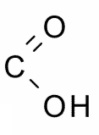 ,
, - un grupo amino
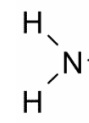 ,
, - un átomo de hidrógeno y
- un grupo radical (R) que permite identificar a cada aa particular (ya que es distinto para cada caso).
1.1. Formulas químicas de los aminoácidos
A continuación puedes observar la fórmula semidesarrollada de los 20 aminoácidos presentes en los seres vivos:
| Nombre del aminoácido | Fórmula semidesarrollada | Nombre del aminoácido | Fórmula semidesarrollada |
|---|---|---|---|
| Ácido aspártico |
| Isoleucina | 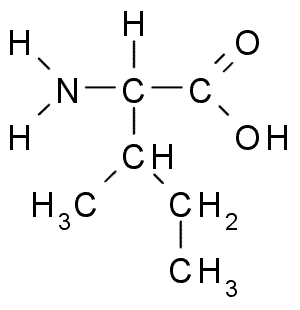 |
| Ácido glutámico | 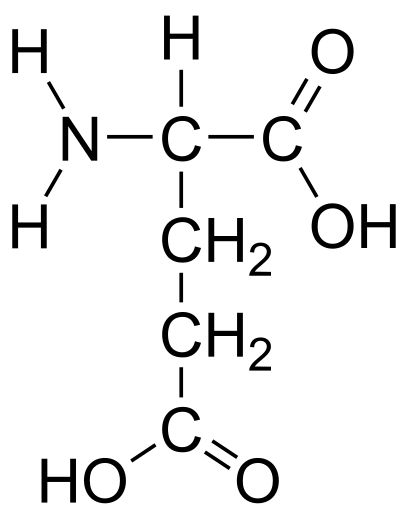 | Leucina | 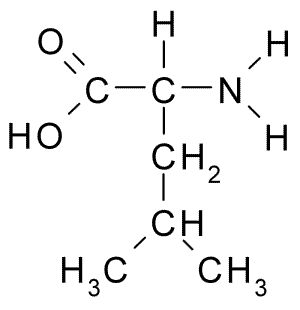 |
| Alanina | 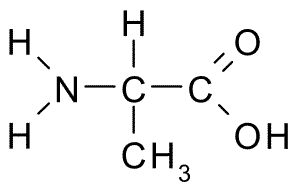 | Lisina | 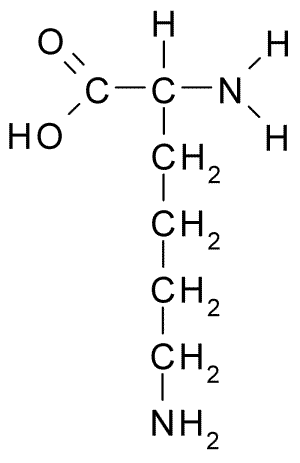 |
| Arginina | 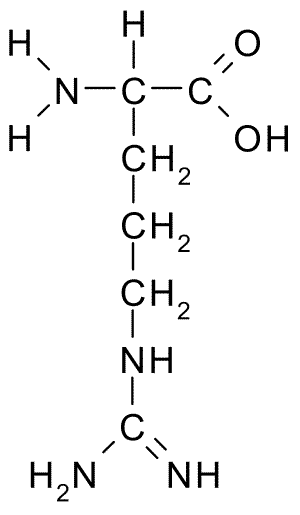 | Metionina | 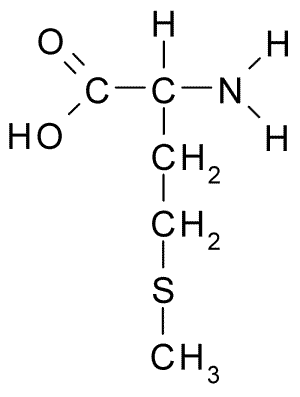 |
| Asparagina | 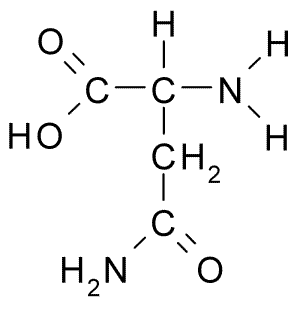 | Prolina | 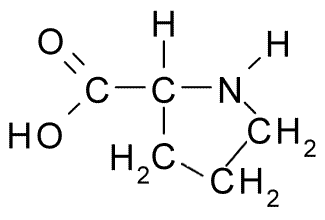 |
| Cisteína | 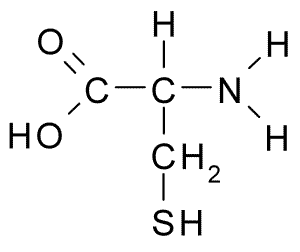 | Serina | 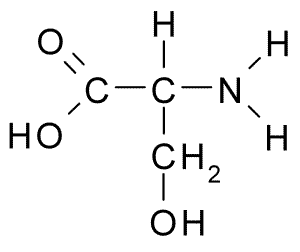 |
| Fenilalanina | 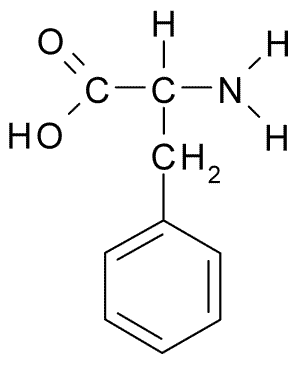 | Tirosina | 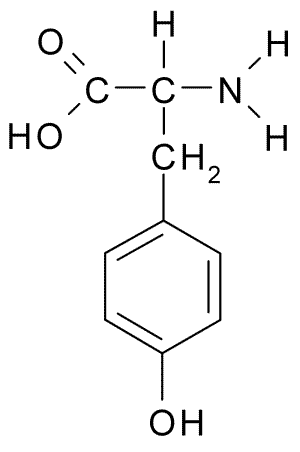 |
| Glicina | 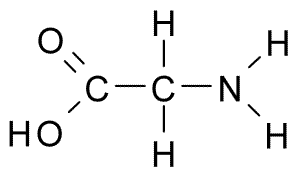 | Treonina | 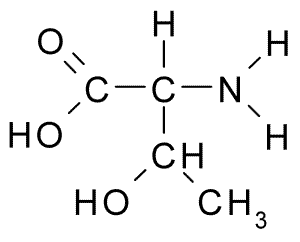 |
| Glutamina | 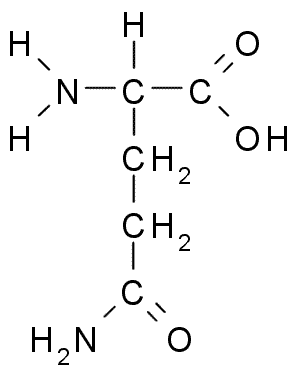 | Triptófano | 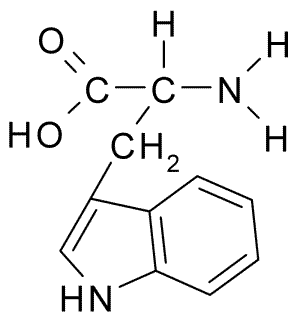 |
| Histidina | 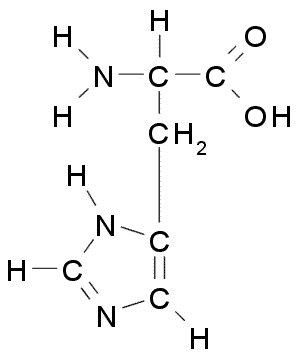 | Valina | 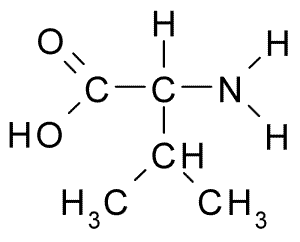 |
1.2. Clasificación de los aminoácidos
Los aminoácidos se pueden clasificar según diversos criterios:
1- Según la posición relativa de ambos grupos funcionales:
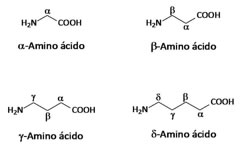
En el caso de los alfa aminoácidos ambos grupos están en carbonos contiguos.
2- Según sean o no imprescindibles para la vida. Los podemos clasificar en esenciales y no esenciales.
Las proteínas que aportan todos los aminoácidos esenciales se denominan completas. Un adulto debe consumir como mínimo 50 g por día de proteínas completas.
Busca cuáles son los aminoácidos esenciales para los adultos y para los niños.
3- Según su radical o cadena lateral.
En el siguiente recurso puedes observar esta clasificación.
- Neutros: contienen un sólo grupo amino y un sólo grupo carboxilo (monoamino-monoácidos).
- Ácidos: los que tienen más de un grupo carboxilo (monoamino-diácidos).
- Básicos: los que tienen más de un grupo amino (diamino-monoácido).
- Con radical hidrófobo o apolar.
- Con radical polar.
1.3. Estereosiomería
Repasando...
Llamamos isómeros a dos compuestos que tienen la misma fórmula molecular pero que difieren en el ordenamiento de sus átomos (isomería estructural) o en la distribución en el espacio de los mismos (isomería espacial). Dentro de la isomería espacial podemos hablar de isomería geométrica (los isómeros coinciden en la función química y en la posición del grupo funcional, difieren en la ubicación de los sustituyentes respecto al doble enlace) y de isomería óptica (hablamos de estereoisómeros, isómeros en los cuales los átomos están unidos en el mismo orden, pero están orientados de forma distinta en el espacio. Sólo se diferencian por la orientación espacial de sus átomos.).
Las moléculas no superponibles con sus imágenes especulares son quirales (todo grupo de puntos cuya imagen en espejo no puede hacerse coincidir consigo misma). Un compuesto cuyas moléculas son quirales puede existir como enantiómero; un compuesto cuyas moléculas son aquirales no puede existir como enantiómero. Los enantiómeros tienen propiedades físicas idénticas, exceptuando la dirección de rotación del plano de la luz polarizada y propiedades químicas idénticas, excepto frente a reactivos ópticamente activos.
Un átomo de carbono unido a 4 grupos diferentes es un centro quiral. En 19 de los 20 aminoácidos el carbono alfa es quiral, siendo la excepción la glicina, en la cual R = H. Por esta razón los aa pueden existir como estereoisómeros.
Ejemplo:
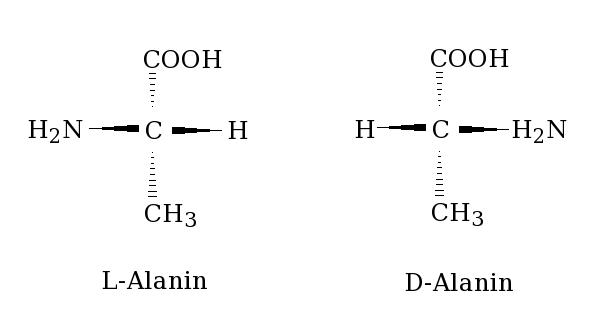
Todos los aminoácidos que constituyen las proteínas son pertenecientes a la serie L (se han encontrado de la serie D aminoácidos solamente en péptidos pequeños de las paredes celulares bacterianas y en algunos antibióticos peptídicos), siendo por convención, la forma en que se representan.
1.4. Enlace peptídico
Se da la condensación entre el grupo carboxilo de un aminoácido y el grupo amino de otro aminoácido formándose el ENLACE PEPTÍDICO (unión covalente).
Se da esta unión con pérdida de una molécula de agua.
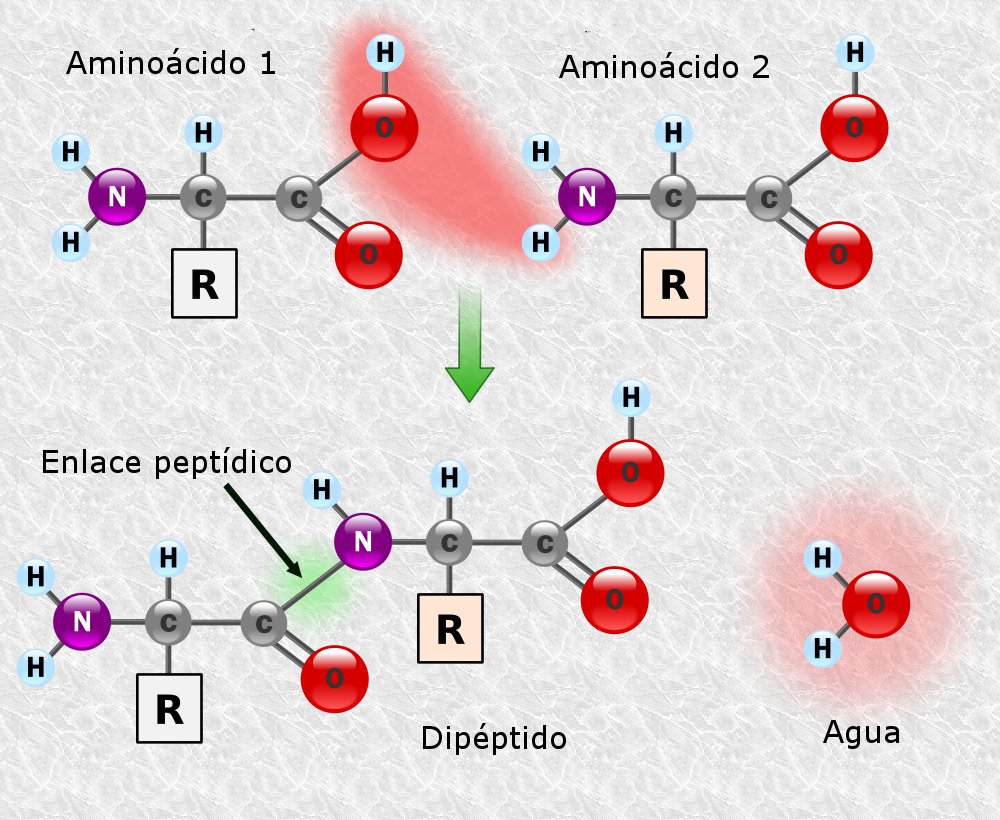
A los aminoácidos unidos entre sí se los denomina residuos.
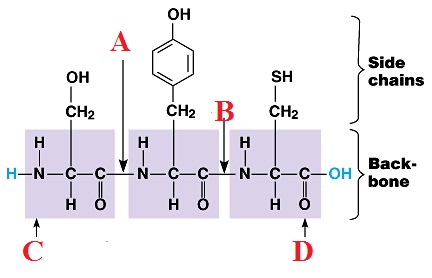
El grupo amino libre y el grupo carboxilo libre en extremos opuestos de la cadena peptídica se denominan N-terminal (amino terminal) y C-terminal (carboxilo terminal).
Por convención, los residuos de aminoácidos en una cadena polipeptídica son numerados a partir del N-terminal hacia el C-terminal.
Como puedes observar en la imagen a continuación, que representa a un tripéptido, los puntos A y B se corresponden a los enlaces peptídicos, el punto C al N-terminal y el punto D al C-terminal.
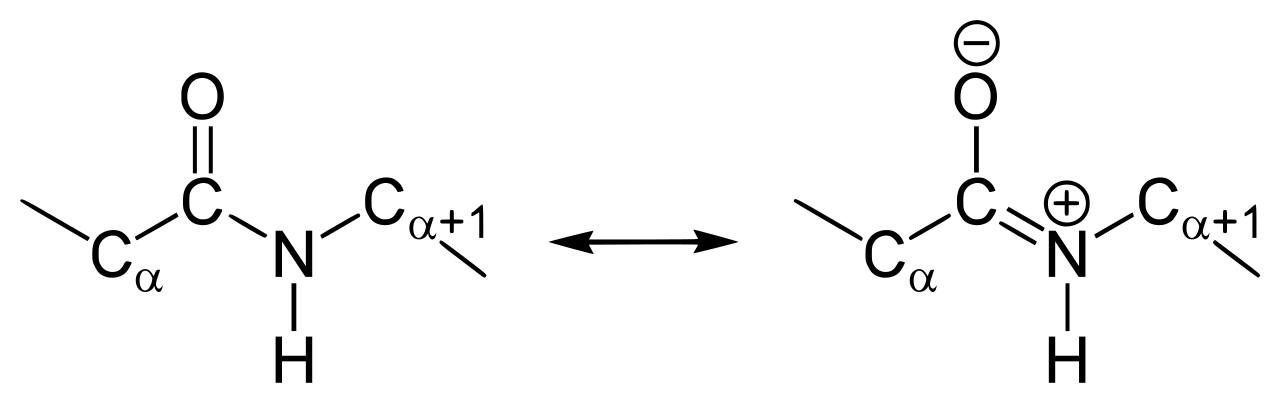
Características del enlace peptídico:
El enlace peptídico, es un enlace especial, que tiene cierto carácter de doble enlace ya que los electrones tienen cierta resonancia, lo que le otorga rigidez. Esto limita las posibilidades de conformación del polipéptido, y por ende de la proteína.
Según las posiciones de los carbonos α existen dos tipos de configuración, cis y trans. En la configuración cis los carbonos α se encuentran en su forma más acercada, mientras que en la forma trans los carbonos se encuentran en su forma más alejada, y por tanto más estable. Suele ser la configuración trans la favorecida en la conformación de la estructura de las proteína, aunque si participa la prolina, suele ser la configuración cis.
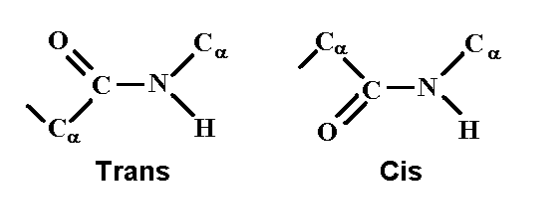
1.5. Clasificación de péptidos y nomenclatura de los aminoácidos
¿Cuándo hablamos de proteína y cuándo de péptido?

A continuación podrás ver la nomenclatura que utilizamos para nombrar a los residuos de aminoácidos que forman una cadena peptídica.
| Nombre del aa | Abreviación de 3 letras | Abreviación de 1 letra | Nomenclatura |
|---|---|---|---|
| Ácido aspártico | Asp | D | aspartil |
| Ácido glutámico | Glu | E | glutamil |
| Alanina | Ala | A | alanil |
| Arginina | Arg | R | arginil |
| Asparagina | Asn | N | asparaginil |
| Cisteína | Cys | C | cisteil |
| Fenilalanina | Phe | F | fenilalanil |
| Glicina | Gly | G | glicil |
| Glutamina | Gln | Q | glutamil |
| Histidina | His | H | histidil |
| Isoleucina | Ile | I | isoleucil |
| Leucina | Leu | L | leucil |
| Lisina | Lys | K | lisil |
| Metionina | Met | M | metionil |
| Prolina | Pro | P | prolinil |
| Serina | Ser | S | seril |
| Tirosina | Tyr | Y | tirosinil |
| Treonina | Thr | T | treonil |
| Triptófano | Trp | W | triptofanil |
| Valina | Val | V | valinil |
1.6. Formación de dipéptidos
Representaremos a través de una ecuación la formación de un dipéptido.
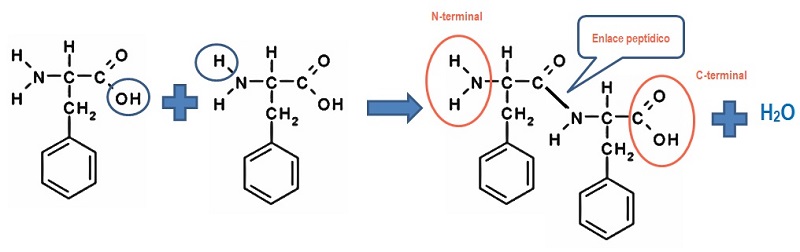
Como puedes observar el grupo carboxilo del primer aminoácido reacciona con el grupo amino del segundo aminoácido, formándose el enlace peptídico y liberándose una molécula de agua.
Para asignar el nombre a cualquier péptido se comienza por el residuo de aminoácido que contiene el N-terminal, cambiándose el nombre del aminoácido como vimos en la sección anterior, y se repite el procedimiento con todos los demás residuos que tenga el péptido, hasta llegar al que contiene el C-terminal que mantiene el nombre original del aminoácido del que proviene.
En el ejemplo anterior el nombre del dipéptido es: fenilalanil-fenilalanina (se podría abreviar Phe-Phe o F-F).
2. Créditos
Autoría del recurso: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Portal Uruguay Educa.
Abril de 2019
Bibliografía consultada:
- Lehninger y otros. (2005) Principios de Bioquímica. Omega.
- Alegría, Mónica y otros. (1999). Química II. Argentina: Santillana
- Aminoácidos. Recuperado de: https://eva.udelar.edu.uy/pluginfile.php/908906/mod_folder/content/0/01.%20amino%C3%A1cidos.pdf?forcedownload=1
Vídeos, páginas y/o simuladores utilizados:
KhanAcademyEspanol. - Gálvez, F. (2017). El enlace peptídico. Recuperado de: https://www.hidden-nature.com/el-enlace-peptidico/
- Educaplus. Aminoácidos. Recuperado de: http://www.educaplus.org/game/aminoacidos
Las imágenes utilizadas fueron tomadas de:
- Fórmula general de un aa: https://upload.wikimedia.org/wikipedia/commons/0/0e/Aminoacido.jpg
- Fórmulas semidesarrollada de los aa: https://commons.wikimedia.org/wiki/Amino_acid
- Clasificación de los aa: http://www.uv.mx/cienciahombre/revistae/vol23num3/articulos/aminoacidos/img/aminoacidos.jpg
- Formas D y L de la alanina: http://upload.wikimedia.org/wikipedia/commons/4/46/L-D-Alanin.jpg
- Formación del enlace peptídico: http://www.bionova.org.es/biocast/documentos/figura/figtem08/figurat0805.jpg
- N-terminal y C- terminal: https://lidiaconlaquimica.files.wordpress.com/2015/07/proteinas-12-peprtido.gif
- Resonancia del enlace peptídico: https://upload.wikimedia.org/wikipedia/commons/thumb/8/83/Mesomeric_peptide_bond.svg/1280px-Mesomeric_peptide_bond.svg.png
- Isomería geométrica del enlace peptídico: https://www.drosophila.es/wp-content/uploads/2014/02/cistrans.png