¿Qué son las proteínas? ¿Qué funciones cumplen? ¿Qué niveles presentan?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué son las proteínas? ¿Qué funciones cumplen? ¿Qué niveles presentan? |
| Imprimido por: | Invitado |
| Día: | jueves, 6 de marzo de 2025, 23:35 |
Tabla de contenidos
1. Proteínas
Introducción
Las proteínas son biopolímeros formados por más de 100 α-aminoácidos unidos mediante enlaces peptídicos. Los elementos que las forman son C, H, O, N; en muchas de ellas hay S y P, y pocas tienen Fe, Zn, Cu, Co y Mg. De todos los elementos que forman las proteínas, el nitrógeno es el que las caracteriza; las proteínas son los compuestos nitrogenados por excelencia en los seres vivos.
El término "proteína" proviene del griego proteios que significa "lo primero o primordial". Ello indica la importancia de estos compuestos en las células. El nombre fue asignado en 1838 a un grupo de sustancias de origen animal y vegetal que tenían en común el elemento nitrógeno en su composición.
Repasa el video introductorio.
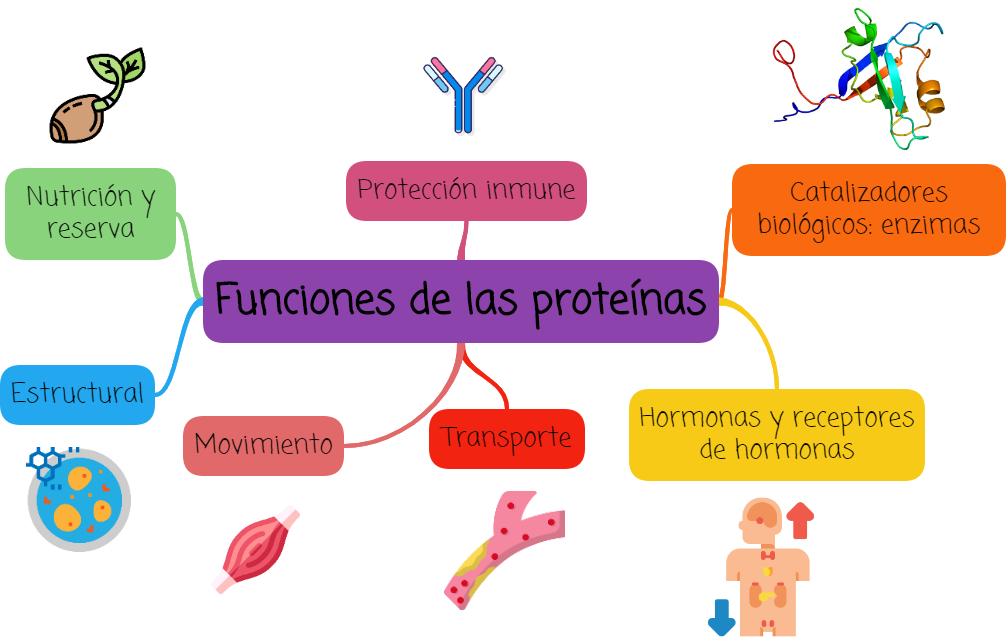
1.1. Funciones
- ESTRUCTURAL: Las membranas
plasmáticas y gran cantidad de tejidos están constituidas por proteínas que
actúan como filamentos y “anclas” de soporte. El colágeno es una proteína
fibrosa que forma parte de los tendones y cartílagos, mientras que la queratina forma el pelo y las uñas; igualmente se
incluye la fibrina de la seda y las telarañas.
- MOVIMIENTO: Algunas
proteínas permiten que la célula o determinadas organelas se muevan, cambien de
forma, etc. La contracción de los músculos se realiza a expensas de que cada
monofilamento grueso contiene varios cientos de moléculas de la proteína miosina, mientras que los delgados
contienen dos cadenas de la proteína actina (las miofibrillas están formadas
por hileras que alternan miofilamentos gruesos y delgados con sus extremos
traslapados). Las integrinas y tubulinas, que mueven el sistema citoesquelético
de la célula, y la dineína de cilias y flagelos también se incluyen en este
grupo.
- TRANSPORTE: Algunas
proteínas trasportan sustancias a ambos lados de la membrana plasmática, y
otras, en los líquidos extracelulares. Por ejemplo, en el plasma sanguíneo existen
lipoproteínas que trasportan los lípidos desde el hígado hasta otros órganos, y
en los glóbulos rojos, la hemoglobina, que trasporta el dioxígeno a los tejidos
para que participe en la oxidación de los nutrientes.
- HORMONAS Y RECEPTORES DE HORMONAS: Estas proteínas permiten regular la actividad fisiológica y metabólica de las células. Algunas son hormonas de naturaleza proteica, es decir que actúan como mensajeros químicos que disparan acciones determinadas en los órganos blanco. En esta categoría se incluyen la insulina, la tiroxina y la hormona del crecimiento. Otras permiten fijar nucleótidos o se fijan al ADN.
- PROTECCIÓN INMUNE: Algunas
proteínas defienden el organismo ante una invasión o agresión externa. Los
anticuerpos son proteínas producidas en los glóbulos blancos que permiten
reconocer y neutralizar bacterias y virus. La trombina y el fibrinógeno, por su
parte, son proteínas que actúan en la coagulación de la sangre, cuando se daña
el sistema vascular.
- NUTRICIÓN Y RESERVA: Algunas
proteínas resultan nutrientes celulares; por ejemplo, la caseína de la leche,
la ovoalbúmina del huevo y el endosperma de las semillas.
- CATALIZADORES BIOLÓGICOS: Muchas proteínas globulares, como las catalasas, las permeasas, las peroxidasas y los citocromos, son capaces de acelerar la rapidez de las reacciones químicas, es decir, actúan como catalizadores biológicos. Por ejemplo, la pepsina rompe las proteínas en péptidos pequeños y la renina separa la leche en fracciones líquidas y sólidas, mientras que la lipasa actúa sobre las grasas.
1.2. Clasificación de las proteínas
Visita el siguiente sitio y a partir de la información que allí aparece realiza una tabla de datos que resuma las diferentes formas de clasificar a las proteínas.
1.3. Valor biológico de las proteínas
El valor biológico de una proteína depende fundamentalmente de su composición en aminoácidos indispensables. Conocida ésta es posible predecir, dentro de ciertas limitaciones, su comportamiento en el organismo; para ello solo es necesario contar con un adecuado patrón de comparación. El problema fundamental para seleccionar un patrón reside en el hecho de que el valor biológico de una proteína no es constante, sino que depende de una serie de variables entre las que se encuentran la especie, edad, y el estado fisiológico.
El primer patrón utilizado fue la proteína del huevo. Su uso ha sido muy criticado ya que su composición en aminoácidos no es constante y el contenido de algunos aminoácidos es excesivo. Por esta última razón la mayor parte de las proteínas alimenticias aparecen como deficitarias cuando se las compara con este patrón en una proporción mayor que la detectada por los métodos biológicos. Además no siempre es posible identificar correctamente al aminoácido limitante.
En los últimos años, los estudios acerca de las necesidades de aminoácidos se han basado en métodos que evalúan el metabolismo de los mismos, tales como el método de oxidación directa del aminoácido, que consiste en marcar con 13C al aminoácido en estudio y luego cuantificar la producción de 13CO2 en el aire expirado, que es un indicador de la oxidación irreversible del aminoácido y por lo tanto señala las pérdidas obligatorias del mismo.
En la evaluación de la calidad de una proteína alimenticia, se deben considerar dos factores: su contenido en aminoácidos indispensables y su digestibilidad.
- El valor biológico de una proteína depende de la composición de aminoácidos y de las proporciones entre ellos y es máximo cuando estas proporciones son las necesarias para satisfacer las demandas de nitrógeno para el crecimiento, la síntesis, y reparación tisular. El valor biológico, se halla además condicionado por las diferentes velocidades de recambio de aminoácidos en los distintos tejidos, y por consiguiente no es una constante sino que se halla influido por la especie, la edad y el estado fisiológico del individuo.
- El otro factor que condiciona la utilización de las proteínas alimenticias, modificándolas en forma variable es la digestibilidad. La digestibilidad será igual a 100 cuando el nitrógeno ingerido sea totalmente absorbido. El contenido en nitrógeno en las heces representa la cantidad no absorbida, es decir la proporción de proteínas que por sus características físicas o propiedades químicas resistieron el ataque de las enzimas proteolíticas. Parte de estas pérdidas fecales representan las pérdidas obligatorias de nitrógeno que proviene de las secreciones endógenas.

Observa el valor biológico de algunas de las proteínas presentes en alimentos en la siguiente tabla:
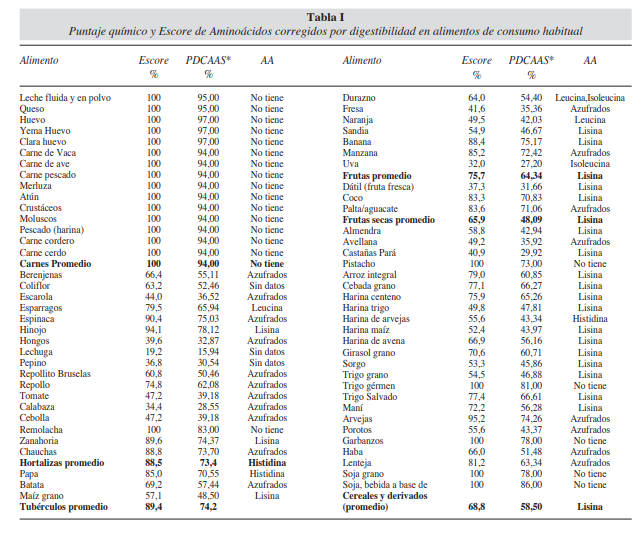
Las calificaciones por encima de 1.0 se nivelan pues todos los aminoácidos en exceso no son utilizados para la síntesis de tejidos, sino que son desaminados y oxidados para ser utilizados en el metabolismo energético o almacenados como tejido adiposo.
2. Interacciones entre los aminoácidos
Fuerzas intrapartícula:
- Enlace peptídico: enlace covalente
- Puentes disulfuro: entre dos aa cisteína.
- Enlace amida (-CO-NH-): entre las cadenas laterales de la Lys y un aa dicarboxílico (Glu o Asp).
Fuerzas interpartícula:
- Ion-ion: fuerzas electrostáticas entre cadenas laterales ionizadas, con cargas opuestas.
- Dipolo-dipolo (enlace de hidrógeno): entre las cadenas laterales de aminoácidos polares.
- Dipolo inducido-dipolo inducido: interacciones hidrofóbicas entre cadenas laterales apolares.
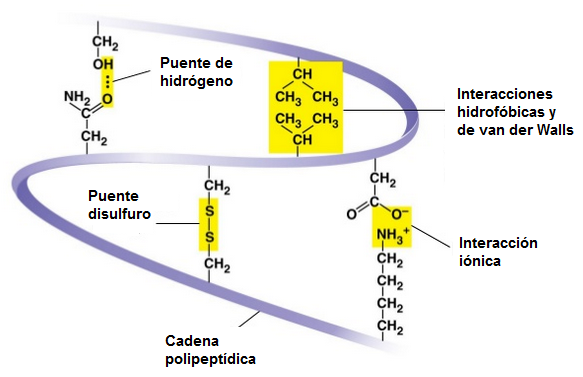
Estas interacciones nos permiten comprender los niveles que presentan las proteínas.
Las fuerzas que estabilizan la estructura terciaria de una proteína se establecen entre las distintas cadenas laterales de los aminoácidos que la componen. Los enlaces propios de la estructura terciaria pueden ser de dos tipos: covalentes y no covalentes.
Como resultado de estas interacciones, en las proteínas con estructura terciaria globular:
- Las cadenas laterales con carácter apolar se
orientan hacia el interior de la molécula evitando las interacciones con el solvente, y forman un núcleo compacto con carácter hidrofóbico.
- Las cadenas laterales de los
aminoácidos polares se localizan en la superficie de la molécula,
interaccionando con el agua y permitiendo que la proteína permanezca en solución.
- No todas estas interacciones contribuyen por igual al mantenimiento de la estructura terciaria. Obviamente, el enlace que aporta más estabilidad es el de tipo covalente, y entre los no covalentes, las interacciones más importantes son las de tipo hidrofóbico, ya que exigen una gran proximidad entre los grupo apolares de los aa.
La siguiente tabla resume lo analizado:
|
Tipo |
Mecanismo |
Energía (kcal/mol) |
Distancia de interacción (Å) |
Grupos que interaccionan |
|---|---|---|---|---|
|
Covalente |
Comparten electrones |
30-100 |
1-2 |
C-C, C-N, C=O, C-H, S-S |
|
Interacciones electrostáticas |
Atracción entre cargas opuestas |
10-20 |
2-3 |
NH3+ COO- |
|
Enlaces de Hidrógeno |
El hidrógeno es compartido entre dos átomos |
2-10 |
2-3 |
N-H ||||| O=C N-H ||||| O-H |
|
Fuerzas de London |
Dipolos inducidos |
1-3 |
3-5 |
Grupos apolares |
3. Estructura de las proteínas
Observa el siguiente video. Recuerda activar la traducción de los subtítulos al español.
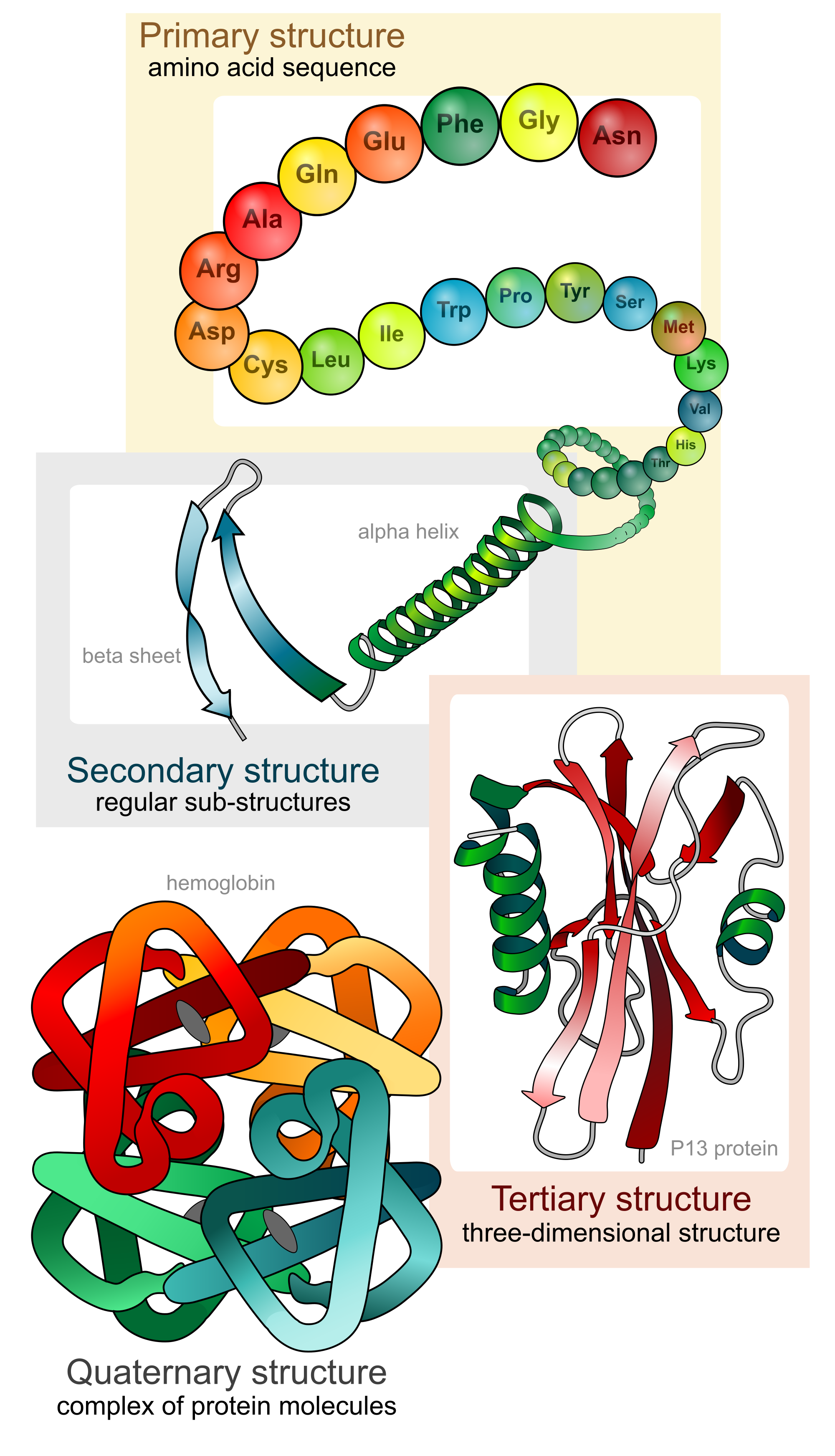
Niveles estructurales
- ESTRUCTURA PRIMARIA: Es la secuencia de los residuos de aa enlazados covalentemente (es decir, el número de residuos de aminoácidos presentes y el orden de los mismos), describe la estructura lineal, unidimensional de una proteína. Las posibilidades de estructuración a nivel primario son casi ilimitadas.
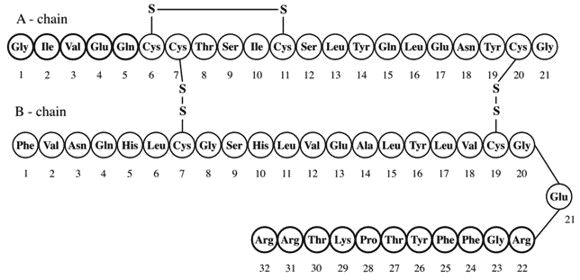
Conocer la estructura primaria de una proteína no solo es importante para entender su función (ya que esta depende de la secuencia de aminoácidos y de la forma que adopte), sino también en el estudio de enfermedades genéticas. Es posible que el origen de una enfermedad genética radique en una secuencia anormal. Esta anomalía, si es severa, podría resultar en que la función de la proteína no se ejecute de manera adecuada o, incluso, en que no se ejecute en lo absoluto.
3.1. Nivel secundario
ESTRUCTURA SECUNDARIA: La estructura secundaria de las proteínas es el plegamiento que la cadena polipeptídica adopta gracias a la formación de enlaces o puentes de hidrógeno entre los átomos que forman el enlace peptídico. Los enlaces de hidrógeno se establecen entre los grupos -CO- y -NH- del enlace peptídico (el primero como aceptor de H, y el segundo como donador de H). De esta forma, la cadena polipeptídica es capaz de adoptar conformaciones de menor energía libre, y por tanto, más estables.
Son ejemplos las α–hélice y las láminas β, y también tipo colágeno (tres cadenas peptídicas retorcidas entre sí formando como un cordón).
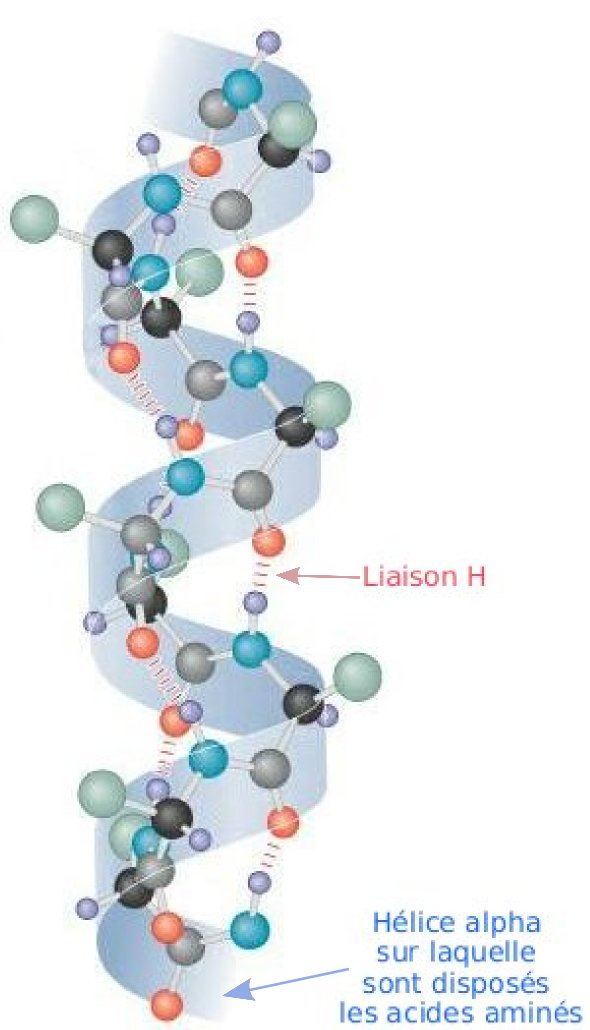
Alfa hélice: Esta estructura se mantiene gracias a los enlaces de hidrógeno intracatenarios formados entre el grupo -NH de un enlace peptídico y el grupo -C=O del cuarto aminoácido que le sigue. La cadena polipeptídica se enrolla en espiral sobre sí misma debido a los giros producidos en torno al carbono alfa de cada aminoácido. Las cadenas laterales de los aminoácidos se sitúan en la parte externa del helicoide, lo que evita problemas de impedimentos estéricos. En consecuencia, esta estructura puede albergar a cualquier aminoácido, a excepción de la prolina, cuyo carbono no tiene libertad de giro, por estar integrado en un heterociclo. Por este motivo, la prolina suele determinar una interrupción en la conformación en α-hélice. Los aminoácidos muy polares (Lys, Glu) también desestabilizan la hélice porque los enlaces de hidrógeno pierden importancia frente a las interacciones electrostáticas de atracción o repulsión.
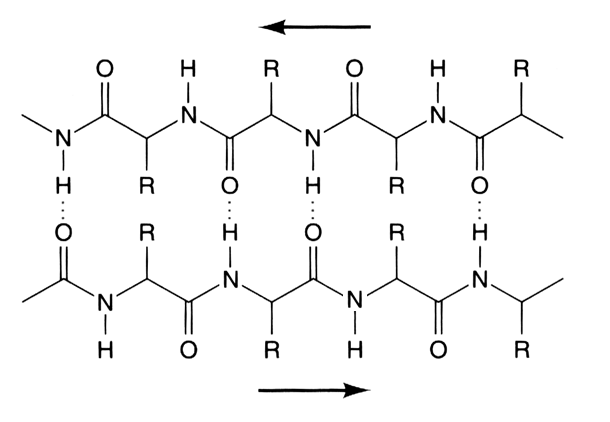
Láminas beta: Cuando la cadena principal de un polipéptido se estira al máximo que permiten sus enlaces covalentes se adopta una configuración espacial denominada estructura β, que suele representarse como una flecha. En esta estructura las cadenas laterales de los aminoácidos se sitúan de forma alternante a la derecha y a la izquierda del esqueleto de la cadena polipeptídica. Las estructuras β de distintas cadenas polipeptídicas o bien las estructuras β de distintas zonas de una misma cadena polipeptídica pueden interaccionar entre sí mediante puentes de hidrógeno, dando lugar a estructuras laminares llamadas por su forma hojas plegadas u hojas β. Cuando las estructuras β tienen el mismo sentido, la hoja β resultante es paralela, y si las estructuras β tienen sentidos opuestos, la hoja plegada resultante es antiparalela.
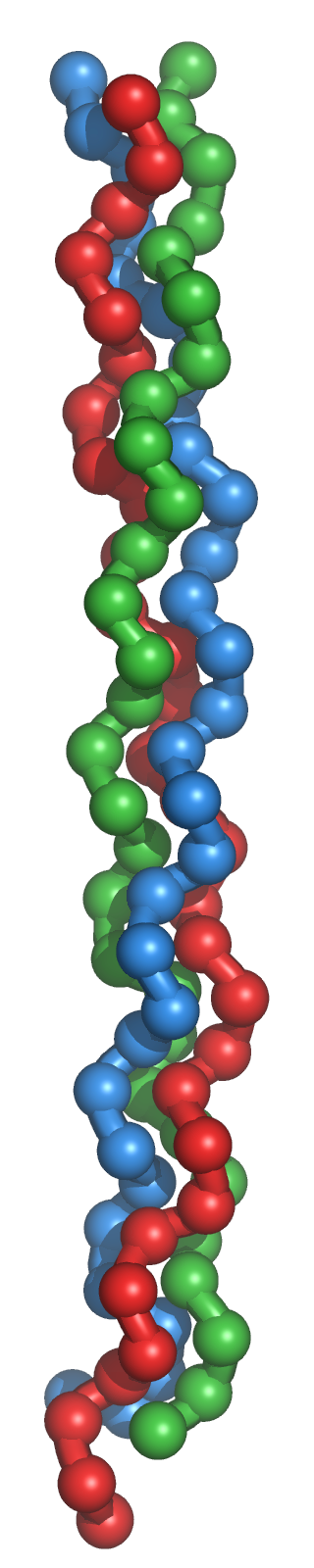
Tipo colágeno: Es una variedad particular de la estructura secundaria, característica del colágeno. El colágeno es una importante proteína fibrosa presente en tendones y tejido conectivo con función estructural ya que es particularmente rígida. Presenta una secuencia típica compuesta por la repetición periódica de grupos de tres aminoácidos. El primer aminoácido de cada grupo es Gly, y los otros dos son Pro (o hidroxiprolina) y un aminoácido cualquiera: -(G-P-X)-. La frecuencia periódica de la Prolina condiciona el enrollamiento peculiar del colágeno en forma de hélice levógira. La glicina, sin cadena lateral, permite la aproximación entre distintas hélices, de forma que tres hélices levógiras se asocian para formar un helicoide dextrógiro.
PARA TENER EN CUENTA: A pesar que las proteínas fibrosas tienen un solo tipo de estructura secundaria, las proteínas globulares pueden presentar varios tipos de estructura secundaria en la misma molécula.
La unión entre los tipos de estructuras secundarias se llaman bucles (2 a 16 aa) y si son muy cortos giros (2 a 3 aa).
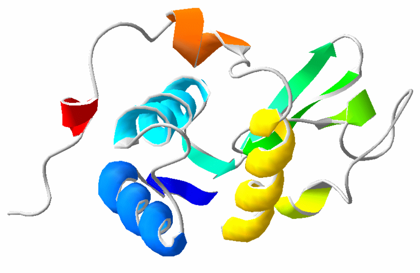
3.2. Nivel terciario
ESTRUCTURA TERCIARIA: Es el plegado de las cadenas polipeptídicas en dominios. Se refiere a la estructura tridimensional de la proteína globular entera. Algunos residuos de aa muy alejados en la estructura primaria quedan juntos en la terciaria.
La estructura terciaria de una proteína es la responsable directa de sus propiedades biológicas, ya que la disposición espacial de los distintos grupos funcionales determina su interacción con los diversos ligandos.
Se distinguen dos tipos de estructura terciaria:
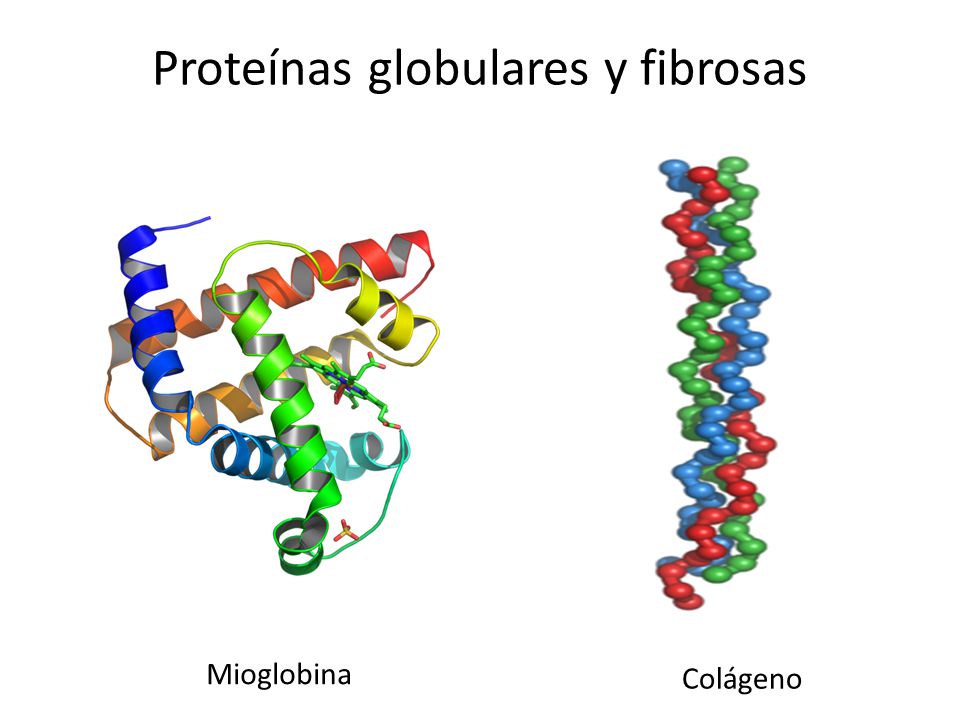
- Proteínas con estructura terciaria de tipo fibroso en las que una de las dimensiones es mucho mayor que las otras dos. Son ejemplos el colágeno, la queratina del cabello o la fibroína de la seda, En este caso, los elementos de estructura secundaria (hélices α u hojas β) pueden mantener su ordenamiento sin recurrir a grandes modificaciones, tan sólo introduciendo ligeras torsiones longitudinales, como en las hebras de una cuerda.
- Proteínas con estructura terciaria de tipo globular, más frecuentes, en las que no existe una dimensión que predomine sobre las demás, y su forma es aproximadamente esférica. En este tipo de estructuras se suceden regiones con estructuras al azar, hélice α hoja β, acodamientos y estructuras supersecundarias.
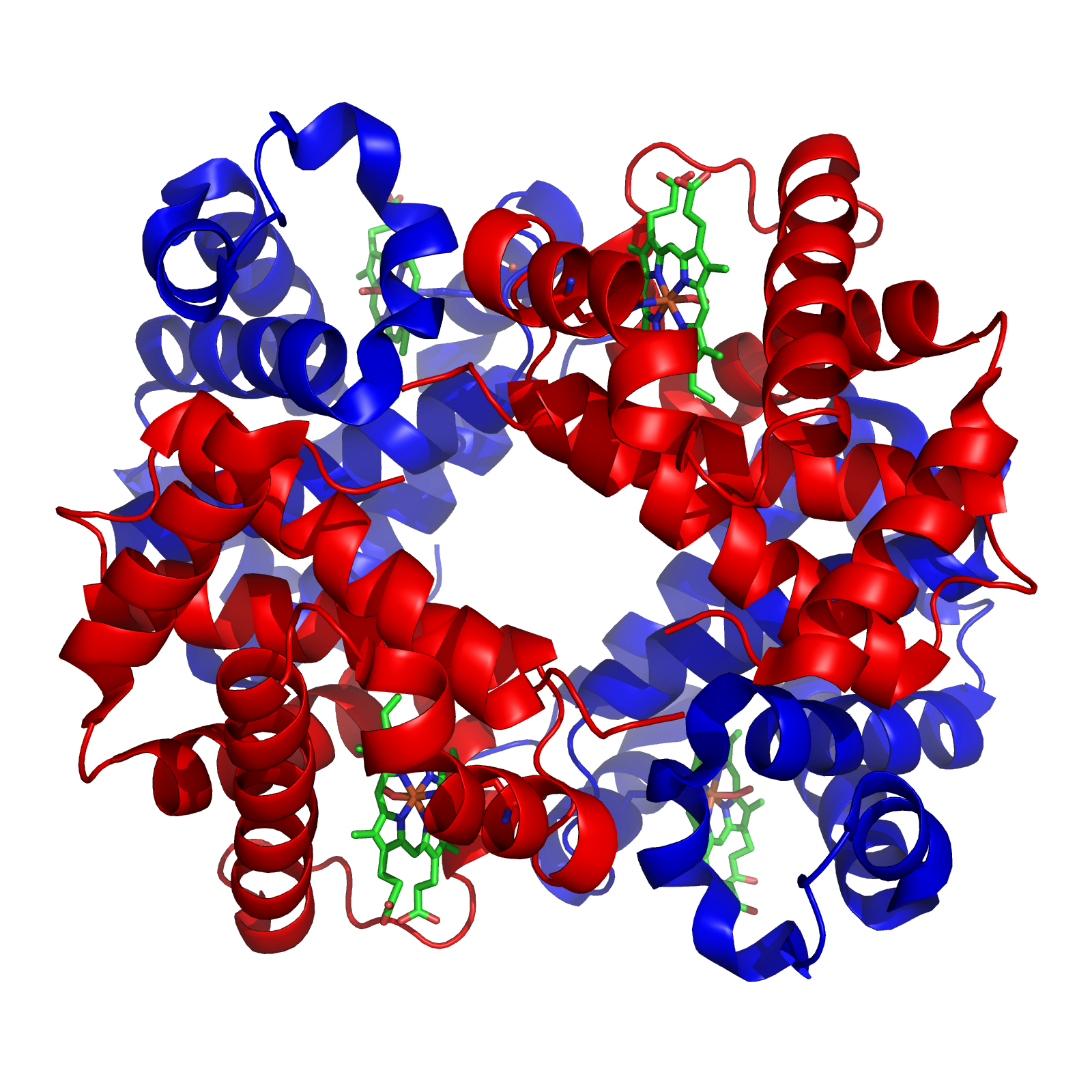
3.3. Nivel cuaternario
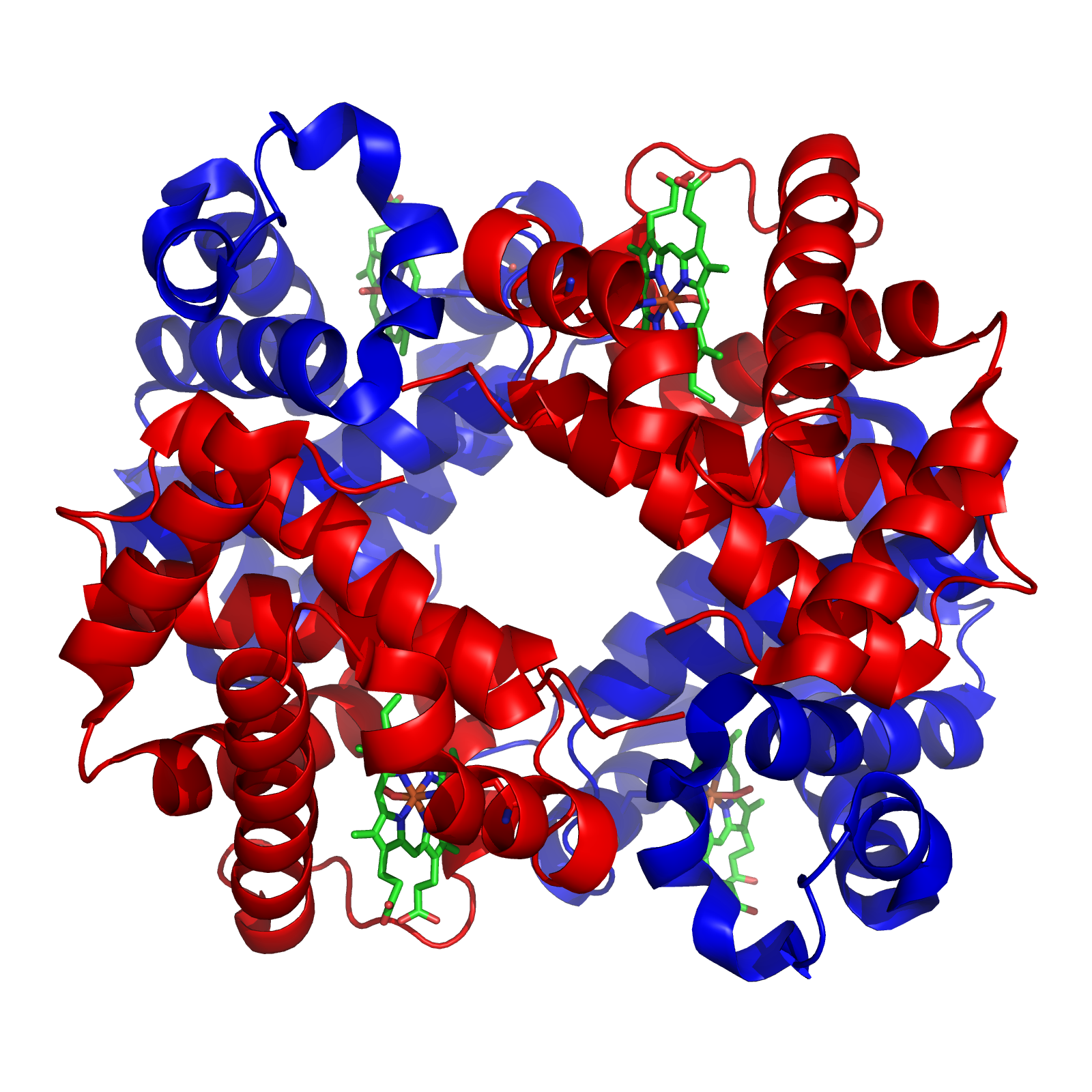
ESTRUCTURA CUATERNARIA: Algunas proteínas la presentan. Se limita a proteínas con múltiples unidades y se refiere a la organización de las mismas. Cada unidad es un polipéptido por separado. Se trata de proteínas oligoméricas. La estructura cuaternaria modula la actividad biológica de la proteína y la separación de las subunidades a menudo conduce a la pérdida de funcionalidad. Las fuerzas que mantienen unidas las distintas cadenas polipeptídicas son, en líneas generales, las mismas que estabilizan la estructura terciaria.
La estructura cuaternaria deriva de la conjunción de varias cadenas peptídicas que, asociadas, conforman un multímero, que posee propiedades distintas a la de sus monómeros componentes.
Por ejemplo la siguiente imagen representa a la hemoglobina.
3.4. En resumen
Observa las siguientes imágenes que representan lo anteriormente analizado en este capítulo.
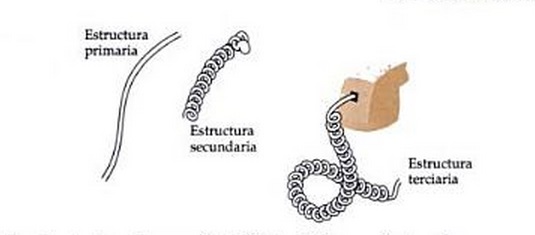
La siguiente imagen es una analogía que puede resultarte útil.
3.5. Aplicación a un ejemplo
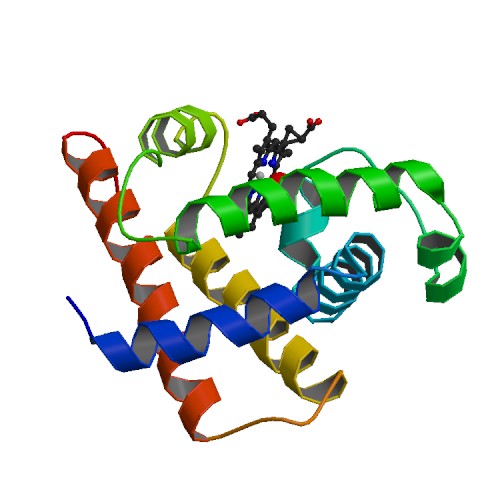
La mioglobina es una pequeña proteína de color rojo brillante. Es muy común en las células musculares y en gran medida es la responsable del característico color rojo de la carne. Su trabajo es almacenar el dioxígeno que deberá ser usado en condiciones de trabajo muscular intenso.
La siguiente imagen representa a la mioglobina. Dicha proteína se encuentra formada por una cadena polipeptídica de 153 residuos aminoacídicos.
La siguiente imagen detalla aspectos estructurales de la mioglobina:
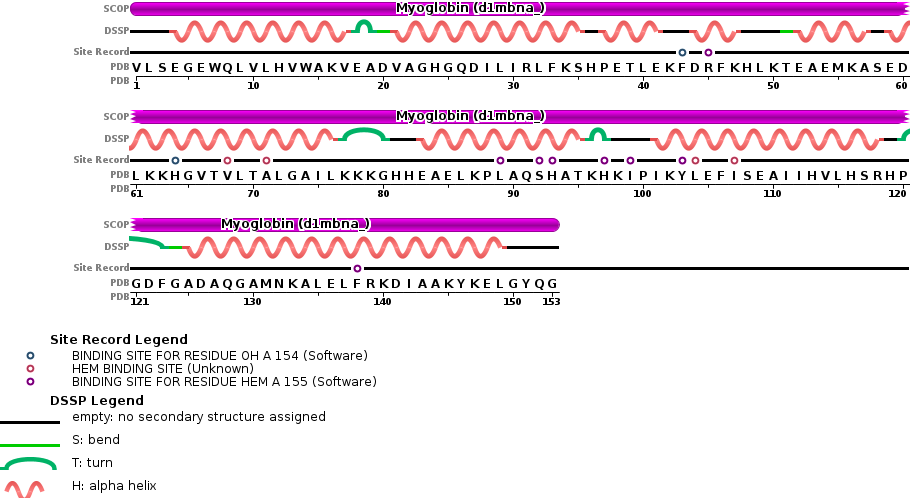
¿Qué niveles estructurales presenta?
- Primaria: 153 residuos aa.
- Secundaria: 9 alfa hélice, también giros y bucles.
- Terciaria: globular (forma esférica).
- Cuaternaria: no presenta (ya que se indica que presenta una sola cadena polipeptídica).
Función: transporte de dioxígeno.
4. Desnaturalización
Visita el siguiente recurso para repasar lo que ocurre cuando una proteína se desnaturaliza, por ejemplo cuando cocinamos un huevo.
La forma de las proteínas puede verse afectada por el calor, los ácidos, las sales y la acción mecánica. Este cambio de forma se llama "desnaturalización" (modificación de la estructura natural) y, como consecuencia de este proceso, se producen variaciones en las texturas de las preparaciones. Las proteínas globulares se despliegan, y esto aumenta su afinidad con el agua. El estado final de la desnaturalización es la coagulación, en cuyo transcurso las proteínas se unen unas con otras, adquieren una forma diferente a la nativa y dejan pocos enlaces libres para relacionarse con el medio.
Los agentes desnaturalizantes como el calor, ácidos o bases, agitación, rayos x, oxidación o reducción, sales de metales pesados etc., actúan rompiendo las atracciones interpartícula como los enlaces de hidrógeno y puentes salinos. Desaparece la estructura secundaria, terciaria y cuaternaria, manteniendo el esqueleto covalente de la cadena polipeptídica (estructura primaria). Al destruirse la ordenación tridimensional característica de la proteína la o las cadenas polipeptídicas se despliegan o desenrollan originando estructuras al azar.
Al desnaturalizarse la proteína pierde la actividad biológica y casi siempre la proteína coagula.
5. Créditos
Autoría del recurso: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Portal Uruguay Educa.
Abril de 2019
Bibliografía consultada:
- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
- Alegría, Mónica y otros. (1999). Química II. Argentina: Santillana
- Lehninger y otros. (2005). Principios de Bioquímica. Omega.
- Luque, V. Estructura y propiedades de las proteínas. Recuperado de: https://www.uv.es/tunon/pdf_doc/proteinas_09.pdf
- Koppmann, M. (2011). Manual de Gastronomía Molecular. (2da Edición). Buenos Aires, Argentina: Siglo Veintiuno.
- Suárez López, M., Kizlansky, A. y López, L. (2006). Evaluación de la calidad de las proteínas en los alimentos calculando el escore de aminoácidos corregido por digestibilidad. Nutrición Hospitalaria. 21 (1). 47-51. Recuperado de: http://www.nutricionhospitalaria.com/pdf/2978.pdf
Badui, S. (2006). Química de los alimentos. (Cuarta edición). Pearson.
Aldo Neñer (2011, 29 de mayo). Proteinas [Archivo de vídeo]. Recuperado de: https://youtu.be/_xxDqknxZro?list=PL4392AB16E065A654- González, J. (s.f.). Curso de Biomoléculas. Clasificación de las proteínas. Recuperado de: http://www.ehu.eus/biomoleculas/proteinas/prot1.htm
- González, J. (s.f.). Curso de Biomoléculas. Estructura terciaria de las proteínas. Recuperado de: http://www.ehu.eus/biomoleculas/proteinas/prot43.htm
RCSBProteinDataBank. ( 2013, 4 de septiembre). What is a Protein? Learn about the 3D shape and function of macromolecules. [Archivo de vídeo]. Recuperado de: https://youtu.be/qBRFIMcxZNM- Simulador de desnaturalización. Porto, A. http://www.bionova.org.es/. Recuperado de: http://www.bionova.org.es/animbio/anim/dnareplicacion/menu.swf
- Protein Data Bank. 1MBN. The stereochemistry of the protein myoglobin. doi: 10.2210/pdb1MBN/pdb. Recuperado de:
https://www.rcsb.org/structure/1MBN
- http://hemoglobina.net/files/img/hemoglobina.jpg
- https://www.wikidoc.org/images/b/bd/Insulin_glargine07.png
- https://upload.wikimedia.org/wikipedia/commons/9/96/AlphaHelixProtein_fr.jpg
- https://userscontent2.emaze.com/images/aef3244a-d7f3-4f67-a6be-57dddd005448/6332082dc71c0e81cb96eed0dacffd92.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/f/fb/Sucrose_porin_1a0s.png/250px-Sucrose_porin_1a0s.png
- https://www.thefamousbirthdays.com/photo/commons/d/d1/wk_37589_25399_large.jpg
- https://i.blogs.es/ebd1f9/lisozima/450_1000.png
- https://tiposde.com.mx/wp-content/uploads/2017/11/Globulares-y-fibrosas.jpg
- http://nextews.com/images/46/a2/46a264e654da0e42_354x242.jpg
- https://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/Main_protein_structure_levels_cs.svg/2000px-Main_protein_structure_levels_cs.svg.png
- Tomada de: Hill, J y Kolb, D. (1999). Química para el nuevo milenio. (8va Edición). México: Prentice Hall.
- Captura de pantalla del simulador de desnaturalización. Porto, A. http://www.bionova.org.es/. Recuperado de: http://www.bionova.org.es/animbio/anim/dnareplicacion/menu.swf
- https://lidiaconlaquimica.files.wordpress.com/2015/07/proteinas-17-estructura-terciaria-enlaces.png
- Protein Data Bank. 1MBN. The stereochemistry of the protein myoglobin. doi: 10.2210/pdb1MBN/pdb. Recuperado de: https://www.rcsb.org/structure/1MBN