¿Qué son las proteínas? ¿Qué funciones cumplen? ¿Qué niveles presentan?
2. Interacciones entre los aminoácidos
Fuerzas intrapartícula:
- Enlace peptídico: enlace covalente
- Puentes disulfuro: entre dos aa cisteína.
- Enlace amida (-CO-NH-): entre las cadenas laterales de la Lys y un aa dicarboxílico (Glu o Asp).
Fuerzas interpartícula:
- Ion-ion: fuerzas electrostáticas entre cadenas laterales ionizadas, con cargas opuestas.
- Dipolo-dipolo (enlace de hidrógeno): entre las cadenas laterales de aminoácidos polares.
- Dipolo inducido-dipolo inducido: interacciones hidrofóbicas entre cadenas laterales apolares.
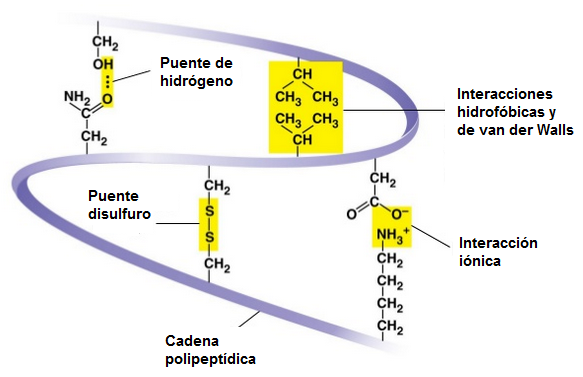
Estas interacciones nos permiten comprender los niveles que presentan las proteínas.
Las fuerzas que estabilizan la estructura terciaria de una proteína se establecen entre las distintas cadenas laterales de los aminoácidos que la componen. Los enlaces propios de la estructura terciaria pueden ser de dos tipos: covalentes y no covalentes.
Como resultado de estas interacciones, en las proteínas con estructura terciaria globular:
- Las cadenas laterales con carácter apolar se
orientan hacia el interior de la molécula evitando las interacciones con el solvente, y forman un núcleo compacto con carácter hidrofóbico.
- Las cadenas laterales de los
aminoácidos polares se localizan en la superficie de la molécula,
interaccionando con el agua y permitiendo que la proteína permanezca en solución.
- No todas estas interacciones contribuyen por igual al mantenimiento de la estructura terciaria. Obviamente, el enlace que aporta más estabilidad es el de tipo covalente, y entre los no covalentes, las interacciones más importantes son las de tipo hidrofóbico, ya que exigen una gran proximidad entre los grupo apolares de los aa.
La siguiente tabla resume lo analizado:
|
Tipo |
Mecanismo |
Energía (kcal/mol) |
Distancia de interacción (Å) |
Grupos que interaccionan |
|---|---|---|---|---|
|
Covalente |
Comparten electrones |
30-100 |
1-2 |
C-C, C-N, C=O, C-H, S-S |
|
Interacciones electrostáticas |
Atracción entre cargas opuestas |
10-20 |
2-3 |
NH3+ COO- |
|
Enlaces de Hidrógeno |
El hidrógeno es compartido entre dos átomos |
2-10 |
2-3 |
N-H ||||| O=C N-H ||||| O-H |
|
Fuerzas de London |
Dipolos inducidos |
1-3 |
3-5 |
Grupos apolares |