Saponificación
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | Saponificación |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 05:15 |
1. Surfactantes
Surfactantes o detergentes
Las manchas y pegotes de grasa no pueden eliminarse con agua. El agua es una sustancia polar y sus moléculas interactúan entre sí mediante enlaces o puentes de hidrógeno. Las grasas y aceites son no polares e interactúan entre sí mediante fuerzas de Van der Waals. Para lograr que sustancias tan diferentes interactúen en forma cruzada, es necesario utilizar sustancias mediadoras conocidas como detergentes o surfactantes. Se trata de moléculas que presentan una “cabeza” polar (o iónica) y una “cola” no polar. La “cola” interactúa mediante fuerzas de Van der Waals con las moléculas no polares de grasa, mientras la “cabeza” lo hace, mediante enlaces de hidrógeno, con el agua.
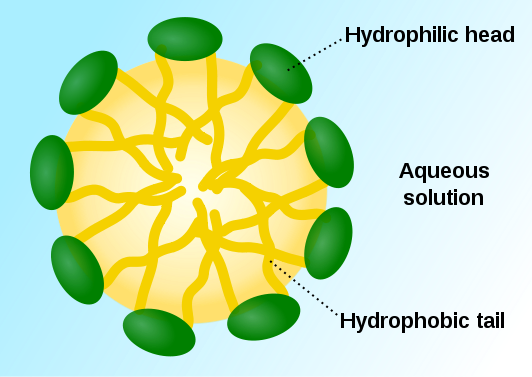
Las colas no polares (en amarillo) de las moléculas de un detergente, se mezclan con la grasa mientras que las cabezas polares (en verde), se mezclan con el agua. Así la grasa es forzada a interactuar con el agua a través de una sustancia intermediaria
Existen
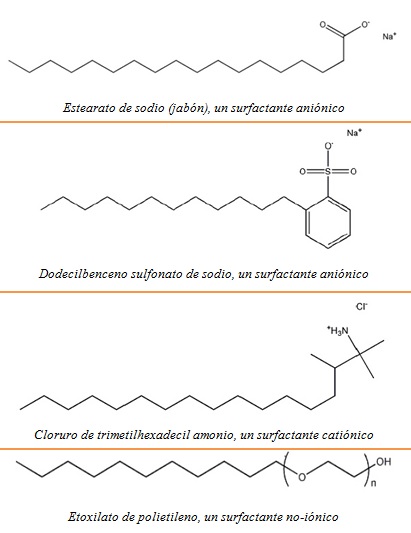
esencialmente tres tipos de surfactantes: aniónicos, catiónicos y no-iónicos.
- Los
surfactantes aniónicos tienen una cabeza cargada negativamente. Los
tipos más comunes son los jabones y los alquil-benceno sulfonatos.
- Los surfactantes
catiónicos tienen una cabeza cargada positivamente. Los más comunes son los
cloruros de alquil amonio.
Los surfactantes no iónicos tienen una cabeza polar pero carente de carga eléctrica neta. Un ejemplo es el de los etoxilatos de polietileno.
Cuando se disuelven en agua, las moléculas de los surfactantes suelen agruparse en la superficie (de ahí el nombre); así, las colas no polares se colocan fuera del agua. Las moléculas de surfactante pueden formar agrupamientos llamados micelas: estas son pequeñas esferas formadas por el surfactante que atrapan a las moléculas de grasa permitiendo su dispersión en agua.
3. Saponificación
En este proceso el enlace éster sufre una reacción de ruptura. Ocurre en medio básico (pH mayor a 7), por eso también se llama hidrólisis básica.
Un jabón se obtiene por hidrólisis alcalina o básica de una grasa o aceite (formada por TG), reacción llamada saponificación.
Un jabón es una sal de un ácido graso. Se nombran con el sufijo "ato":
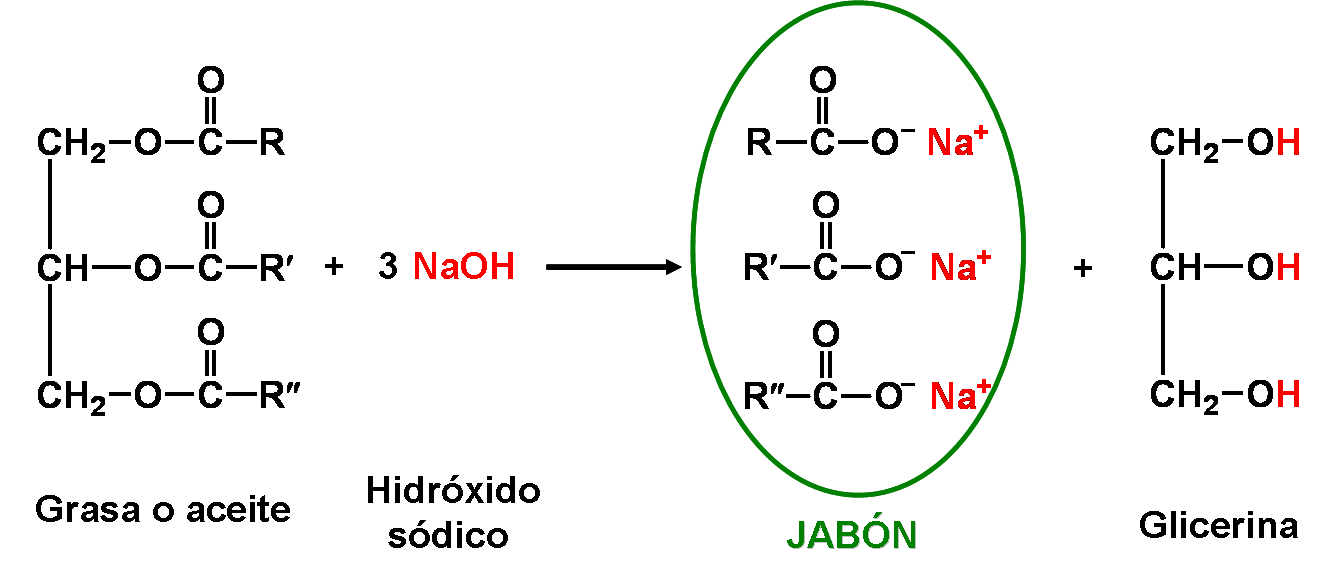
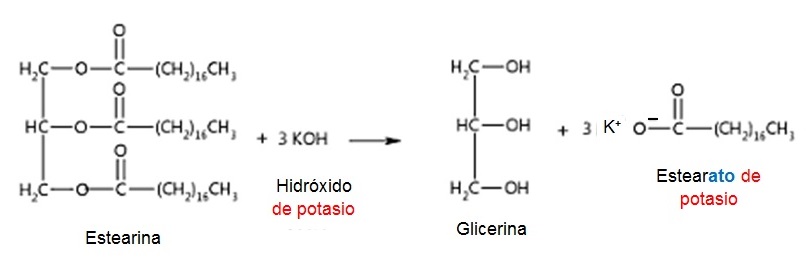
Si se utiliza como base NaOH - hidróxido de sodio, se formará un jabón sólido. Mientras que si se usa KOH - hidróxido de potasio, el jabón será líquido.
3.1. Índice de saponificación
El índice de saponificación (ÍS) es expresado como la masa de KOH (expresada en miligramos) requerida para saponificar los ácidos grasos libres y combinados, presentes en un gramo de grasa y ofrece una medida de la masa molar promedio de los triglicéridos que constituyen la grasa.Las grasas que
contienen ácidos grasos de cadena corta consumen más KOH en su saponificación
mostrando ÍS más grandes y las que poseen ácidos grasos de cadena larga consumen
menos álcali exhibiendo valores pequeños de Índice de saponificación.
Tomando en consideración que en la reacción de saponificación, un mol de grasa
reacciona con tres moles de KOH, si cada mol de grasa consume 168 mg de KOH,
por lo tanto, el ÍS de una grasa= 168/masa molar del TG. Es decir, el índice
de saponificación de una grasa es inversamente proporcional a su masa molar. Al dividir por 3 la masa molar promedio de una grasa se obtiene la masa molar promedio de los ácidos grasos que contiene.
4. Créditos
Autoría del recurso: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Portal Uruguay Educa.
Abril de 2019
Bibliografía consultada:
- Lehninger y otros. (2005). Principios de Bioquímica. Omega.
- Badui, S. (2006). Química de los alimentos. (Cuarta edición). México: Pearson.
- Rodríguez, A. , Maldonado, S. Muro, M. y Miranda, L. (2016). Índice de saponificación de cinco mantecas determinado mediante un micrométodo. Investigación y Desarrollo en Ciencia y Tecnología de Alimentos. Recuperado de: http://www.fcb.uanl.mx/IDCyTA/files/volume1/1/10/161.pdf
- Royal Society of Chemistry. Learn Chemistry. Enhancing learning and teaching. Chemistry in your cupboard: Finish. Recuperado de: http://www.rsc.org/learn-chemistry/resource/res00000009/finish?cmpid=CMP00000011
Vídeos, páginas y/o simuladores utilizados:
Ruben Sebastian . (2016, febrero 3). Micelas y moléculas anfipáticas o anfifílicas. [Archivo de vídeo]. Recuperado de: https://youtu.be/jPXQswT4uY8Universidad Complutense de Madrid Universidad Complutense de Madrid Universidad Complutense de Madrid Universidad Complutense de Madrid EvothermWMA . (2016, mayo 17). Episode 2: Surfactant Chemistry. [Archivo de vídeo]. Recuperado de: https://youtu.be/nPIlDaAX4vEUniversitat Politècnica de València - UPV. (2017, octubre 4). Aceites y grasas. Determinación del índice de saponificación. | UPV. [Archivo de vídeo]. Recuperado de: https://youtu.be/FgduAxadJ80
Las imágenes utilizadas fueron tomadas de:
- Estructura de una micela. https://upload.wikimedia.org/wikipedia/commons/thumb/4/4d/Micelle_scheme-en.svg/250px-Micelle_scheme-en.svg.png
- Representación de la reacción de saponificación. https://lidiaconlaquimica.files.wordpress.com/2015/07/lipidos-15-saponificacion.png