ISOMERÍA
| Sitio: | Aulas | Uruguay Educa |
| Curso: | QUÍMICA 6 |
| Libro: | ISOMERÍA |
| Imprimido por: | Invitado |
| Día: | lunes, 22 de julio de 2024, 15:18 |
1. Parte 1
ISOMERÍA
Los isómeros son sustancias con igual composición química (el mismo número de átomos de cada elemento) y diferentes propiedades físicas y/o químicas. La Isomería puede ser :
Isomería Plana: la presentan compuestos con moléculas que, a pesar de tener el mismo número de átomos de cada elemento, estos átomos se unen formando distintos enlaces.
2. Parte 2
De Cadena.
Por ejemplo, los compuestos 2 metil pentano y 3 metil pentano tienen en común la fórmula molecular, C6H14, pero difieren en la forma de la cadena de carbonos, en este caso la diferencia está en la posición de la ramificación CH3, en un caso se enlaza al carbono 2 de la cadena principal y en el otro al carbono 3.
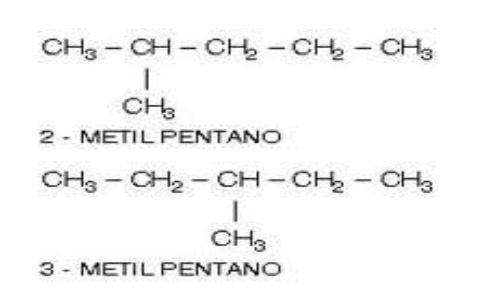
Los compuestos con moléculas de igual fórmula molecular, pero, con átomos de carbono enlazados de forma diferente se denominan isómeros de cadena.
3. Parte 3
De Posición.
Otra diferencia entre las moléculas puede corresponder a la posición del grupo funcional en la cadena de carbonos.
El grupo funcional es un átomo o un conjunto de átomos o un enlace que le da las características al compuesto y determina a que familia ( o función ) pertenece. Ejemplo, los compuestos con enlace doble entre los carbonos de la cadena principal pertenecen a la familia de los alquenos.
Entonces: 1 penteno y 2 penteno difieren en la posición del enlace doble.
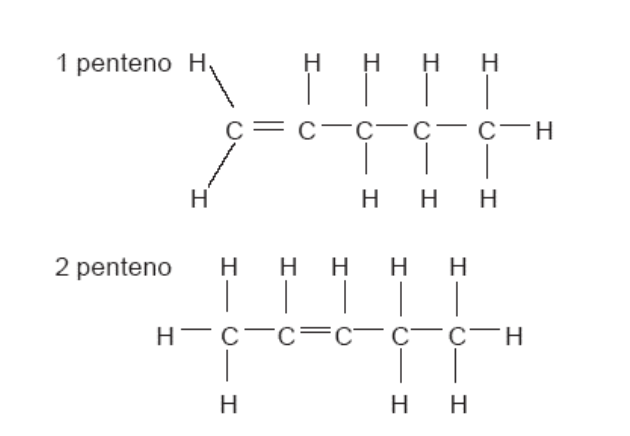
Los compuestos que presentan moléculas con la misma fórmula molecular, pero, diferente ubicación del grupo funcional, en la cadena de carbonos se denominan isómeros de posición.
4. Parte 4
De Función.
También son isómeros las moléculas que pertenecen a distintas familias o funciones químicas. Por ejemplo, propanona que es una cetona y propanal que es un aldehído:
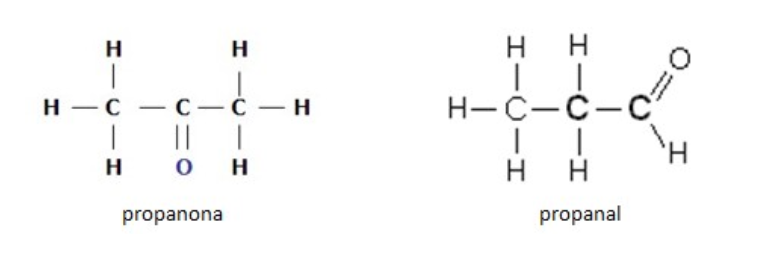
Los compuestos con moléculas de igual fórmula molecular, pero, pertenecientes a diferentes familias se denominan isómeros de función.
5. Parte 5
2 ) Isomería Espacial
La presentan las moléculas que tienen igual número de átomos de cada elemento, también enlazados de la misma forma, pero difieren en la orientación espacial de esos átomos. Se clasifican en:
Isomería geométrica: la presentan, por ejemplo, las moléculas con enlace doble, si a cada átomo de carbono del enlace doble se unen sustituyentes (átomos o grupos de átomos) diferentes. Ejemplo: 2 buteno, a cada carbono del enlace doble se unen dos grupos diferentes, (H) y (CH3).
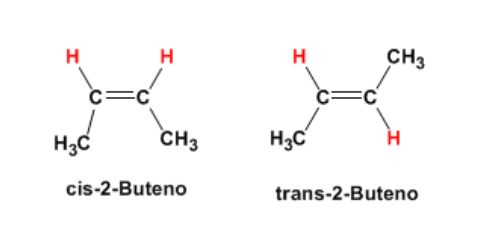
Se toma como referencia el plano del enlace doble. Si los grupos metilo (CH3) se encuentran hacia el mismo lado del plano se forma el isómero Cis y si están hacia lados opuestos el isómero Trans.
Esta diferencia en la orientación espacial de los sustituyentes en relación a un plano de la molécula genera compuestos con propiedades diferentes.
6. Parte 6
b. Isomería óptica: la presentan los compuestos con un carbono enlazado a cuatro sustituyentes (átomos o grupos de átomos) diferentes. Por ejemplo, el compuesto 2 butanol, presenta el segundo carbono unido a (CH3 –) (CH3CH2-) (H-) y (OH-). El átomo de carbono con estas características se denomina quiral.
Esta condición permite obtener dos moléculas diferentes, si se ordenan los sustituyentes de modo tal que una molécula resulte la imagen en el espejo de la otra.
Se demuestra que son diferentes cuando se las intenta superponer. Si el grupo CH3- y el grupo CH3CH2-se superponen, el H- y el OH- no coinciden, quedando orientados de forma opuesta.
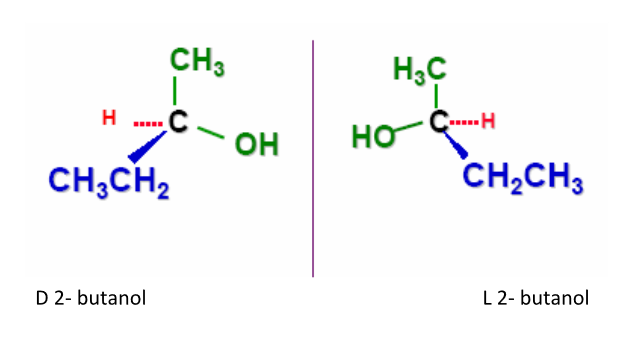
Se toma como referencia para identificarlo, el grupo funcional OH, sí está orientado hacia la derecha es el isómero D y si está orientado hacia la izquierda el isómero L.
Los isómeros que son imágenes especulares que no se pueden superponer se denominan enantiómeros.