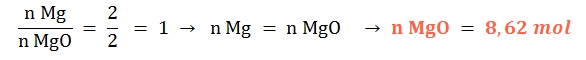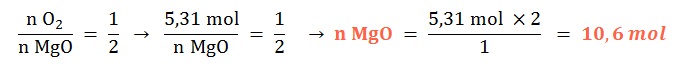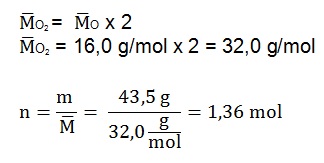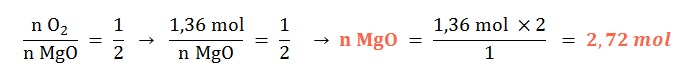Cálculos estequiométricos
¿Cómo funcionaban los antiguos flashes?
El flash fotográfico es un dispositivo utilizado para iluminar de forma artificial una escena que se quiere fotografiar. Los primeros flashes estaban compuestos por mezclas que incluían magnesio en polvo, estas mezclas al explotar emitían luz.

¿Qué ocurre durante la combustión del magnesio?
Observa el siguiente vídeo.
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 1º B.D. |
| Libro: | Cálculos estequiométricos |
| Imprimido por: | Invitado |
| Día: | viernes, 4 de abril de 2025, 13:04 |
Formas de representar la materia y sus interacciones
Podemos describir el cambio ocurrido en tres niveles distintos.
- A nivel macroscópico la tira de magnesio entra en combustión y se observa un destello blanco.
- A nivel ultra microscópico se rompen enlaces químicos de las sustancias llamadas reactivos y se forman nuevas sustancias llamados productos que tienen nuevos enlaces químicos.
- A nivel simbólico, muy usado en Química, podemos representar el cambio a través de la siguiente ecuación química:
2 Mg + O2 → 2 MgO
Se puede leer la representación anterior de la siguiente manera: el magnesio y el dioxígeno reaccionan para formar óxido de magnesio.
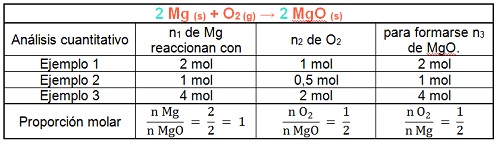
Como vimos en el módulo 14, los cambios químicos se pueden representar a través de una ecuación. Como también analizamos, al ocurrir cambios químicos los elementos químicos se conservan, por lo que podemos afirmar que el número de átomos es el mismo antes y después del cambio. Para representar esta igualdad del número de átomos "balanceamos" o "igualamos" la expresión. En el ejemplo anterior colocamos un dos delante de la fórmula del magnesio sólido y un dos delante de la fórmula del óxido de magnesio para igualar el número de átomos que intervienen en el cambio. Estos números que utilizamos se llaman coeficientes estequiométricos. Los coeficientes estequiométricos permiten establecer la proporción molar en que se combinan los reactivos y se forman los productos.
2 Mg (s) + O2 (g) → 2 MgO (s)
La representación anterior también se puede leer dos moles de magnesio sólido y un mol de dioxígeno gaseoso reaccionan para formar dos moles de óxido de magnesio sólido.
Proporciones molares
Como puedes observar en el siguiente cuadro, las proporciones en que se combinan los reactivos (Mg y O2) y se forma el producto (MgO) no varían.
Ejemplo A
Se tienen 3,50 mol de magnesio sólido, ¿con qué cantidad química de dioxígeno reaccionará al ocurrir su combustión?
Planteo:
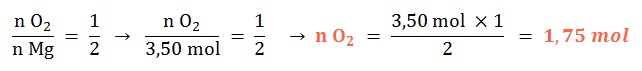
Ejemplo B
Se tienen 1,33 mol de dioxígeno gaseoso, ¿con qué cantidad química de magnesio sólido reaccionará al ocurrir su combustión?
Planteo:
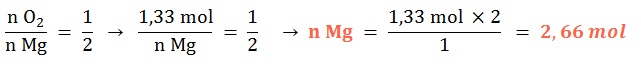
Ejemplo C
Si reaccionan 8,62 mol de magnesio sólido ¿qué cantidad química de óxido de magnesio sólido se formará?
Planteo: