¿Qué son las sales? ¿Cómo se nombran? ¿Qué propiedades tienen?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 1º B.D. |
| Libro: | ¿Qué son las sales? ¿Cómo se nombran? ¿Qué propiedades tienen? |
| Imprimido por: | Invitado |
| Día: | lunes, 7 de abril de 2025, 10:30 |
Tabla de contenidos
1. Introducción
Normalmente solemos hablar de "la sal" que usamos en la vida cotidiana (esta sal es una mezcla de sales en las que el cloruro de sodio se encuentra en mayor proporción), pero como vamos a ver en este módulo existen muchas sales y no todas tienen sabor salado o se utilizan para cocinar.
Para comenzar te sugerimos que visualices el siguiente recurso sobre la sal de mesa (que usamos habitualmente para salar) que analiza algunos aspectos relacionados con su función en el organismo así como su relación con la salud.
2. ¿Qué son las sales?
Son un grupo de sustancias tanto orgánicas como inorgánicas (mineral). Son compuestos iónicos, formados por cationes y aniones.
Las sales pueden encontrarse en la naturaleza formando minerales o disueltas en agua.
Puedes repasar el módulo sobre los enlaces químicos para revisar las características del enlace iónico.
3. ¿Cuáles son algunas de las propiedades de las sales?
Generalmente, las sales:
- forman cristales
- son solubles en agua (puedes repasar el módulo sobre la interacción entre los iones y las moléculas de agua)
- tienen elevado punto de fusión (PF)
- conducen la corriente eléctrica en solución acuosa o fundidas

3.1. Formación de cristales
Observa el siguiente video que muestra la cristalización rápida de la sal nitrato de potasio.
3.2. Conductividad eléctrica
Observa el siguiente video que muestra un experimento para analizar la conductividad eléctrica del agua salada, agua "pura" y sal común.
Las sales son sólidos cristalinos a temperatura ambiente y sus iones se distribuyen según una forma geométrica determinada, con una estructura rígida que no permite la conducción de la corriente eléctrica, pero cuando el compuesto se funde o solubiliza en agua los iones se separan y entonces sí conducen la corriente eléctrica.
4. Formación de las sales
En el laboratorio es posible preparar sales utilizando diversas reacciones químicas como las que veremos a continuación:
Por neutralización
Al reaccionar un ácido con una base. El ácido le proporciona el anión a la sal y la base el catión.
Por ejemplo en el siguiente video puedes observar lo que ocurre cuando una solución de hidróxido de sodio (NaOH) reacciona con otra solución de igual concentración y volumen de ácido clorhídrico (HCl), si evaporamos el agua de la solución final podemos obtener la sal sintetizada: cloruro de sodio (NaCl).
La ecuación que representa lo ocurrido es la siguiente:
NaOH (ac) + HCl (ac) → NaCl (ac) + H2O (l)
Por reacción de un hidróxido con un óxido no metálico
Por ejemplo se utiliza agua de cal (solución de hidróxido de calcio Ca(OH)2) para detectar el dióxido de carbono (CO2) como puedes ver en el siguiente video (observar hasta 2 minutos 40 segundos):
Podemos representar la obtención de carbonato de calcio a través de la siguiente ecuación:
Ca(OH)2 (ac) + CO2 (g) → CaCO3 (s) + H2O (l)
Por precipitación
Algunas sales poco solubles en agua o insolubles en ella se pueden preparar mezclando soluciones acuosas que contengan los iones correspondientes. Se denominan reacciones de precipitación porque se obtiene un sólido (precipitado) que se deposita en el fondo del sistema acuoso.
La siguiente ecuación representa el proceso ocurrido:
CaCl2 (ac) + Na2CO3 (ac) → CaCO3 (s) + 2 NaCl (ac)
El carbonato de calcio obtenido precipita.
Por reacción de un metal con un ácido
Algunos metales reaccionan con los ácidos formando sales.
Observar el video hasta 1 minuto 35 segundos.
El cinc al reaccionar con el ácido clorhídrico forma cloruro de cinc y gas dihidrógeno como se encuentra representado en la siguiente ecuación:
Zn (s) + 2 HCl (ac) → ZnCl2 (ac) + H2 (g)
4.1. Profundizando en la reacción entre ácidos y bases
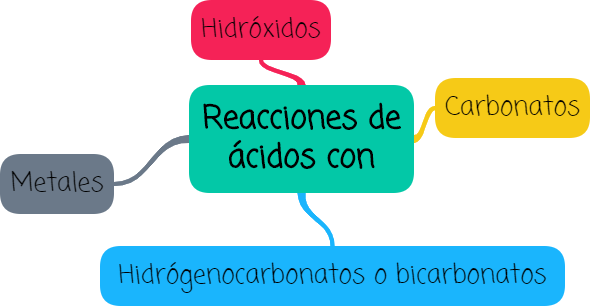
Observa el siguiente video y analiza las reacciones que se pueden dar entre los ácidos y los metales, los hidróxidos, los carbonatos y los hidrógenocarbonatos (conocidos más comúnmente como bicarbonatos). En todos los casos, como podrás ver, se forman sales.
5. Formulación y nomenclatura de las sales
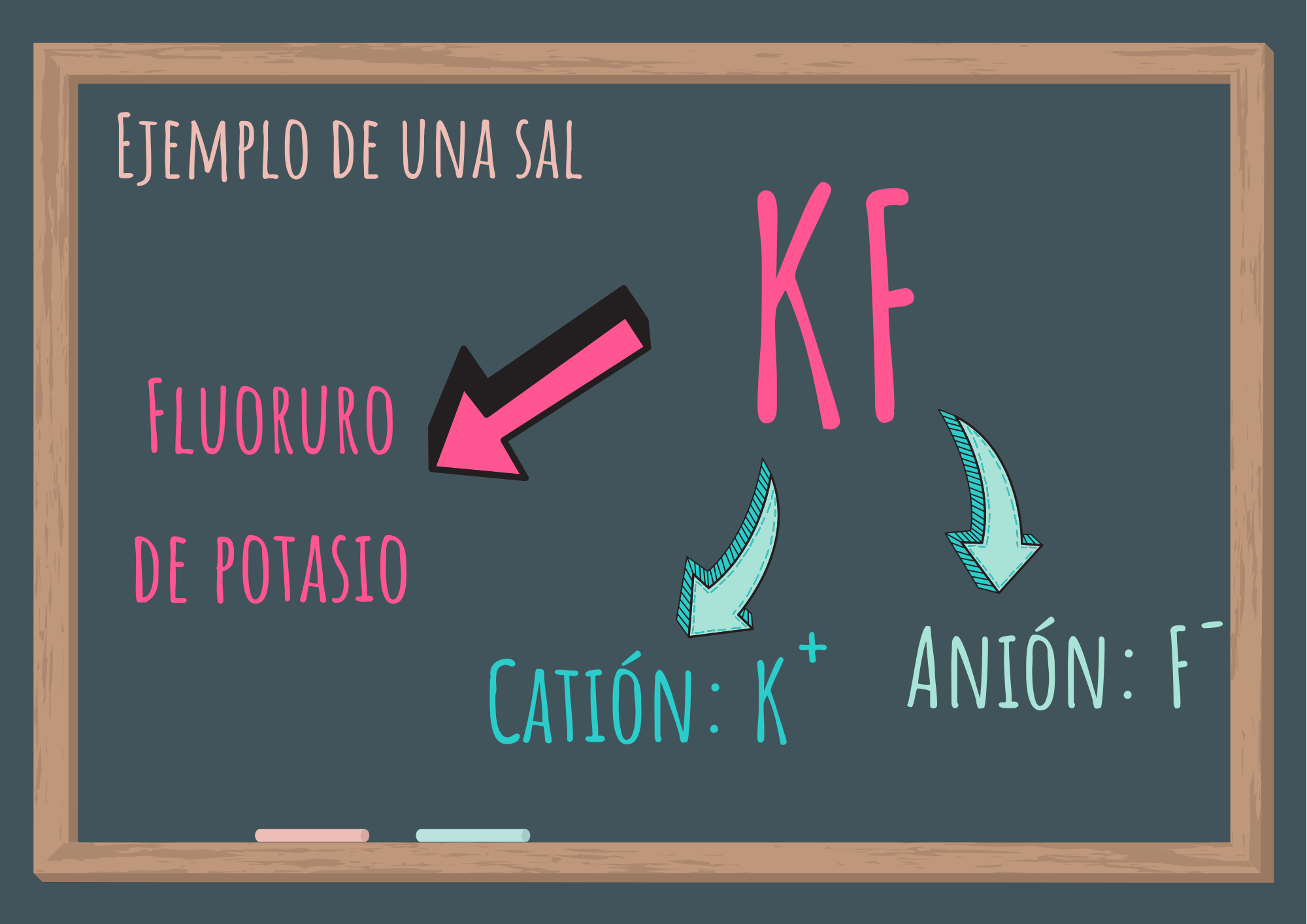
Como ya analizamos, las sales son compuestos iónicos formadas por cationes y aniones. Para escribir la fórmula de una sal hay que considerar qué catión y qué anión la componen.
Repasemos algunas reglas útiles:
- Se escribe primero el catión y luego el anión.
- Los subíndices indican la proporción en que los iones se encuentran formando el cristal.
- Las sales son compuestos eléctricamente neutros, la proporción de cationes y aniones debe ser tal que la carga neta sea cero.
- Para nombrar las sales se hace en orden opuesto: primero el anión y luego el catión.

5.1. Nomenclatura de sales
Podemos nombrar a las sales utilizando tres nomenclaturas posibles:
- sistemática
- de Stock y
- tradicional.
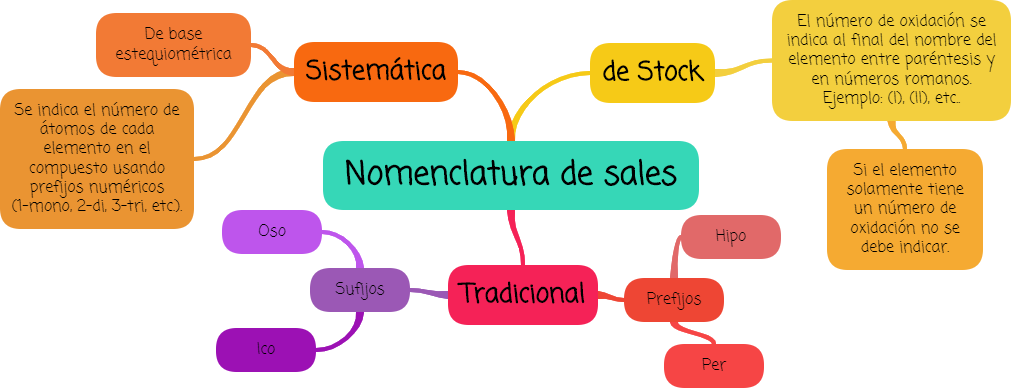
En este módulo repasaremos las nomenclaturas tradicional y de Stock.
5.2. Repasando números de oxidación y nomenclatura tradicional
- ¿Qué es el número de oxidación?
Es la carga que tendría un elemento si se asignaran los electrones de enlace al átomo más electronegativo, considerando todas las uniones como iónicas.
Los números de oxidación se encuentran en la tabla periódica.
Un elemento puede tener varios números de oxidación.
- Ejemplos de números de oxidación de algunos elementos:
Na: +1
K: +1
Mg: +2
Ca: +2
Fe: +2, +3
Cu: +1, +2
C: +2, +4
N: +3, +5
O: -2, -1
Cl: -1, +1, +3, +5, +7.
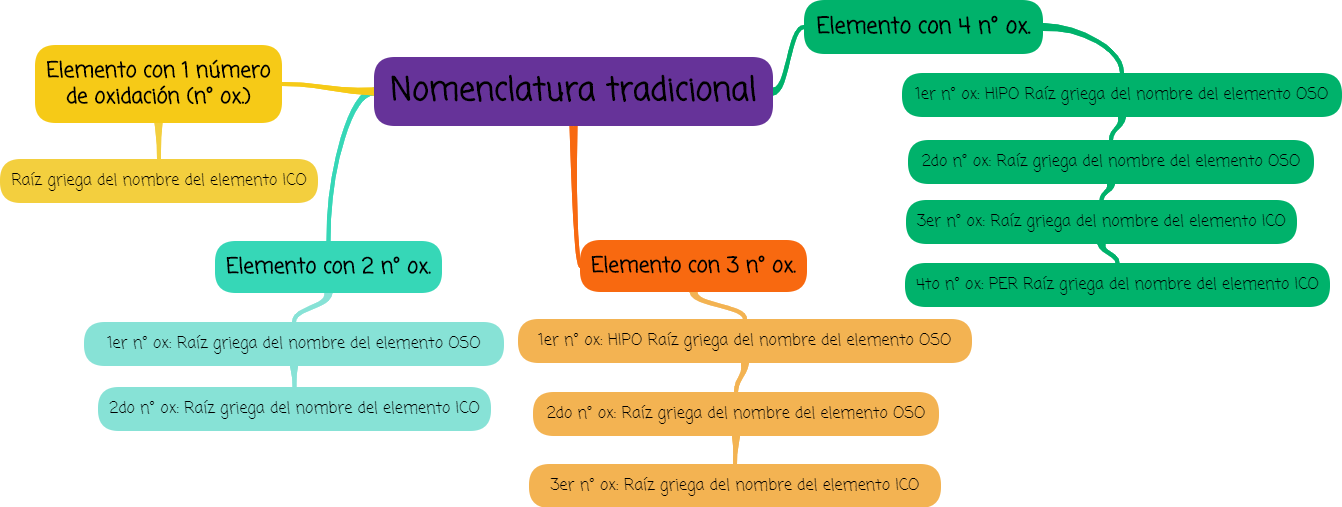
- Números de oxidación y nomenclatura tradicional:
Observa en el siguiente mapa mental cuál es el nombre asignado para los compuestos formados por no metales que tienen 1, 2 ,3 o 4 números de oxidación.
5.3. Nomenclatura tradicional
Cuando hay que formular una sal, es conveniente identificar el ácido del cual proviene debido a que el anión de la sal puede considerarse como un derivado de ese ácido.
Te sugerimos que repases la disociación iónica de algunos ácidos y bases.
El siguiente video repasa los nombres de los aniones según el ácido del que provienen.

Ejemplos:
1- Anión proveniente de un hidrácido:
| K+ | + | Cl- | → | KCl |
|---|---|---|---|---|
| catión potasio | anión cloruro | cloruro de potasio |
En este caso el anión proviene del ácido clorhídrico (HCl) por eso su nombre es cloruro.
2- Anión proveniente de un oxoácido:
| Ca2+ | + | 2 NO3- | → | Ca(NO3)2 |
|---|---|---|---|---|
| catión calcio | anión nitrato | nitrato de calcio |
En este caso el anión proviene del ácido nítrico (HNO3) por eso su nombre es nitrato.
3- Anión proveniente de un oxoácido:
| Na+ | + | ClO- | → | NaClO |
|---|---|---|---|---|
| catión sodio | anión hipoclorito | hipoclorito de sodio |
En este caso el anión proviene del ácido hipocloroso (HClO) por eso su nombre es hipoclorito.
5.4. Nomenclatura de Stock
Cuando el elemento que forma el catión tiene varios números de oxidación podemos emplear esta nomenclatura.
Por ejemplo el cobre puede tener número de oxidación +1 o +2, por lo que puede formar dos sales distintas con el anión sulfato (en este caso).
| 2 Cu+ | + | SO42- | → | Cu2SO4 |
|---|---|---|---|---|
| catión cobre (I) | anión sulfato | sulfato de cobre (I) |
| Cu2+ | + | SO42- | → | CuSO4 |
|---|---|---|---|---|
| catión cobre (II) | anión sulfato | sulfato de cobre (II) |
Para diferenciar ambas sales se incluye en el nombre entre paréntesis el número de oxidación del cobre en números romanos:
sulfato de cobre (I)
sulfato de cobre (II)
Si el elemento posee un único número de oxidación no es necesario indicar entre paréntesis cuál es el mismo.
6. Créditos
Autoría del recurso: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Portal Uruguay Educa.
Diciembre de 2019
Bibliografía consultada:
- Villizio, M., Nieto, M., Dos Santos, M., Scarone, C., Rodríguez, M., Culazzo, M. y Lahore, A. (2002). Química un enfoque planetario. (4ta edición). Montevideo, Uruguay: Monteverde.
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2010). Todo se transforma. Química- 3er Año C.B. Montevideo, Uruguay: Contexto.
- Irazoquí, R., Rebollo, C. y Soubirón, E. (2012). Primer año de Bachillerato. Química. Un abordaje sustentable. C. Suiza, Uruguay: Correo del Maestro.
- Alegría, M., Bosack, A., Dal Fávero, M., Franco, R., Jaul, M. y Rossi, R. (1998). Química I. Sistemas materiales. Estructura de la materia. Transformaciones químicas. Buenos Aires, Argentina: Santillana.
- Alegría, M., Franco, R., Jaul, M. y Morales, E. (2007). Química. Estructura, comportamiento y transformaciones de la materia. Buenos Aires, Argentina: Santillana.
- Universidad Central de Venezuela Facultad de Agronomía Departamento de Química y Tecnología Cátedra de Química. (s.f.). Guía de estudio del Propedéutico de Química. Recuperado de: http://www.ucv.ve/fileadmin/user_upload/facultad_agronomia/Propedeutico/2014/GuIa_de_Estudio_PropedEutico_QuImica.pdf
Vídeos, páginas y/o simuladores utilizados:
- Cienciabit: Ciencia y Tecnología. (2015, 29 de noviembre). Cristalización Rápida. Experimento.
[Archivo de vídeo]. Recuperado de: https://youtu.be/Vo29NUA4aSQ - Ciencias Naturales Digital. (2019, 27 de marzo). 7° ELECTRICIDAD 02 El agua salada y la conducción de la electricidad. [Archivo de vídeo]. Recuperado de: https://youtu.be/M85wMonGxEU
- BerkeleyChemDemos. (2013, 1 de octubre). acid-base reaction (HCl + NaOH). [Archivo de vídeo]. Recuperado de: https://youtu.be/TS-I9KrUjB0
- Cienciabit: Ciencia y Tecnología. (2014, 13 de julio). CO2: Experimentos para la Deteccion de Dióxido de Carbono. [Archivo de vídeo]. Recuperado de: https://youtu.be/PYSjYqOEyY0
- Cienciabit: Ciencia y Tecnología. (2017, 6 de marzo). Reacción de Precipitación. Formación de Carbonato de Calcio. [Archivo de vídeo]. Recuperado de: https://youtu.be/2x0FyLUOTCI
- Cienciabit: Ciencia y Tecnología. (2018, 25 de marzo). Reacción del Zinc con el Ácido Clorhídrico. Reacción Química Redox, de Desplazamiento y Exotérmica. [Archivo de vídeo]. Recuperado de: https://youtu.be/-LSFUF1tj0s
- La Química de Yamil. (2018, 2 de septiembre). Reacciones de ácidos y bases | Ácidos y Bases. [Archivo de vídeo]. Recuperado de: https://youtu.be/UqSehQeWM1k
- La Química de Yamil. (2019, 9 de julio). Cómo escribir la fórmula de una sal (sin usar iones) | Formulación Inorgánica. [Archivo de vídeo]. Recuperado de: https://youtu.be/5HoLAFwZxWs
- La Química de Yamil. (2018, 27 de mayo). Cómo se escribe el nombre de un anión (Hídrico...uro; oso...ito; ico...ato) | Ácidos y Bases. [Archivo de vídeo]. Recuperado de: https://youtu.be/d90cvlhT1Es
Las imágenes utilizadas fueron tomadas de:
- Mapas mentales elaborados con GoConqr.
- Imágenes de pizarra elaboradas con Canva.