Soluciones y sus propiedades
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química para la Gastronomía - 2020 |
| Libro: | Soluciones y sus propiedades |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 17:16 |
Tabla de contenidos
1. ¿Qué son las soluciones químicas?
Las soluciones son mezclas homogéneas de dos o más componentes. Por lo general, uno de estos componentes se encuentra en mayor proporción y se denomina solvente. Al que está presente en menor proporción, le llamamos soluto.
Cuando piensas en una solución química por lo general te imaginas soluciones líquidas, y eso está bien puesto que la mayoría pertenecen a esta clasificación (sal en agua, dióxido de carbono disuelto en el líquido de las bebidas gaseosas, alcohol disuelto en agua, etc). De hecho, el agua es considerado el solvente universal, por tanto, tu concepto acerca de las soluciones no es erróneo dado que la mayoría de las soluciones son acuosas.
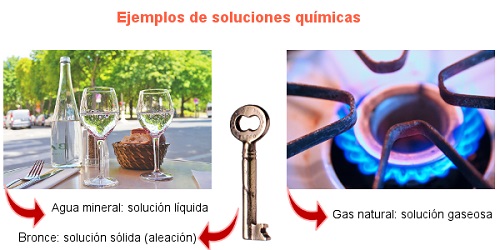
¿Lo semejante se disuelve en lo semejante?
Por lo general sí. Podemos usar esta primera regla para entender en parte el proceso de disolución. Por ejemplo, los solventes polares como el agua y el alcohol, son muy buenos solventes para solutos iónicos (sales, óxidos).
Pero el agua no es un buen solvente para el caso de sustancias que no son polares, o presentan una mínima polaridad como es el caso del aceite, la parafina, la nafta.

Matraces aforados: se utilizan para preparar soluciones de concentración exacta
Clasificación
Solución no saturada: Es aquella que puede admitir más soluto hasta alcanzar su grado de saturación. Asimismo, las soluciones no saturadas pueden ser diluidas o concentradas. En las primeras, la cantidad de soluto es pequeña en relación al volumen de solución; en las concentradas, la cantidad de soluto es apreciable en relación al volumen de la solución.

Solución saturada: En este tipo de solución, existe un equilibrio entre el soluto y el medio dispersante, y el solvente no será capaz de disolver más soluto. En algunos casos es posible seguir agregando soluto, aumentando la temperatura lo que puede provocar una precipitación del sólido cuando la solución enfríe o en caso de que el solvente ya no tenga más capacidad de disolver el soluto.
1.1. ¿Qué ocurre cuando la sal y el azúcar se disuelven en agua?
Observa el siguiente video que representa lo que ocurre cuando la sal (cloruro de sodio - NaCl) se disuelve en agua formando una solución.
El siguiente video representa el proceso de disolución del azúcar (sacarosa - C12H22O11) en agua:
1.2. ¿Diluir o disolver?
Es frecuente confundir el significado de los verbos disolver y diluir. Este error se refuerza por ejemplo, en la publicidad y programas televisivos donde se los usa indistintamente. Pero no son sinónimos.
- DISOLVER: es mezclar los componentes para preparar una solución.
- DILUIR: es agregar solvente a una solución para preparar otra.
EJEMPLO:
Ana prepara un jugo de naranja para compartir con tres amigas. Coloca el contenido de un sobre en una jarra y agrega agua hasta obtener 1 L de jugo (proceso de disolver o realizar un disolución).
En ese momento llegan otras amigas y decide agregar más agua para convidar a todos (proceso de diluir o hace una dilución).

¿Qué propiedades se modificaron? ¿Tienen algo en común ambas soluciones?
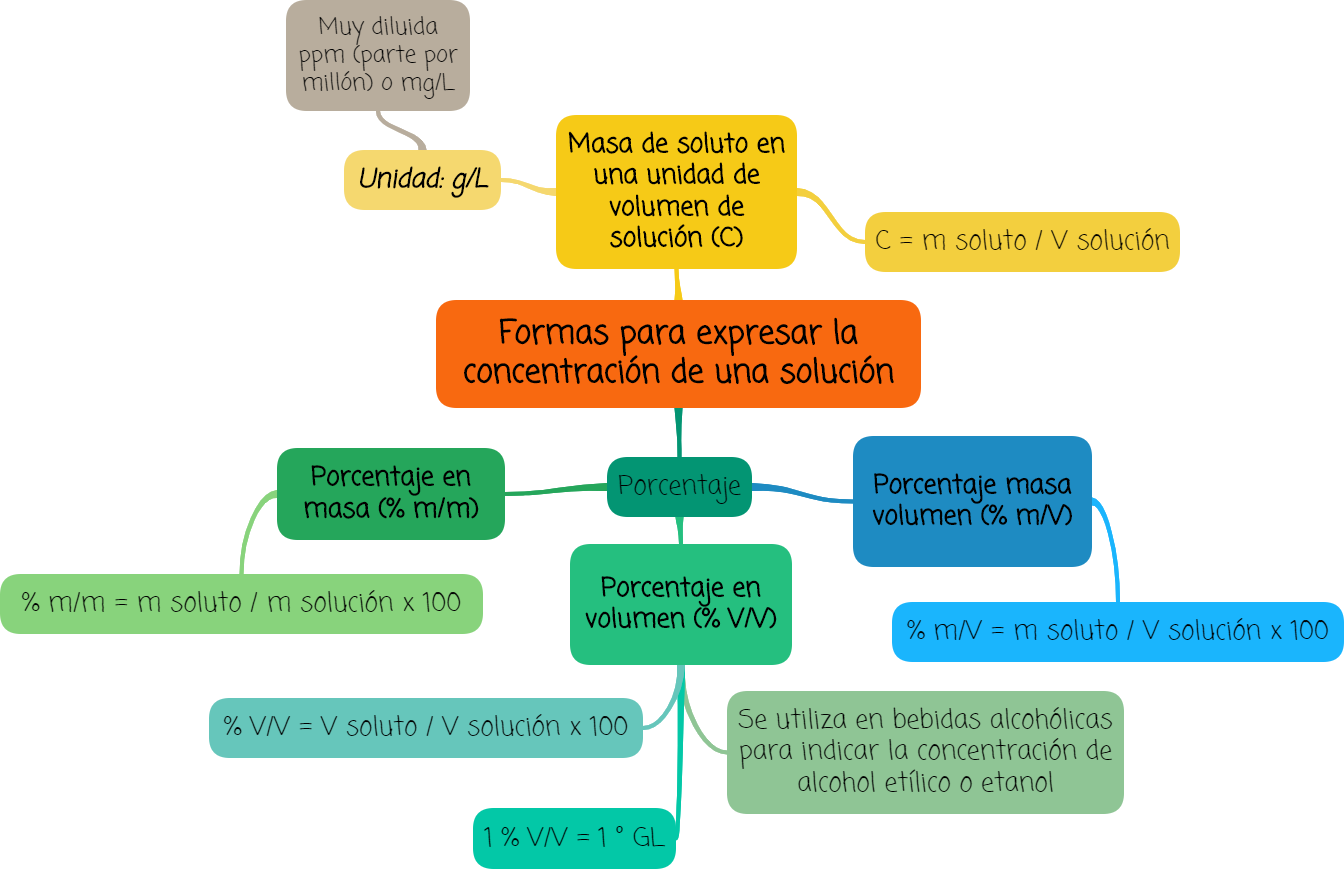
2. Formas de expresar la concentración
Además de clasificar a las soluciones en diluidas, concentradas o saturadas, podemos ser aún más específicos indicando la proporción entre soluto y solvente, por ejemplo.
FORMAS Y UNIDADES USADAS PARA EXPRESAR LA CONCENTRACIÓN DE LAS SOLUCIONES:
Existen algunas formas para expresar la concentración de una solución muy utilizadas por la comunidad científica.
A continuación analizaremos algunas de ellas:
- Masa de soluto en una unidad de volumen de solución
- Porcentaje en masa
- Porcentaje en volumen
- Porcentaje masa volumen
2.1. Masa de soluto en una unidad de volumen de solución (C)
Esta forma relaciona la masa del soluto y el volumen de la solución. La podemos calcular utilizando la siguiente expresión matemática:
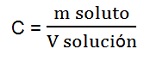
Es muy común utilizar las siguientes unidades: masa de soluto en gramos (g), volumen de la solución en litro (L "mayúscula") y por lo tanto concentración en gramos por litro (g/L).
En el caso de las soluciones muy diluidas se puede utilizar la unidad ppm (partes por millón) o sea mg/L, siendo mg: miligramos.
Por ejemplo: Si tenemos una solución compuesta por 6,34 g de cloruro de sodio disueltos en 450 mL (recuerda que el volumen deberá estar expresado en litro) de solución su concentración será:
C = 6,34 g / 0,450 L
C = 14,1 g/L.
2.2. Porcentaje en masa (% m/m)
Esta forma indica la masa de soluto presente en 100 unidades de masa de solución. No presenta unidad. Podemos calcular dicho porcentaje utilizando la siguiente expresión matemática:
![]()
Por ejemplo: una solución de ácido nítrico tiene una concentración de 65 % m/m, esto significa que si tenemos 100 g de solución, 65 g son de ácido nítrico, los 35 g restantes corresponden al solvente que en este caso es el agua.
2.3. Porcentaje en volumen (% V/V)
En el caso de que tanto el soluto como el solvente se encuentren líquidos se suele utilizar esta otra forma. No presenta unidad. Para calcular el porcentaje en volumen utilizamos la siguiente expresión matemática:
![]()
Recuerda que al utilizar la expresión anterior deberás expresar ambos volúmenes en la misma unidad.
Esta forma es muy utilizada en el caso de las bebidas alcohólicas (soluciones de etanol o "alcohol etílico"). La unidad, en este caso, se denomina grado Gay-Lussac y se representa º GL.
1 ºGL = 1 % V/V
Por ejemplo: un vino tiene una graduación alcohólica de 14 º GL, esto quiere decir que su concentración de etanol es de 14 % V/V, hay 14 mL de etanol por cada 100 mL del vino.

3. Propiedades coligativas
Cuando se separan los componentes de una solución se obtienen “intactos”, sin transformaciones, con sus propiedades químicas inalteradas. Sin embargo, las propiedades de una solución, en algunos aspectos, difieren mucho de las de los componentes puros, en particular del solvente.
Por ejemplo, ¿sabías que un truco conocido para mantener las bebidas "frías" está relacionado con las propiedades coligativas? Se trata de que si vas a llenar un recipiente con bebidas que deban estar "frías", lo normal es meterlas en hielo con agua salada de manera que se mantengan a baja temperatura, pero puedan estar sueltas para ser recogidas. La sal disuelta en agua hace que ésta quede líquida por debajo de 0 ºC, es decir que el punto de fusión de la solución formada es menor que el del agua pura. De esa manera, conseguirás que las bebidas estén en un medio a baja temperatura durante más tiempo. El agua salada aguantará temperaturas menores que 0 ºC y tardará más en aumentar su temperatura, manteniendo las bebidas "frías" más tiempo.
Estas propiedades de las soluciones ideales (o muy diluidas), denominadas propiedades coligativas, no dependen del tipo de soluto que se disuelve en determinado solvente, sino del número de partículas que se disuelven en él.
3.1. Propiedades a estudiar
Repasamos las siguientes propiedades coligativas:
- aumento ebulloscópico
- descenso crioscópico
- presión osmótica
3.2. Descenso crioscópico
Es la disminución del punto de fusión que se produce al agregar un soluto no iónico y no volátil a un solvente. La solución solidificará a temperaturas menores que cuando estaba el solvente puro.
3.3. Ascenso ebulloscópico
En el punto de ebullición de un líquido la presión de vapor se vuelve igual a la presión atmosférica y el líquido hierve y pasa al estado gaseoso. Al agregar un soluto, como la presión de vapor baja, la temperatura requerida para equilibrarla es mayor, es decir que el líquido hervirá a mayor temperatura.
3.4. Presión osmótica
¿Qué es el proceso de ósmosis?
Es el proceso por el cual las moléculas de solvente pasan a través de una membrana semipermeable desde una solución diluida a otra más concentrada.

La ósmosis es una de las formas principales por la que las moléculas de agua se mueven hacia dentro y hacia fuera en las células vivas. Las membranas de las células en los organismos vivos permiten el paso de solvente a su través.
La presión osmótica es la presión que se debe ejercer para que ese proceso no ocurra. Depende del número y no del tipo de partículas de soluto en la solución, por eso es una propiedad coligativa.
3.5. Aplicación de las propiedades coligativas
Cuando hablamos de productos líquidos que contengan un porcentaje de agua podemos comprobar a qué temperatura congelan o entran en ebullición a base de enfriarlos o calentarlos y medir la temperatura. Con esto y lo conocido de las propiedades coligativas sabemos qué concentración de soluto hay en el producto. Por ello, conociendo los puntos de ebullición y congelación de los productos con su concentración habitual, podemos calentarlos o congelarlos, y ver a qué temperatura ocurre, pudiendo saber si contienen más o menos agua que la prueba previa.
Un ejemplo para un defecto de soluto, podría ser la fabricación de bebidas alcohólicas sin alcohol o con una concentración de alcohol menor. Por ejemplo, si quisieran vender un producto afirmando que tiene menos alcohol para que se consumiera más. Estos productos deberían de tener un punto de ebullición más bajo que otros productos con la misma concentración de alcohol, o si afirman que han fabricado una cerveza sin alcohol, por ejemplo, debería variar el punto de congelación lo suficiente para asemejarse a una solución con los productos indicados para la fabricación. También se podrá comprobar el porcentaje de alcohol de la bebida.
4. Créditos
Referencias bibliográficas:
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (Quinta edición). Madrid, España: Mc Graw Hill.
- Koppmann, M. (2011). Manual de Gastronomía Molecular. (Segunda Edición). Buenos Aires, Argentina: Siglo Veintiuno.
- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
Videos:
- Animación de disolución de sacarosa. Recuperado de: https://www.middleschoolchemistry.com/multimedia/chapter5/lesson4#sucrose_animation
- Cienciabit: Ciencia y Tecnología. (2017, 19 de noviembre). Propiedades Coligativas de las Disoluciones. Descenso Crioscópico. [Archivo de vídeo]. Recuperado de: https://youtu.be/dvkedxUD5rw
- Cienciabit: Ciencia y Tecnología. (2017, 10 de diciembre). Propiedades Coligativas de las Disoluciones. Presión Osmótica. [Archivo de vídeo]. Recuperado de: https://youtu.be/93T2Q5qyB14
- Cienciabit: Ciencia y Tecnología. (2017, 12 de noviembre). Propiedades Coligativas de las Disoluciones. Aumento Ebulloscópico. [Archivo de vídeo]. Recuperado de: https://youtu.be/C4xDxNrxHic
- Canadian Museum of Nature. (2011, 2 de septiembre). How Water Dissolves Salt [Archivo de vídeo]. Recuperado de: https://www.youtube.com/watch?v=xdedxfhcpWo
Imágenes empleadas:
- Capítulo 1. http://aulas.uruguayeduca.edu.uy/mod/page/view.php?id=38000
- Jugo. Recuperada de: https://www.argentinadiabetes.org/wp-content/uploads/2017/03/2369454-770x375.jpg
- Botellas con hielo. Recuperada de: https://p1.pxfuel.com/preview/863/647/751/cans-drinks-ice-water.jpg
- Ósmosis. Recuperada de: https://commons.wikimedia.org/wiki/File:0307_Osmosis_cleaned.jpg
- Cerveza sin alcohol. Recupuerado de: https://es.wikipedia.org/wiki/Archivo:ZeroEthanolBeer.JPG