Medios acuosos y conservación de los alimentos
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química para la Gastronomía - 2020 |
| Libro: | Medios acuosos y conservación de los alimentos |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:54 |
1. ¿Qué es el pH?
¿Qué es el pH?
Es una medida que permite comparar fácilmente la acidez o basicidad de una solución. Es un valor numérico (no tiene unidad).
Escala de pH
Los valores de la escala de pH están comprendidos entre 0 y 14. Esta escala se aplica a soluciones acuosas de ácidos o bases que tienen una concentración menor o igual a 1,0 mol/L, y a una temperatura de 25,0 ºC.
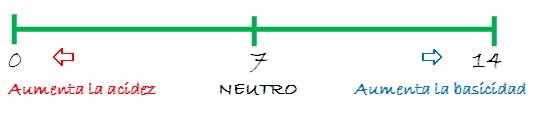
- Las soluciones que tienen valores de pH menores a 7 son soluciones ácidas.
- Si su valor de pH es igual a 7, es una solución neutra.
- Y si por el contrario, su valor de pH es mayor a 7 es una solución alcalina o básica.
Cuanto más cercano a 0 sea el valor del pH, más ácida será la solución, y cuanto más cercano a 14 más básica o alcalina será.
2. ¿Cómo se mide el pH?
Medición del pH:
Si se desea conocer el valor exacto del pH, en vez de emplear un reactivo indicador, podemos medirlo utilizando uno de los siguientes métodos.
- Método colorimétrico: Se emplean tiras de papel indicador de pH (se logran impregnando varios reactivos indicadores en el papel), y se compara el color de la tira, luego de que fue humedecida con la solución a estudiar, con la escala de colores que se encuentra en el envase del papel indicador. Se puede determinar el valor del pH con diferencias de una unidad.


- Método electrométrico: Se utiliza un aparato llamado peachímetro que se sumerge en la solución a medir. Luego de realizar la medición se debe lavar la parte que se sumerge (llamado electrodo) con agua destilada, esperar que se seque para recién guardar el peachímetro. Debemos ser muy cuidadosos al manejarlo ya que es un aparato muy delicado.
La ventaja que presenta es que es más exacto que el papel indicador ya que podemos obtener una medida con centésimos (ejemplo pH = 4,96).

3. Ejemplos de ácidos y bases agregados a los alimentos
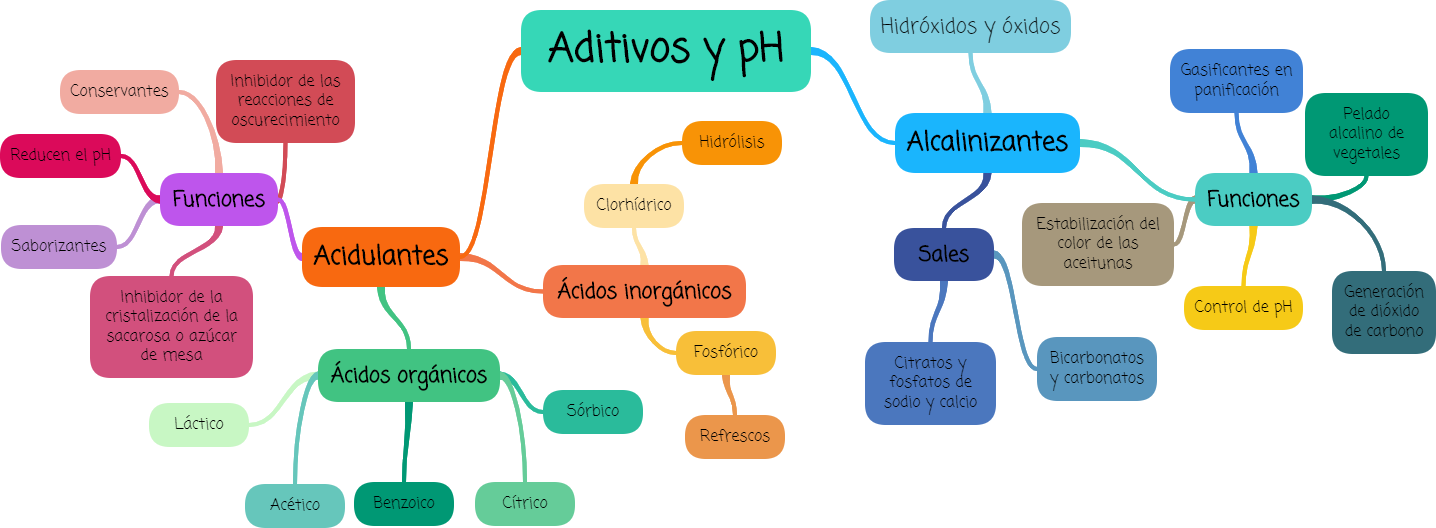
Acidulantes
Los acidulantes además de reducir el pH, cumplen un gran número de funciones: amortiguador de pH; conservador; saborizante; promotor de reacciones de curado en los cárnicos; secuestrador; modificador de la viscosidad; coagulante de la leche; inhibidor de las reacciones de oscurecimiento; hidrolizante de la sacarosa y del almidón; promotor de la gelificación de las pectinas; inhibidor de la cristalización de la sacarosa; y otras.
- Ácidos orgánicos: acético o etanoico, adípico, benzoico, cítrico, fumárico, láctico, málico, propiónico, sórbico, succínico y tartárico.
- Ácidos inorgánicos: El fosfórico (H3PO4) es el ácido inorgánico más común y es empleado en las bebidas de cola; el clorhídrico (HCl) se utiliza para catalizar algunas reacciones de hidrólisis.
Muchos de los ácidos se encuentran de manera natural en diversos vegetales como parte de su metabolismo y contribuyen a la acidez y al sabor típico. Por ejemplo, las manzanas, los plátanos, las peras, las papas y las zanahorias contienen una alta proporción de ácido málico, mientras que el tartárico se localiza en aguacates, uvas y toronjas y el ácido cítrico está presente prácticamente en todos los vegetales.
Alcalinizantes:
Por su parte, los alcalinizantes tienen diversos usos, entre los que destacan el control del pH, la generación de CO2, el pelado alcalino de vegetales, la estabilización del color de las aceitunas, la obtención de proteínas de soya y los diferentes gasificantes para panificación.
Las sales fundentes alcalinas para quesos, constituidas por citratos y fosfatos de sodio y de calcio, proporcionan textura, untuosidad y regulan el pH de estos derivados lácteos. Por su importancia, en esta categoría de aditivos destacan los bicarbonatos, hidróxidos, óxidos, carbonatos y fosfatos de sodio, de calcio y de magnesio.
4. Créditos
Referencias bibliográficas:- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
- Irazoquí, R; Rebollo, C y Soubirón, E. (2012). Primer año de Bachillerato. Química. Un abordaje sustentable. C. Suiza, Uruguay; Correo del Maestro.
- Hill, J. y Kolb, D. (1999). Química para el nuevo milenio. (8va edición). México: Pearson, Prentice Hall.
- Badui, S. (2006). Química de los alimentos. (Cuarta edición). México: Pearson.