¿Qué tienen en común la gelatina, la mayonesa y un helado?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química para la Gastronomía - 2020 |
| Libro: | ¿Qué tienen en común la gelatina, la mayonesa y un helado? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:53 |
1. Introducción
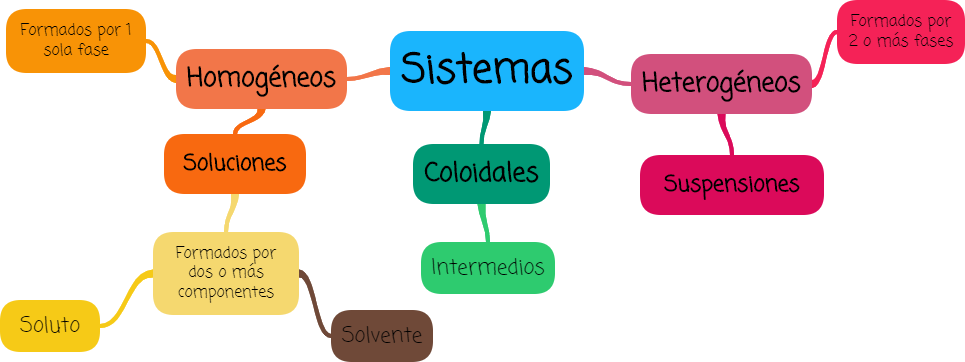
En cursos anteriores de química trabajaste la clasificación de los sistemas en heterogéneos y homogéneos, según el número de fases presentes. Profundizaremos al respecto, y veremos que no todo es lo que parece.

2. Sistemas homogéneos y heterogéneos
Comencemos retomando algunos conceptos (solución y suspensión) y analizando uno nuevo (coloide).
Como ya has trabajado una solución es un tipo de sistema homogéneo formado por dos o más componentes, una suspensión es un tipo de sistema heterogéneo formado por dos o más fases, y los sistemas coloidales son sistemas intermedios, que a simple vista parecen homogéneos pero si los observamos con un ultramicroscopio notamos que no lo son.
3. Propiedades de los sistemas
A continuación analizamos algunas propiedades de cada tipo de sistemas.
 |
SOLUCIÓN: mezcla homogénea donde las partículas dispersas no pueden filtrarse ni sedimentan. Es posible obtener estos componentes mediante algún método de fraccionamiento como destilación, cristalización o cromatografía. Las partículas no son visibles a simple vista ni siquiera usando un microscopio o un ultramicroscopio. Tamaño de partícula: 1 a 10 Å. Recuerda que 1 Å ångström corresponde a 1x10-10 m |
|---|
 |
SUSPENSIÓN: mezcla heterogénea donde las partículas dispersas sedimentan y pueden filtrarse. Las partículas de la fase dispersa son visibles a simple vista. Ejemplo: arena en agua, algunos medicamentos y cosméticos donde la fase dispersa se deposita en el fondo del recipiente y es necesario agitarlos antes de usar. Tamaño de partícula: mayor de 10 000 Å. |
|---|
 |
DISPERSIONES COLOIDALES O COLOIDES: tipo intermedia de mezcla en el que las partículas con apariencia de soluto, o fase dispersa, se suspenden en la fase con apariencia de solvente, fase continua o dispersante. Las partículas tienen un tamaño intermedio entre las microscópicas y visibles. No son filtrables ya que las partículas traspasan los filtros. Las partículas de la fase dispersa son muy pequeñas, solo visibles con un ultramicroscopio y en algunos casos con un microscopio. Tamaño de partícula: 10 a 10 000 Å. |
|---|
4. Los coloides
Están en la “línea divisoria” entre los sistemas homogéneos y las mezclas heterogéneas, es decir entre las soluciones verdaderas y las suspensiones; se ven homogéneos y la fase dispersa no sedimenta, pero al ser observados al microscopio su aspecto es de dos o más fases como las suspensiones.
Los coloides o sistemas coloidales pueden formarse por cualquier combinación entre sólidos, líquidos y gases, excepto la combinación gas-gas que siempre constituye una solución.
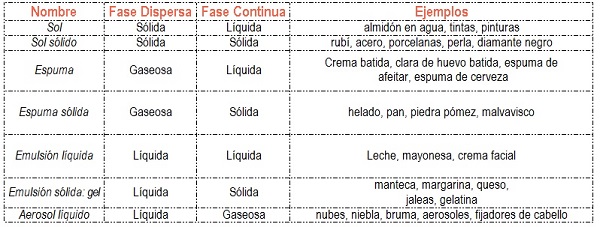
4.1. ¿Qué son las emulsiones?
Si se sacude vigorosamente aceite y agua se forma una emulsión. Dicha emulsión es inestable, al reposar se separa en dos fases nuevamente. La tendencia natural es que las gotas de agua se unan, lo mismo las de aceite, y así se forma un sistema más estable. A fin de que el agua y el aceite formen una emulsión estable debe estar presente una tercera sustancia llamada AGENTE EMULSIONANTE O EMULSIONADOR.
En ocasiones se añaden ESTABILIZADORES cuya función es mantener la emulsión una vez que se haya formado. Dichas sustancias mejoran la estabilidad aumentando la viscosidad de la emulsión. Al aumentar la viscosidad, se reduce la libertad de movimiento de las gotitas dispersas de la emulsión y esto disminuye la posibilidad de que se pongan en contacto y se unan.
Por ejemplo:
 |
|
|---|---|
 |
|
|
Observa el siguiente video:
6. Créditos
Referencias bibliográficas:
- Whitten, K., Davis, R. y Peck. M. (1998). Química General. (5ta edición). Madrid, España: Mc Graw Hill
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
Imágenes:
- Módulo sistemas coloidales
- Ejemplo cuestionario: https://www.abc.com.py/resizer/1W-yrjro5e8_abjEA4DBDqUxY_U=/fit-in/770x495/smart/arc-anglerfish-arc2-prod-abccolor.s3.amazonaws.com/public/KZBSFFI3ERHPDLUF3S6J7QFUJQ.jpg
- Leche: https://www.publicdomainpictures.net/pictures/60000/velka/glass-of-milk-13796122733hr.jpg
- Mayonesa: https://upload.wikimedia.org/wikipedia/commons/6/60/Mayonnaise_%281%29.jpg
- Helado: https://p1.pxfuel.com/preview/180/322/375/ice-cream-cone-ice-cream-cone-dessert.jpg
- 1. Recuperado de: https://image.flaticon.com/icons/svg/73/73207.svg
- 2. Recuperado de: https://image.flaticon.com/icons/svg/73/73164.svg
- 3. Recuperado de: https://image.flaticon.com/icons/svg/73/73128.svg
Videos:
Universidad Complutense de Madrid . (2016, enero 12). [MOOC] - Sistemas coloidales: emulsiones líquidas 1. [Archivo de vídeo]. Recuperado de: https://youtu.be/L0NKt5R5cfUfq-experimentos . (2011, junio 19). Mezclas coloidales y Efecto Tyndall. [Archivo de vídeo]. Recuperado de: https://youtu.be/VuPTLbsJ6nM