Energía y calor
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | Energía y calor |
| Imprimido por: | Invitado |
| Día: | viernes, 4 de abril de 2025, 00:41 |
1. Repasando
En esta unidad temática es necesario que puedas:
- diferenciar cambios físicos de químicos (enlace para profundizar),
- balancear expresiones que representan un cambio químico (enlace para profundizar),
- realizar cálculos de cantidad química de las sustancias involucradas (enlace para profundizar),
- entre otros.
Por lo que se sugiere que si alguno de estos temas no lo recuerdas bien los puedas repasar en cada enlace anterior.

2. Introducción
Biomoléculas y dieta:
Las biomoléculas forman parte de los seres vivos y se pueden clasificar en:
- proteínas,
- lípidos,
- glúcidos y
- ácidos nucleicos
Es importante también analizar su presencia en lo relacionado con la dieta, como puedes repasar en el módulo introductorio.
¿Qué son los nutrientes?
Son sustancias que componen los alimentos, son imprescindibles para el crecimiento y el funcionamiento del organismo y son los compuestos que utilizan las células. Satisfacen las necesidades de materia y energía requeridas por las células.

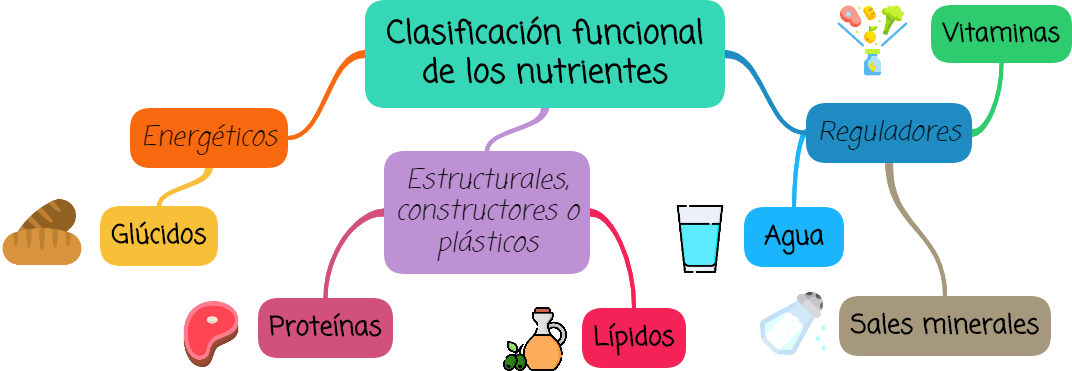
Los principales nutrientes que se obtienen de los alimentos se pueden clasificar en:
CLASIFICACIÓN FUNCIONAL DE LOS NUTRIENTES | Ejemplos: | |
Energéticos
| Cuando se transforman en las células liberan energía. | Glúcidos principalmente, también lípidos y proteínas. |
Estructurales, constructores o "plásticos"
| Se emplean para formar las estructuras de los seres vivos. | Las proteínas son las más importantes, también se incluyen los lípidos de la membrana celular. |
Reguladores
| No proveen energía y no se degradan en el organismo pero intervienen en los procesos metabólicos. | Agua, sales minerales y vitaminas |
2.1. Valor energético de cada nutriente
¡Comer es delicioso! Todos tenemos una comida favorita, pero comer no es solo darnos un gusto, es la manera en que adquirimos los nutrientes necesarios para tener un cuerpo sano. Estos nutrientes son componentes de los alimentos que tienen una función energética, estructural o reguladora.
No existe ningún alimento que cuente con todos los nutrientes que requerimos, por tanto debemos incluir en nuestra dieta una gran variedad de alimentos.
En general, los alimentos no tienen un solo tipo de nutriente y, además, contienen sustancias que no aportan energía (como el agua), por lo que hay marcadas diferencias en los valores de energía liberada.
La energía que requiere nuestro organismo proviene principalmente de los glúcidos y de los lípidos, como puedes observar en la siguiente tabla.
Nutriente | Producto de metabolismo | Fuente de energía | Energía liberada en los procesos metabólicos |
GLÚCIDOS (no incluye a las fibras) | De su digestión se obtiene glucosa, que llega a los tejidos a través de la sangre para ser usada para la producción de energía (en la respiración). |
Fuente de energía inmediata.
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l) Energía liberada = - 2790 kJ/mol Energía liberada = - 3,7 kcal/g | 4 kcal/g |
LÍPIDOS
| De su transformación se obtienen CO2 y H2O. | Son las reservas de energía del organismo y son usados cuando los glúcidos son insuficientes. Cuando la energía incorporada a través de los alimentos es mayor que la usada, el exceso se convierte sobre todo en grasas que se acumulan en el tejido adiposo. | 9 kcal/g |
PROTEÍNAS | De su transformación se obtiene también urea. | Son las principales moléculas estructurales de las células e intervienen en todas las funciones vitales. Sirven como fuente para producir energía en caso de ayuno, cuando se agotan las reservas de los otros nutrientes. | 4 kcal/g |
La energía que los alimentos suministran se encuentra contenida en los enlaces químicos de las sustancias que los forman.
3. ¿Qué es el calor?
Los nutrientes aportan materia y energía para el crecimiento y funcionamiento de las células.
La energía se puede definir como la capacidad de producir transformaciones. Las transformaciones químicas, así como los procesos físicos, se acompañan de transferencias de energía.
La termoquímica estudia aquellas transformaciones que se acompañan de liberación o de absorción de calor.
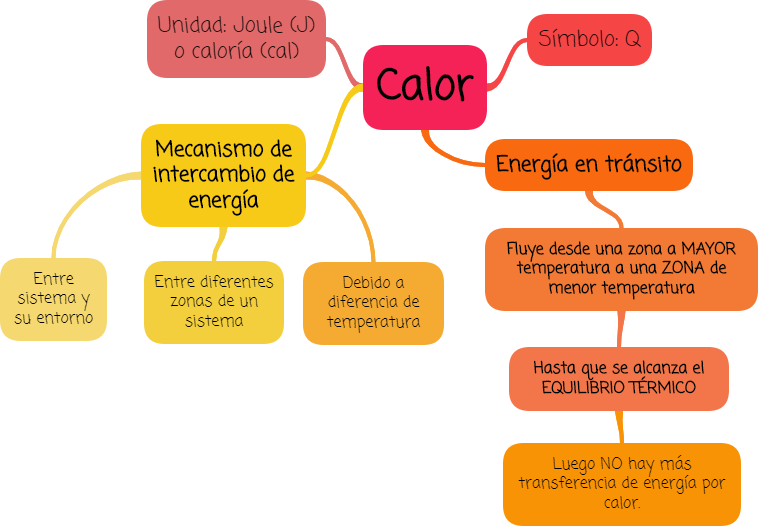
¿Qué es el calor?
El calor, es la energía transferida, a través de paredes conductoras, entre un sistema y su ambiente (o entre sistemas en contacto) cuando sus temperaturas son diferentes. Es un mecanismo de intercambio de energía.
El calor es energía en tránsito. Esta energía siempre fluye de una zona de mayor temperatura a una zona de menor temperatura, Este intercambio de energía provoca un incremento de temperatura de la primera zona y una disminución en la segunda. Se intercambia energía en forma de calor entre distintos cuerpos, o entre diferentes partes de un mismo cuerpo que están a distinta temperatura.
Cuando están en contacto varios objetos a diferente temperatura, se da espontáneamente una transferencia de energía en forma de calor, desde los objetos que están a mayor temperatura hacia los que están a menor temperatura hasta que todos los objetos llegan a la misma temperatura y se alcanza el equilibrio térmico.
Una vez alcanzado el equilibrio térmico no hay más transferencia de energía por calor.
El calor se simboliza con la letra "Q".
3.1. Unidades
La unidad de energía en el Sistema Internacional es el Joule que se simboliza "J".
Recibe este nombre en honor al físico James Joule.

Un múltiplo de uso frecuente es el kilojoule que se simboliza "kJ"y equivale a 1000 J.
En Medicina, Biología, Nutrición es común que se utilice como unidad de energía la caloría, cuyo símbolo es "cal".
James Joule determinó experimentalmente que 1 caloría equivale a 4,18 J.
1 cal = 4,18 J
3.2. Diferencias entre temperatura y calor
Cotidianamente utilizamos temperatura y calor como sinónimos entre sí. Pero en Ciencias no son sinónimos, son magnitudes muy diferentes.
Es necesario aclarar la diferencia entre temperatura y calor.
A continuación resaltaremos las diferencias:
TEMPERATURA
1) La temperatura es una propiedad de los sistemas que no se transfiere.
2) La temperatura se mide con un termómetro.
3) La medida de temperatura se expresa en diferentes unidades: Celsius, Kelvin, etc.
CALOR
1) El calor es una forma de transferir energía.
2) La medida de calor se expresa en unidades de energía (Joule, caloría, etc.).

3.3. Sensación térmica
¿Por qué percibimos diferentes sensaciones térmicas?
La piel no sirve como termómetro porque percibe sensaciones térmicas diferentes aunque la temperatura sea la misma. Estas sensaciones térmicas las percibimos a través de receptores, de frío llamados de Krause y de calor llamados de Ruffini. Estos receptores se encuentran en nuestra piel distribuidos en forma desigual, de ahí que tengamos algunas zonas más sensibles que otras.
Es incorrecto decir “tengo frío” o “hace calor” sino más bien “siento frío” o “siento calor”.

3.4. Variación de temperatura, masa y calor específico
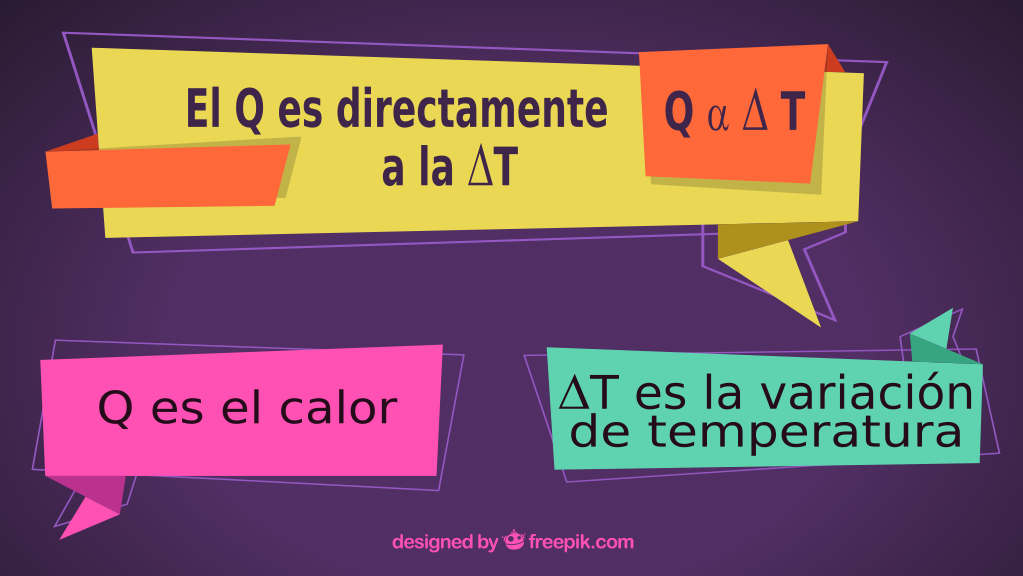
A partir de datos experimentales se puede concluir que el calor es directamente proporcional a la variación de temperatura.
La variación de temperatura, se calcula restando la temperatura final y la temperatura inicial (Δt = tfinal - tinicial).
A partir de datos experimentales se puede concluir que el calor es directamente proporcional a la masa.

Por lo tanto sabemos que: Q α (es directamente proporcional) Δt y también es directamente proporcional a la masa.
Podemos decir entonces que Q α m. Δt (el calor es directamente proporcional al producto entre la masa y la variación de temperatura).
Si calculamos el cociente entre el calor y el producto de la masa y la variación de temperatura (m . ΔT) obtenemos un valor constante:
Q / m . ΔT = constante
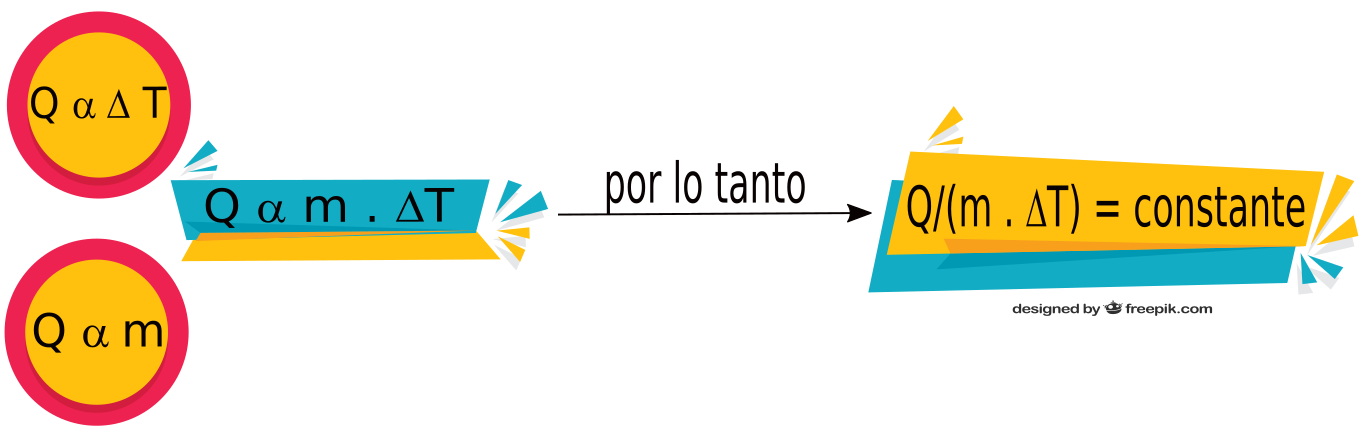
El valor constante que se obtiene al hacer el cociente Q/(m . ΔT ), es diferente para cada sustancia o material, y es una propiedad intensiva característica denominada Calor Específico. La notación que se utiliza para denominar al Calor Específico es Ce.

El calor específico de una sustancia o material, cuya notación es "Ce", es la cantidad de energía que hay que suministrar a 1 gramo de la misma para que su temperatura aumente 1 °C.
Las unidades más utilizadas del calor específico son: J/g°C o cal/g°C.
3.5. ¿Cómo se calcula el calor?
Se puede determinar el calor que absorbe o libera un sistema conociendo la temperatura inicial y final del sistema, su masa y el calor específico del material que lo forma. El calor se calcula con la siguiente expresión matemática:

Siendo: Q → calor absorbido o liberado por el cuerpo
m → masa del cuerpo
Ce → calor específico (valor característico para cada sustancia o material)
ΔT = Tf - Ti → variación de temperatura (temperatura final menos temperatura inicial)
Para tener en cuenta:
- si el sistema absorbe energía, la temperatura del cuerpo aumenta, es decir la temperatura final es mayor que la inicial, por lo tanto la ΔT es positiva y el Q es positivo: ΔT > 0 → Q > 0.
- si el sistema libera energía, la temperatura del cuerpo disminuye, es decir la temperatura final es menor que la inicial, por lo tanto Δt es negativa y el Q es negativo. ΔT < 0 → Q < 0.
Usando la misma ecuación pero operando matemáticamente se pueden determinar las magnitudes masa, calor específico o variación de temperatura, según se desee y dependiendo de los datos experimentales que se tengan.
El siguiente esquema te puede ayudar a calcular la magnitud que corresponda según los datos, también se aclara la unidad de cada una:
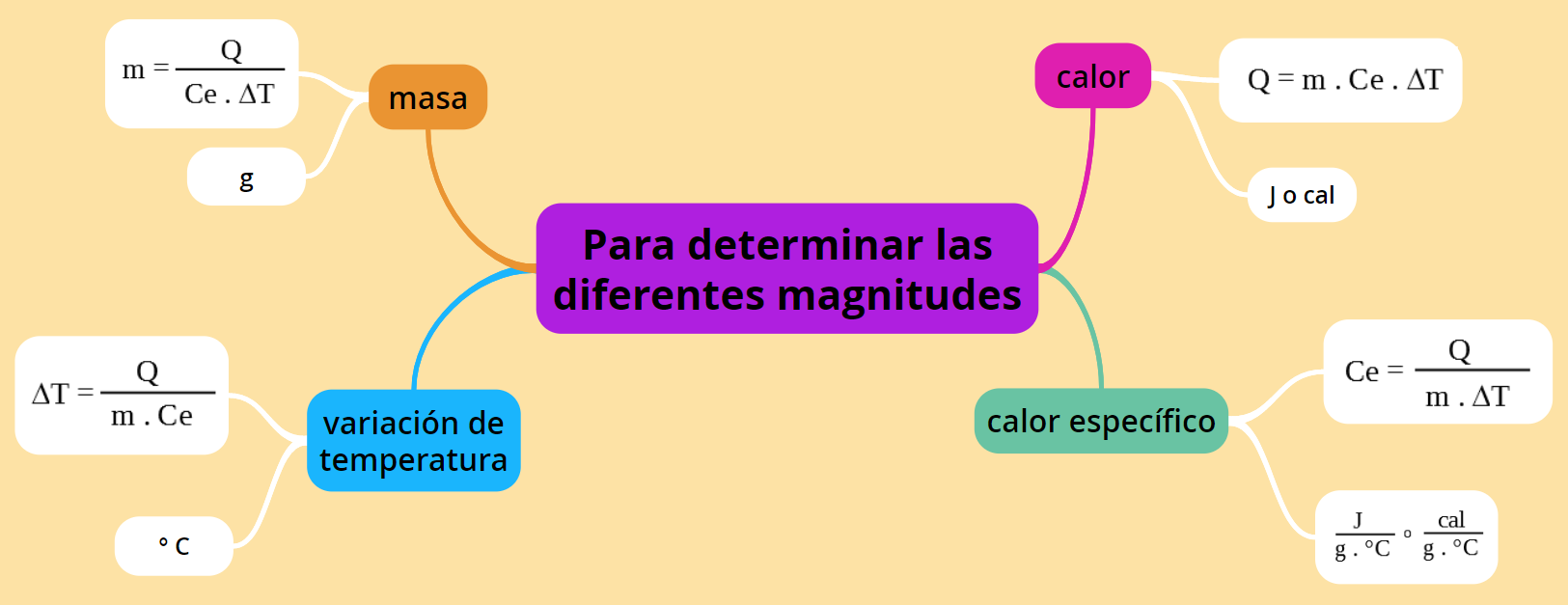
La tabla a continuación contiene la misma información del esquema en otro formato:
Magnitud | Ecuación | Unidades |
|---|---|---|
Calor (Q) | Q = m . Ce . ∆T
| J o cal |
Calor específico (Ce) | Ce = Q/m.∆T
| J/g°C o cal / g°C |
Masa (m) |
m = Q/Ce .∆T | g |
Variación de temperatura (∆T) | ∆T = Q/ m. Ce
| °C |
3.6. Ejemplos de resolución de ejercicios
![]()
Determinar el calor que absorbe una moneda de cobre (Ce = 0,385 J/g.°C), de masa 3,25 g, si su temperatura se eleva desde 5,0 °C hasta 30,0 °C.
Resolución:
- Como se pide determinar el Q, se usa la ecuación: Q = m . Ce . ΔT, y se sabe que ΔT= Tf - Ti
- Identificar los datos que aparecen en la letra:
Ce = 0,385 J/g.°C
m = 3,25 g
Ti = 5,0 °C
Tf = 30,0 °C
- Sustituir los valores en la ecuación: Q = 3,25 g . 0,385 J/g.°C . (30,0 °C - 5,0 °C) = 31,3 J
- Luego de realizar la operación el valor del calor absorbido por la moneda es de 31,3 J, este valor es positivo porque la moneda aumentó su temperatura.
![]()
Se le suministran 30,00 kcal a una cierta masa de agua, su temperatura aumenta de 5,00 °C a 30,00 °C. Determinar el valor de la masa de agua usada en el experimento.
Resolución:
- Como se pide determinar la masa, se usa la ecuación: m = Q/Ce . ΔT
- Identificar los datos que aparecen en la letra del ejercicio:
Q = 30 kcal, el valor que está en kcal lo tenemos que pasar a cal, por lo tanto Q = 30.000 cal
Ti = 5,0 °C
Tf = 30,0 °C
- El valor de Ce del agua se obtiene de la tabla de Calores Específicos vista anteriormente: Ce = 1,00 cal/g . °C
- Sustituiir los valores en la ecuación: m = 30.000 cal / [1,000cal/g . °C . (30,00 °C - 5,00 °C)] = 1.200 g
- Luego de realizar la operación, determinar que la masa de agua usada fue de 1.200 g o 1,2 kg.
De igual forma se procede si se pide cualquiera de las otras magnitudes.
3.7. Para pensar
![]()
Un adorno cuya masa es de 0,125 kg absorbe 525 cal aumentando su temperatura 75,0 ºC.
¿Será de plata o de platino?
Justifica tu respuesta realizando los cálculos que correspondan.
4. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Alegría, M., Bosack, A., Deprati, A., Dal Fávero, M., Franco, R., Jaul, M. y Morales, E. (1999). Química II Dinámica de las transformaciones. Introducción a la Química biológica, ambiental e industrial. Argentina: Santillana.
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Bosack, A. (2001). Química. Serie Activa. Buenos Aires, Argentina: Puerto de Palos.
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill.
- Irazoquí, R; Rebollo, C y Soubirón, E. (2012). Primer año de Bachillerato. Química. Un abordaje sustentable. C. Suiza, Uruguay; Correo del Maestro.
- Masterton, W. y Hurley, C. (2004). Principios y reacciones. (4ta edición). Madrid, España: Thomson.
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
Vídeos, páginas y/o simuladores utilizados:
- Módulo 12: Cálculos de calor. http://aulas.uruguayeduca.edu.uy/course/view.php?id=809§ion=13
- Módulo 18. Procesos exotérmicos y endotérmicos. http://aulas.uruguayeduca.edu.uy/course/view.php?id=98§ion=22
Las imágenes utilizadas fueron tomadas de:
- Pan. https://image.flaticon.com/icons/svg/2915/2915835.svg
- Carne. https://image.flaticon.com/icons/svg/2224/2224259.svg
- Aceite.https://image.flaticon.com/icons/png/512/2224/2224306.png
- Vaso de agua. https://image.flaticon.com/icons/svg/1864/1864846.svg
- Salero. https://image.flaticon.com/icons/png/512/581/581712.png
- Vitaminas. https://image.flaticon.com/icons/png/512/2317/2317041.png
- Molécula de agua. https://image.flaticon.com/icons/png/512/2793/2793587.png
- Colesterol. https://image.flaticon.com/icons/svg/2734/2734186.svg
- Molecule. https://image.flaticon.com/icons/svg/857/857479.svg
- Plato de comida. https://image.flaticon.com/icons/svg/74/74602.svg
- Célula. https://image.flaticon.com/icons/png/512/2699/2699526.png
- Bloque de construcción. https://image.flaticon.com/icons/svg/1973/1973851.svg
- Rayo. https://image.flaticon.com/icons/svg/1330/1330254.svg
- Metabolismo. https://image.flaticon.com/icons/svg/1855/1855016.svg
- Termómetro. https://image.flaticon.com/icons/svg/899/899746.svg
- Flechas. https://image.flaticon.com/icons/svg/860/860774.svg / https://image.flaticon.com/icons/svg/1059/1059157.svg
- Modelo de piel. https://image.flaticon.com/icons/svg/2885/2885281.svg
- Mapa mental. https://image.flaticon.com/icons/svg/1205/1205507.svg