Material de lectura
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Formato rejilla |
| Libro: | Material de lectura |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:16 |
Tabla de contenidos
1. Repasando
Los secretos del carbono...
Es un elemento químico muy singular cuyos átomos presentan algunas propiedades que revisaremos a continuación.
Como ya has estudiado en tercer año el carbono es el número 6 en la tabla periódica, lo que significa un átomo de carbono tiene 6 protones en su núcleo y 6 electrones en la periferia. Los electrones se encuentran ordenados en niveles, para el caso del carbono la distribución electrónica es la siguiente:
Nivel 1: 2 e-
Nivel 2: 4 e-
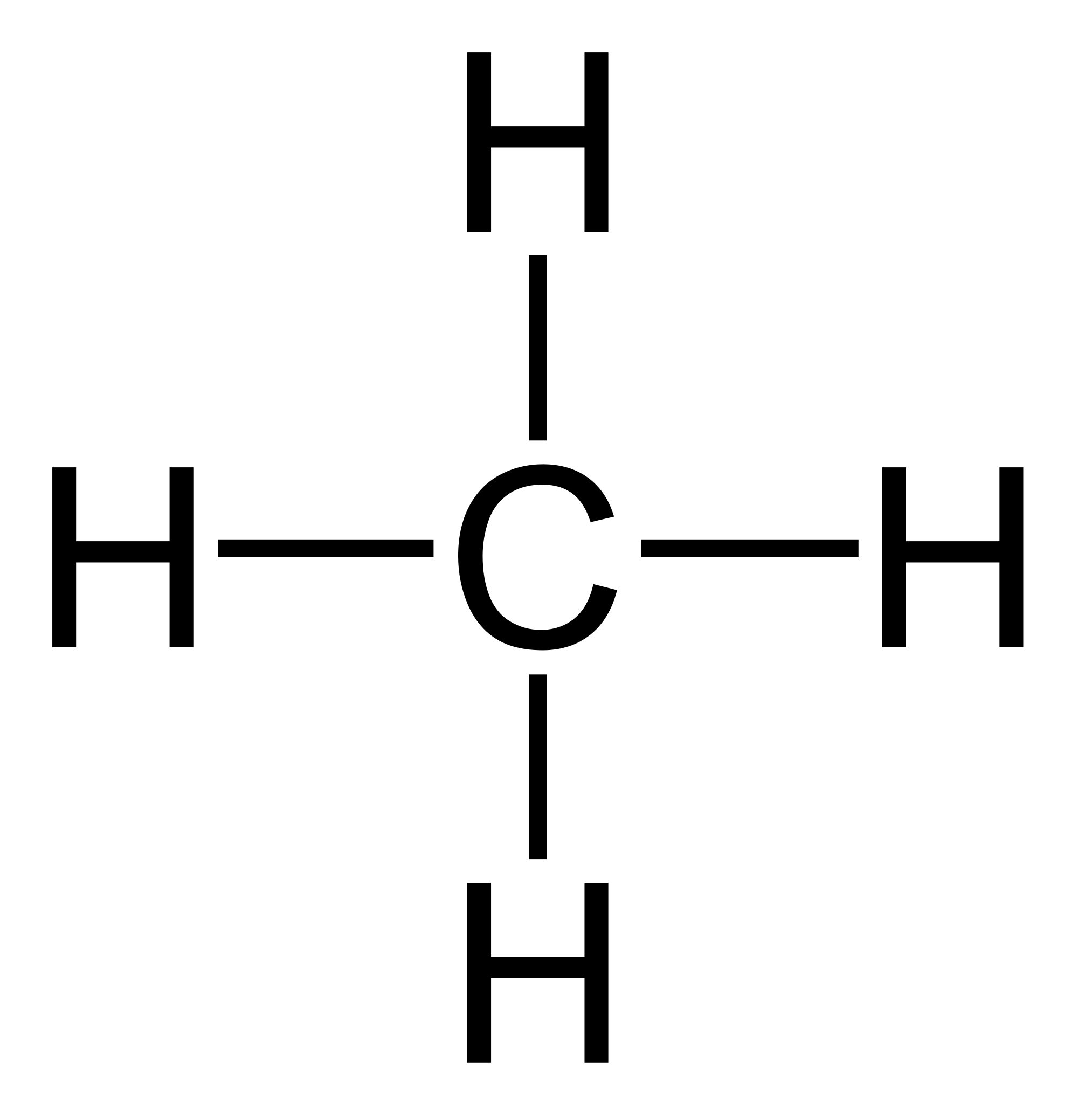
Los electrones que se encuentran en el último nivel de energía incompleto se llaman electrones de valencia. El átomo de carbono tiene entonces 4 electrones de valencia (pertenecientes al nivel 2). Si realizamos el diagrama de Lewis(representando cada electrón de valencia con un punto) nos quedaría:

Estos 4 electrones de valencia posibilitan la formación de 4 enlaces covalentes. Por esto se dice que los átomos de carbono son tetravalentes.
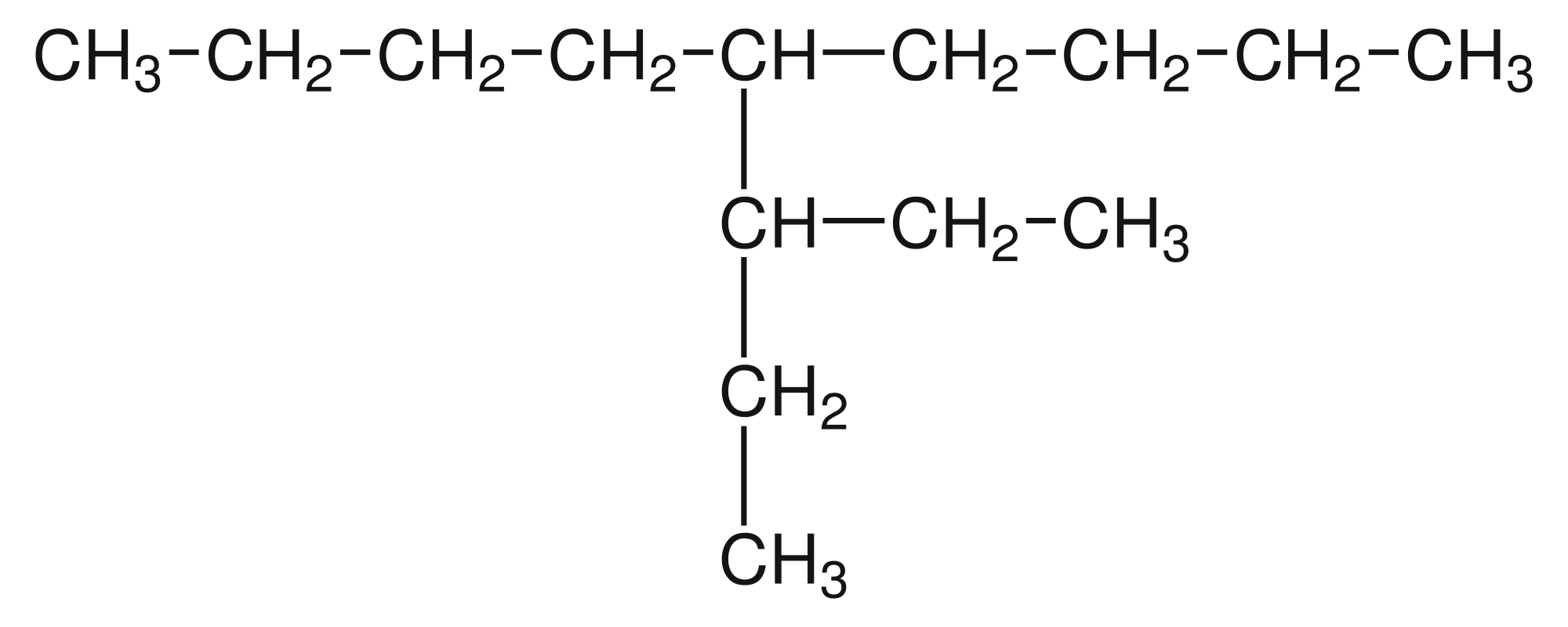
Otra propiedad de los átomos de carbono es laconcatenación, se unen entre sí formando cadenas.
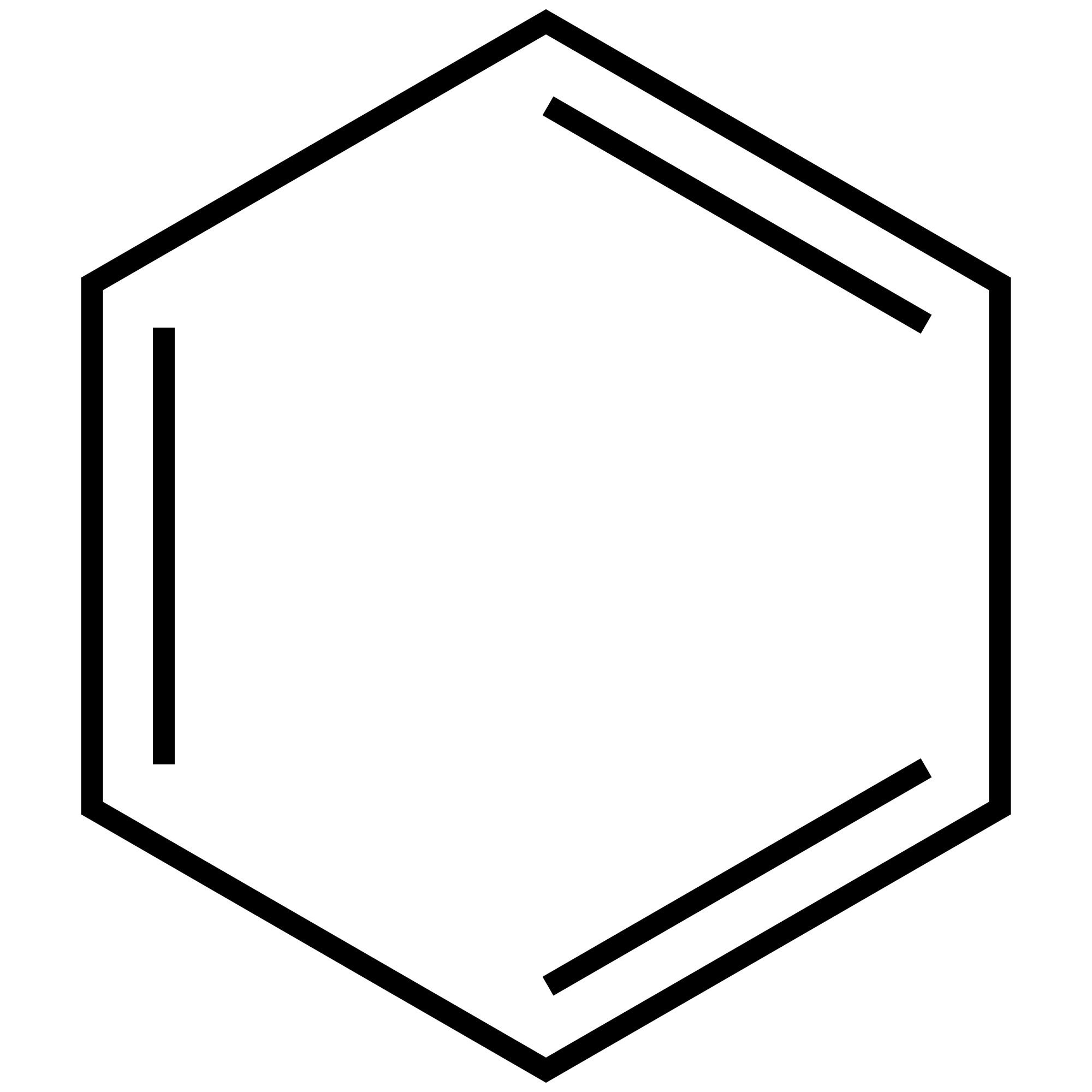
A su vez, las cadenas carbonadas pueden cerrarse formando anillos.
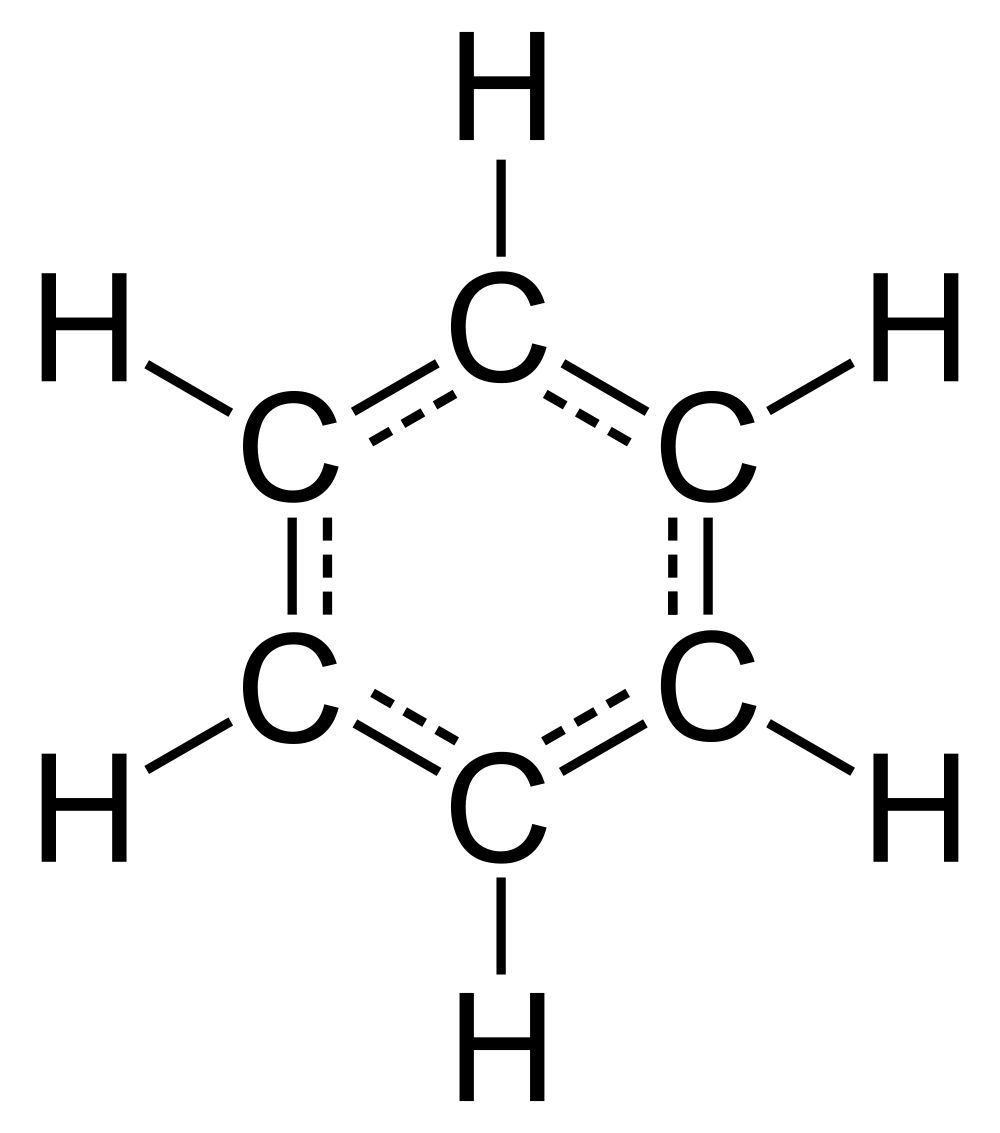
El compuesto anterior (benceno) también se puede representar:
Los átomos de carbono pueden unirse entre sí y con otros átomos de distintos elementos formando:
- enlaces simples (-C-C-, -C-H)
- enlaces múltiples (-C=C-, -C=O, -C≡C-, -C≡N)
Compartiendo uno o más pares de electrones con otro átomo de carbono, de oxígeno, nitrógeno, etc.
Estas propiedades analizadas son la base de los compuestos que estudiaremos en siguientes módulos.
1.1. Hidrocarburos. Alcanos
HIDROCARBUROS (HC)
Como su nombre lo indica, son compuestos orgánicos formados por los elementos carbono e hidrógeno.
Se utilizan como fuente de energía tanto en la industria como en nuestros hogares. El petróleo es la mayor fuente de hidrocarburos, luego le sigue el gas natural.
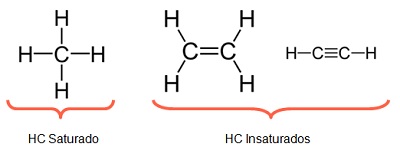
Los podemos clasificar en saturados e insaturados. Los HC saturados son compuestos que tienen todos los enlaces simples entre átomos de carbono.Los HC insaturados tienen al menos un enlace doble o triple en la cadena carbonada.
Según la disposición de los átomos de carbono podemos hablar de HC:
- lineales: presentan una cadena carbonada continua.
- ramificados: presentan cadenas laterales, llamadas ramificaciones, unidas a la cadena principal.
- cíclicos: la cadena está formando anillos o ciclos.
Dentro de los HC encontramos distintas familias(conjunto de compuestos que tienen propiedades comunes):
- alcanos,
- alquenos,
- alquinos,
- aromáticos.
ALCANOS:
Son HC saturados, o sea todos los enlaces entre los átomos de carbono son simples. La fórmula generalde los alcanos es CnH2n+2, siendo n el número de átomos de carbono presente en el compuesto.
El alcano más simple es el metano, formado por un átomo de carbono.
En la tabla a continuación aparecen los 5 primeros compuestos que pertenecen a la familia de los alcanos representados de diversas maneras.
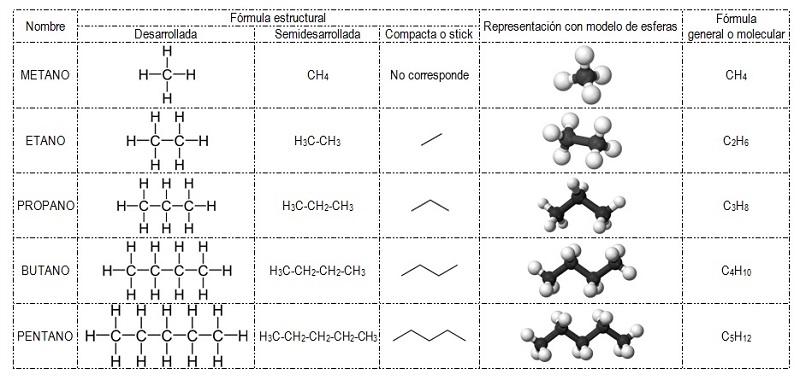
La fórmula estructural indica cómo están unidos entre sí los distintos átomos. La fórmula estructural puede ser desarrollada, donde se indican todos los enlaces entre los átomos. O también semidesarrollada donde se representan los enlaces entre los átomos de carbono pero no los enlaces entre carbono e hidrógeno (los átomos de hidrógeno se representan de forma condensada, o sea se indica el número total de átomos de hidrógeno unidos al carbono en cuestión). La fórmula compacta o stick es aún más simplificada en donde solamente se representan los enlaces entre los átomos de carbono (no se representan los hidrógenos) utilizando líneas.
La representación con modelo de esferas se hace en 3 D.
La fórmula general o molecular indica cuántos átomos de cada elemento (carbono e hidrógeno, en este caso) forman a la molécula del compuesto que se está analizando.
1.2. Alquenos, alquinos
Continuamos ahora con la familia de los alquenos y los alquinos. Ambas familias pertenecen al grupo de los hidrocarburos insaturados, ya que presentan un doble o triple enlace en la cadena carbonada.
ALQUENOS:
Presentan un doble enlace en la cadena carbonada. Su fórmula general es CnH2n, siendo n el número de átomos de carbono presente en el compuesto. Para darles nombre a los compuestos de la familia de los alquenos aplicamos las mismas reglas (nomenclatura IUPAC) que en el caso de los alcanos, cambiando el sufijo por ENO.
Por ejemplo, el alqueno más pequeño es el eteno o etileno (gas a temperatura ambiente que constituye materia prima para la elaboración del polímero sintético llamado polietileno).
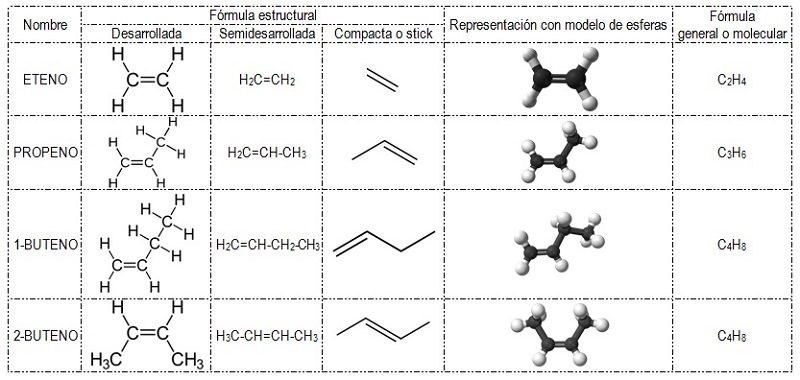
Recuerda que a partir del buteno debemos indicar con un número la posición del doble enlace ya que comienzan a surgir más posibilidades. En el caso de los alquenos se numera la cadena de tal manera que el doble enlace se encuentre en la posición más baja posible. El carbono que forma parte del doble enlace y que se encuentra en el interior de la cadena carbonada solo podrá unirse con un átomo de hidrógeno o una ramificación (respetando la tetravalencia).
ALQUINOS:
Presentan un triple enlace en la cadena carbonada. Su fórmula general es CnH2n-2, siendo n el número de átomos de carbono presente en el compuesto. Para darles nombre seguimos las mismas reglas que en el caso anterior, cambiando el sufijo por INO.
Por ejemplo, el alquino más pequeño es el etino o acetileno (gas utilizado en los sopletes oxiacetilénicos).
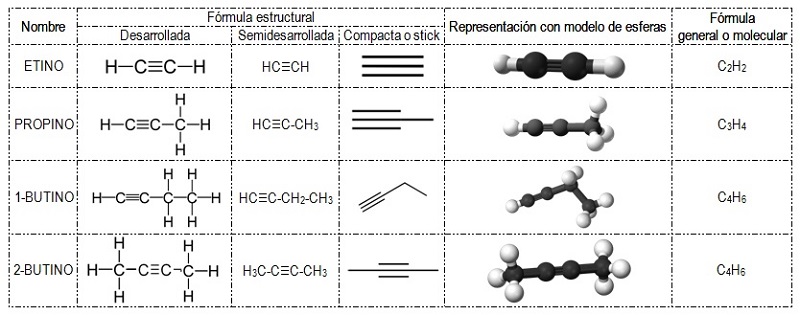
Al igual que en el caso de los alquenos, a partir del butino debemos indicar con un número la posición del triple enlace ya que comienzan a surgir más posibilidades. También se numera la cadena de tal manera que el triple enlace se encuentre en la posición más baja posible. El carbono que forma parte del triple enlace y que se encuentra en el interior de la cadena carbonada no podrá unirse a un hidrógeno ni a una ramificación (respetando la tetravalencia).
1.3. Isómeros
ISÓMEROS:
Son compuestos que presentan la misma fórmula molecular, pero que difieren en su estructura, o sea el ordenamiento de sus átomos no es el mismo, o en la distribución en el espacio de los átomos que componen a la molécula.
Difieren en sus propiedades características.
Iso: iguales; Meros: partes.
ISOMERÍA EN HIDROCARBUROS
Podemos observar los siguientes tipos de isomería en los compuestos que hemos estudiado: isomería plana o estructural (de cadena y de posición de función), y espacial (geométrica).
- Isomería estructural de cadena:
Observa los siguientes compuestos llamados butano y metilpropano.
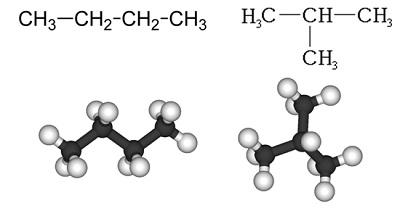
Ambos tienen como fórmula molecular C4H10 pero su estructura no es la misma. Podemos decir que son isómeros de cadena entre sí.
- Isomería estructural de posición de función:
En el siguiente ejemplo puedes ver cómo a pesar de que los compuestos tienen la misma cadena principal, el grupo funcional (en este caso el doble enlace) se encuentra ubicado en una posición diferente en la cadena dando lugar al 1-buteno y al 2-buteno, ambos de fórmula molecular C4H8 .
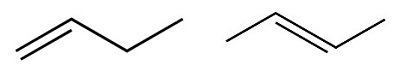
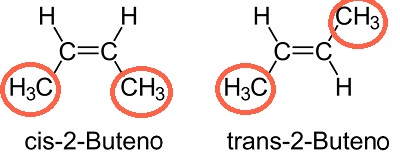
- Isomería espacial geométrica:
Los compuestos que presentan esta isomería coinciden en el grupo funcional y la posición del mismo, pero difieren en la ubicación de los sustituyentes unidos al doble enlace (en el isómero cislos sustituyentes se encuentran en el mismo plano -"del mismo lado del doble enlace", y en el isómero trans se encuentran en planos contrarios- "lados opuestos del doble enlace").
Algunos alquenos presentan este tipo de isomería.

En resumen:
Los alcanos pueden presentar isomería estructural de cadena.
Los alquenos y alquinos pueden presentar isomería estructural de cadena y de posición de función.
Los alquenos además pueden presentar isomería espacial geométrica.
1.4. Funciones oxigenadas
Las funciones oxigenadas son aquellas que aparte de tener átomos de carbono y de hidrógeno tienen átomos de oxígeno.
Las principales familias son:
- Funciones oxigenadassimples: Alcoholes, Aldehídos, Cetonas y Ácidos carboxílicos.
- Funciones oxigenadas compuestas: Éter, Éster, Anhídrido.
Grupo Funcional: es un grupo de átomos que definen e identifican a un compuesto para asociarlo con una determinada familia. Por ejemplo, todos los alcoholes poseen en su estructura el grupo hidroxilo (-OH) unido a un átomo de C (carbono).
A continuación detallaremos los grupos funcionales de las familias que pertenecen a las funciones oxigenadas simples.
Los R simbolizan cadenas hidrocarbonadas de determinada longitud.
FUNCIONES OXIGENADAS SIMPLES:
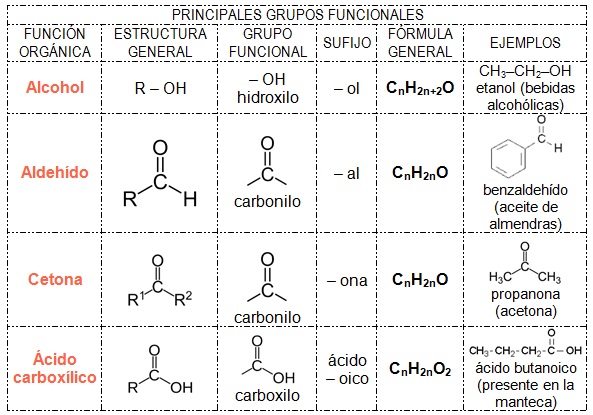
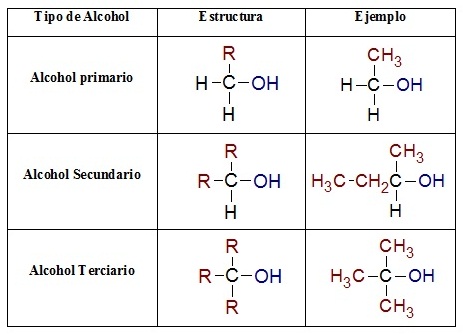
- ALCOHOLES:
Los nombres de los alcoholes se forman con los prefijos que indican el número de átomos de carbono de la cadena principal y la terminación “ol”. Si la cadena es ramificada se escribe primero la ubicación y el nombre de la ramificación y luego la ubicación del grupo funcional -OH junto al nombre de la cadena principal terminada en ol.
Por ejemplo para nombrar el siguiente compuesto:
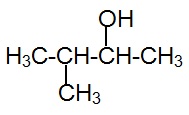
Debemos seleccionar la cadena más larga que contenga al grupo funcional, luego la numeramos de tal forma que el grupo funcional quede en la ubicación más baja posible.
Y por último nombramos al compuesto.
Si quieres puedes repasar las reglas para nombrar compuestos que vimos en el módulo 20.
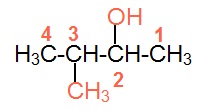
3-metil-2-butanol
Los alcoholes se pueden clasificar en primarios, secundarios y terciarios:
Ejemplos de alcoholes primarios, secundarios y terciarios: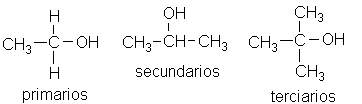
Etanol (primario), 2-propanol (secundario), metil propanol o ter-butanol (terciario).
- ALDEHÍDOS Y CETONAS:
El grupo funcional de ambas familias es el carbonilo. En los aldehídos el grupo carbonilo se encuentra en un carbono primario, en cambio, en las cetonas el mismo se encuentra en un carbono secundario.
Los aldehídos se nombran con la terminación “al”, en cambio en las cetonas la terminación es “ona”
En el caso de los aldehídos no es necesario indicar la ubicación del grupo carbonilo porque siempre se encuentra en el primer carbono, pero en el caso de las cetonas debemos especificar la posición del grupo funcional (excepto para la propanona porque existe una sola ubicación posible del grupo carbonilo).
- ÁCIDOS CARBOXÍLICOS:
El grupo funcional de esta familia es el carboxilo. Se nombran con la palabra ácido seguida del prefijo que indica el número de átomos de carbono de la cadena principal, con terminación "oico". Al igual que en el caso de los aldehídos no es necesario indicar la ubicación del grupo carboxilo porque siempre se encuentra en el primer carbono.
Por ejemplo:
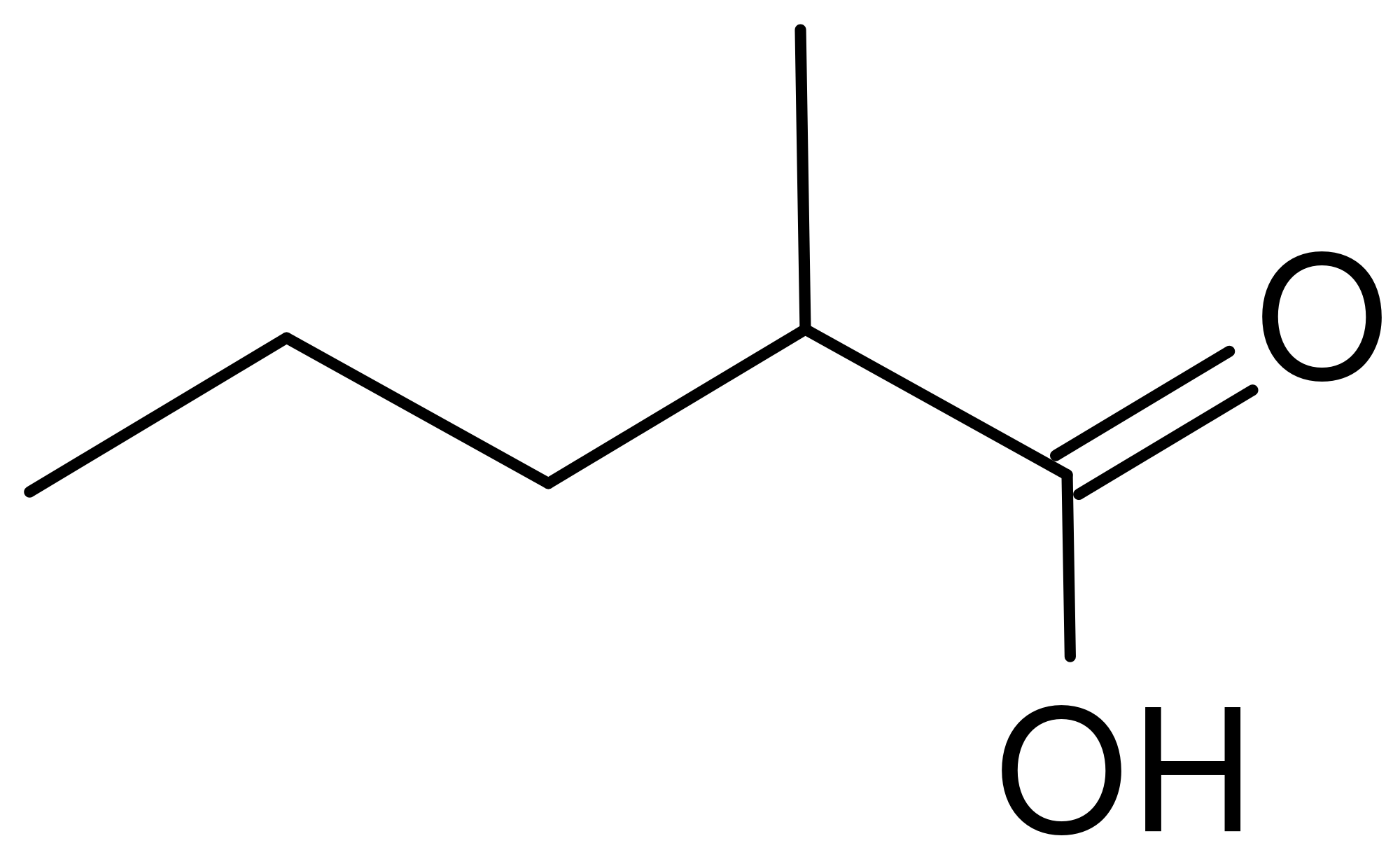
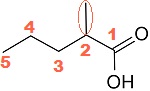
ácido-2-metilpentanoico
2. Biomoléculas
Se llama biomoléculas a aquellas moléculas constituyentes de los seres vivos. Se pueden clasificar en inorgánicas y orgánicas.
Son biomoléculas inorgánicas sustancias como el agua, el dioxígeno y el dióxido de carbono. Aún teniendo en cuanta que las sales minerales no forman moléculas y se encuentran ionizadas en el medio acuoso del organismo, se suelen incluir en esta categoría.
Las biomoléculas orgánicas están formadas fundamentalmente por carbono, hidrógeno, oxígeno y nitrógeno y en menor proporción por fósforo, azufre, hierro y calcio, entre otros. Como ejemplos se pueden mencionar:
- proteínas
- lípidos
- glúcidos
- ácidos nucleicos.
3. Proteínas
Introducción
Las proteínas son biopolímeros formados por más de 100 α-aminoácidos unidos mediante enlaces peptídicos. Los elementos que las forman son C, H, O, N; en muchas de ellas hay S y P, y pocas tienen Fe, Zn, Cu, Co y Mg. De todos los elementos que forman las proteínas, el nitrógeno es el que las caracteriza; las proteínas son los compuestos nitrogenados por excelencia en los seres vivos.
El término "proteína" proviene del griego proteios que significa "lo primero o primordial". Ello indica la importancia de estos compuestos en las células. El nombre fue asignado en 1838 a un grupo de sustancias de origen animal y vegetal que tenían en común el elemento nitrógeno en su composición.
Observa el siguiente vídeo introductorio:
3.1. Funciones
- ESTRUCTURAL: Las membranas
plasmáticas y gran cantidad de tejidos están constituidas por proteínas que
actúan como filamentos y “anclas” de soporte. El colágeno es una proteína
fibrosa que forma parte de los tendones y cartílagos, mientras que la queratina forma el pelo y las uñas; igualmente se
incluye la fibrina de la seda y las telarañas.
- MOVIMIENTO: Algunas
proteínas permiten que la célula o determinadas organelas se muevan, cambien de
forma, etc. La contracción de los músculos se realiza a expensas de que cada
monofilamento grueso contiene varios cientos de molécula s de la proteína miosina, mientras que los delgados
contienen dos cadenas de la proteína actina (las miofibrillas están formadas
por hileras que alternan miofilamentos gruesos y delgados con sus extremos
traslapados). Las integrinas y tubulinas, que mueven el sistema citoesquelético
de la célula, y la dineína de cilias y flagelos también se incluyen en este
grupo.
- TRANSPORTE: Algunas
proteínas trasportan sustancias a ambos lados de la membrana plasmática, y
otras, en los líquidos extracelulares. Por ejemplo, en el plasma sanguíneo existen
lipoproteínas que trasportan los lípidos desde el hígado hasta otros órganos, y
en los glóbulos rojos, la hemoglobina, que trasporta el dioxígeno a los tejidos
para que participe en la oxidación de los nutrientes.
- HORMONAS Y RECEPTORES DE HORMONAS:
- Estas proteínas
permiten regular la actividad fisiológica y metabólica de las células. Algunas
son hormonas de naturaleza proteica, es decir que actúan como mensajeros
químicos que disparan acciones
determinadas en los órganos blanco. En esta categoría se incluyen la insulina,
la tiroxina y la hormona del crecimiento. Otras permiten fijar nucleótidos o se
fijan al ADN.
- PROTECCIÓN INMUNE: Algunas
proteínas defienden el organismo ante una invasión o agresión externa. Los
anticuerpos son proteínas producidas en los glóbulos blancos que permiten
reconocer y neutralizar bacterias y virus. La trombina y el fibrinógeno, por su
parte, son proteínas que actúan en la coagulación de la sangre, cuando se daña
el sistema vascular.
- NUTRICIÓN Y RESERVA: Algunas
proteínas resultan nutrientes celulares; por ejemplo, la caseína de la leche,
la ovoalbúmina del huevo y el endosperma de las semillas.
- CATALIZADORES BIOLÓGICOS: Muchas proteínas globulares, como las catalasas, las permeasas, las peroxidasas y los citocromos, son capaces de acelerar la rapidez de las reacciones químicas, es decir, actúan como catalizadores biológicos. Por ejemplo, la pepsina rompe las proteínas en péptidos pequeños y la renina separa la leche en fracciones líquidas y sólidas, mientras que la lipasa actúa sobre las grasas.
3.2. Clasificación de las proteínas
Visita el siguiente sitio y a partir de la información que allí aparece realiza una tabla de datos que resuma las diferentes formas de clasificar a las proteínas.
4. Aminoácidos
Estructura de un aminoácido
Como hemos visto un aminoácido es la unidad fundamental que constituye a las proteínas (la proteína es un polímero y los aa son sus monómeros).
Para la mayoría de los seres vivos (como los seres humanos) son 20 aa (en la carpeta de materiales útiles tienes un archivo con sus fórmulas, imprímelos para utilizarlos en los ejercicios y en el examen) los que forman a las proteínas, pero existen otros dos aa proteicos en algunos seres vivos (selenocisteína y pirrolisina).
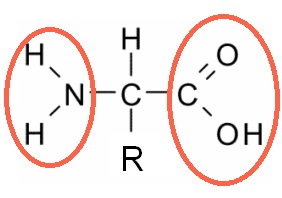
Cada aa está formado por un átomo de carbono unido a:
- un grupo carboxilo
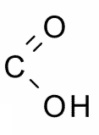 ,
, - un grupo amino
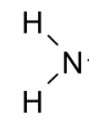 ,
, - un átomo de hidrógeno y
- un grupo radical (R) que permite identificar a cada aa particular (ya que es distinto para cada caso).
4.1. Estereosiomería
Llamamos isómeros a dos compuestos que tienen la misma fórmula molecular pero que difieren en el ordenamiento de sus átomos (isomería estructural) o en la distribución en el espacio de los mismos (isomería espacial). Dentro de la isomería espacial podemos hablar de isomería geométrica (los isómeros coinciden en la función química y en la posición del grupo funcional, difieren en la ubicación de los sustituyentes respecto al doble enlace) y de isomería óptica (hablamos de estereoisómeros, isómeros en los cuales los átomos están unidos en el mismo orden, pero están orientados de forma distinta en el espacio. Sólo se diferencian por la orientación espacial de sus átomos.).
Las moléculas no superponibles con sus imágenes especulares son quirales (todo grupo de puntos cuya imagen en espejo no puede hacerse coincidir consigo misma). Un compuesto cuyas moléculas son quirales puede existir como enantiómero; un compuesto cuyas moléculas son aquirales no puede existir como enantiómero. Los enantiómeros tienen propiedades físicas idénticas, exceptuando la dirección de rotación del plano de la luz polarizada y propiedades químicas idénticas, excepto frente a reactivos ópticamente activos.
Un átomo de carbono unido a 4 grupos diferentes es un centro quiral. En 19 de los 20 aminoácidos el carbono alfa es QUIRAL, siendo la excepción la glicina, en la cual R = H. Por esta razón los aa pueden existir como estereoisómeros.
Ejemplo:
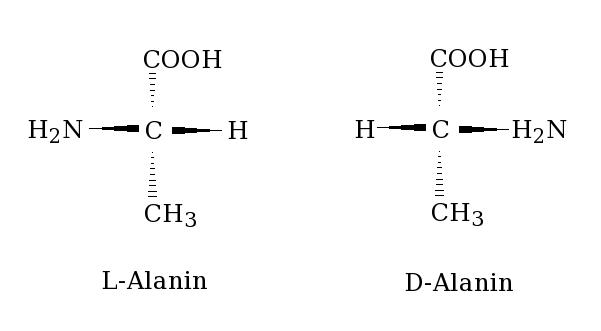
Todos los aa que constituyen las proteínas son pertenecientes a la serie L, (se han encontrado D aa solamente en péptidos pequeños de las paredes celulares bacterianas y en algunos antibióticos peptídicos), siendo por convención, la forma en que se representan.
4.2. Enlace peptídico
Se da la condensación entre el grupo carboxilo de un aa y el grupo amino de otro aa formándose el ENLACE PEPTÍDICO (unión covalente).
Se da esta unión con pérdida de una molécula de agua.
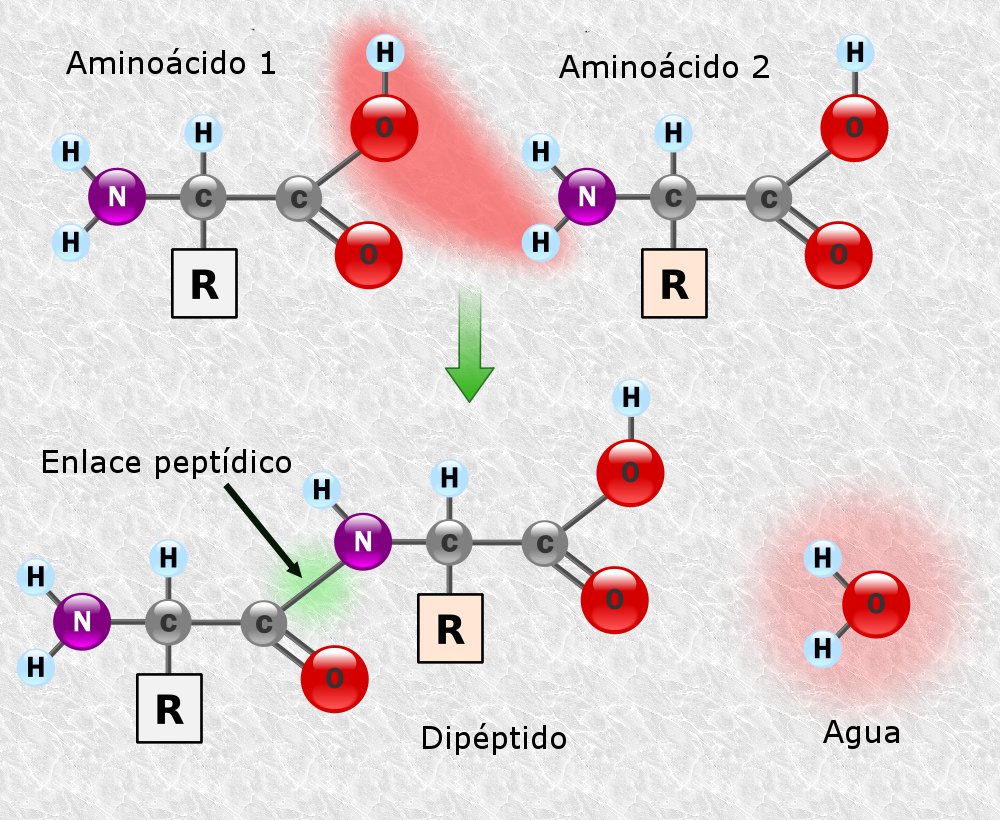
A los aa unidos entre sí se los denomina residuos.
El grupo amino libre y el grupo carboxilo libre en extremos opuestos de la cadena peptídica se denominan N-terminal (amino terminal) y C-terminal (carboxilo terminal).
Por convención, los residuos de aa en una cadena polipeptídica son numerados a partir del N-terminal hacia el C-terminal.
Como puedes observar en la imagen a continuación, que representa a un tripéptido, los puntos A y B se corresponden a los enlaces peptídicos, el punto C al N-terminal y el punto D al C-terminal.
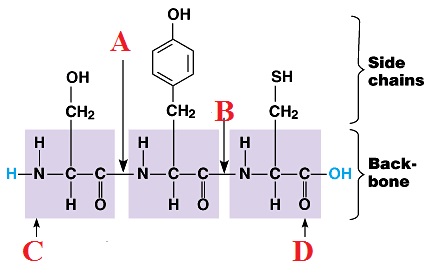
4.3. Clasificación de péptidos y nomenclatura de los aa
¿Cuándo hablamos de proteína y cuándo de péptido?

A continuación podrás ver la nomenclatura que utilizamos para nombrar a los residuos de aa que forman una cadena peptídica.
| Nombre del aa | Abreviación de 3 letras | Abreviación de 1 letra | Nomenclatura |
| Ácido aspártico | Asp | D | aspartil |
| Ácido glutámico | Glu | E | glutamil |
| Alanina | Ala | A | alanil |
| Arginina | Arg | R | arginil |
| Asparagina | Asn | N | asparaginil |
| Cisteína | Cys | C | cisteil |
| Fenilalanina | Phe | F | fenilalanil |
| Glicina | Gly | G | glicil |
| Glutamina | Gln | Q | glutamil |
| Histidina | His | H | histidil |
| Isoleucina | Ile | I | isoleucil |
| Leucina | Leu | L | leucil |
| Lisina | Lys | K | lisil |
| Metionina | Met | M | metionil |
| Prolina | Pro | P | prolinil |
| Serina | Ser | S | seril |
| Tirosina | Tyr | Y | tirosinil |
| Treonina | Thr | T | treonil |
| Triptófano | Trp | W | triptofanil |
| Valina | Val | V | valinil |
4.4. Formación de dipéptidos
Representaremos a través de una ecuación la formación de un dipéptido.
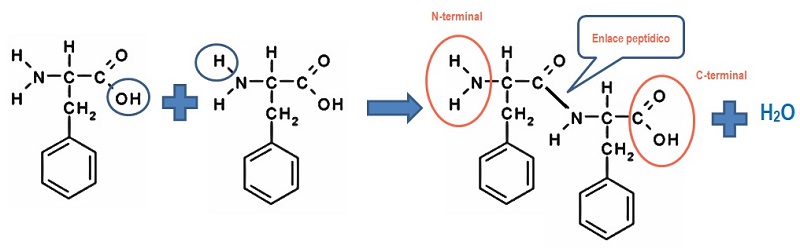
Como puedes observar el grupo carboxilo del primer aminoácido reacciona con el grupo amino del segundo aminoácido, formándose el enlace peptídico y liberándose una molécula de agua.
Para asignar el nombre a cualquier péptido se comienza por el residuo de aa que contiene el N-terminal, cambiándose el nombre del aa como vimos en la sección anterior, y se repite el procedimiento con todos los demás residuos que tenga el péptido, hasta llegar al que contiene el C-terminal que mantiene el nombre original del aa del que proviene.
En el ejemplo anterior el nombre del dipéptido es: fenialanil-fenilalanina (se podría abreviar Phe-Phe o F-F).
5. Estructura de las proteínas
Observa el siguiente vídeo. Recuerda activar la traducción de los subtítulos al español.
Niveles estructurales
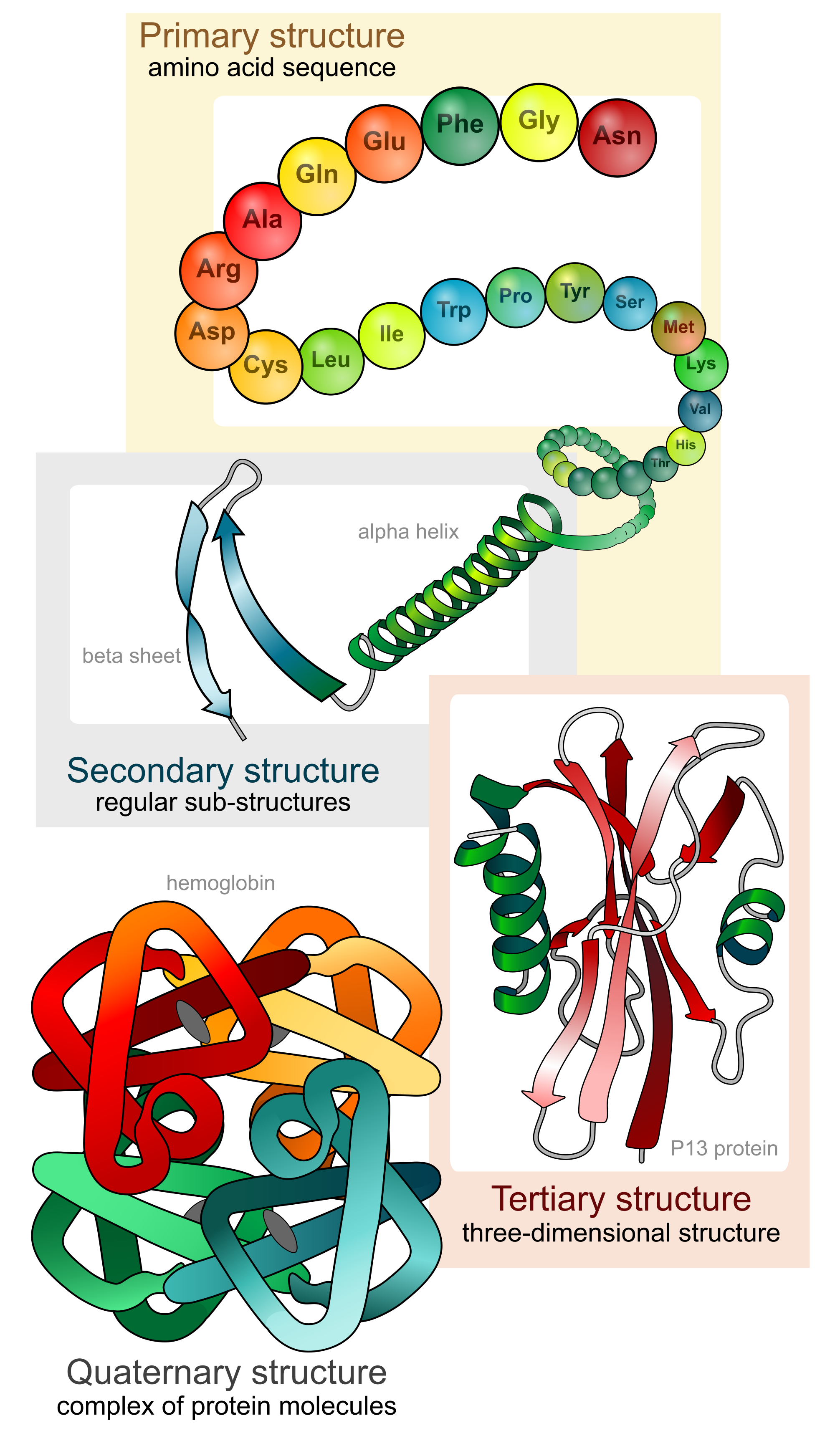
ESTRUCTURA PRIMARIA: Es la secuencia de los residuos de aa enlazados covalentemente (es decir, el número de residuos de aminoácidos presentes y el orden de los mismos), describe la estructura lineal, unidimensional de una proteína. Las posibilidades de estructuración a nivel primario son casi ilimitadas. Como en casi todas las proteínas existen 20 aa diferentes, el número de estructuras posibles es del orden 10200.
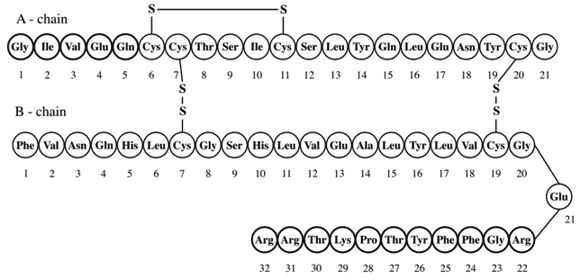
Conocer la estructura primaria de una proteína no solo es importante para entender su función (ya que ésta depende de la secuencia de aminoácidos y de la forma que adopte), sino también en el estudio de enfermedades genéticas. Es posible que el origen de una enfermedad genética radique en una secuencia anormal. Esta anomalía, si es severa, podría resultar en que la función de la proteína no se ejecute de manera adecuada o, incluso, en que no se ejecute en lo absoluto.
5.1. Nivel secundario
ESTRUCTURA SECUNDARIA: La estructura secundaria de las proteínas es el plegamiento que la cadena polipeptídica adopta gracias a la formación de enlaces o puentes de hidrógeno entre los átomos que forman el enlace peptídico. Los enlaces de hidrógeno se establecen entre los grupos -CO- y -NH- del enlace peptídico (el primero como aceptor de H, y el segundo como donador de H). De esta forma, la cadena polipeptídica es capaz de adoptar conformaciones de menor energía libre, y por tanto, más estables.
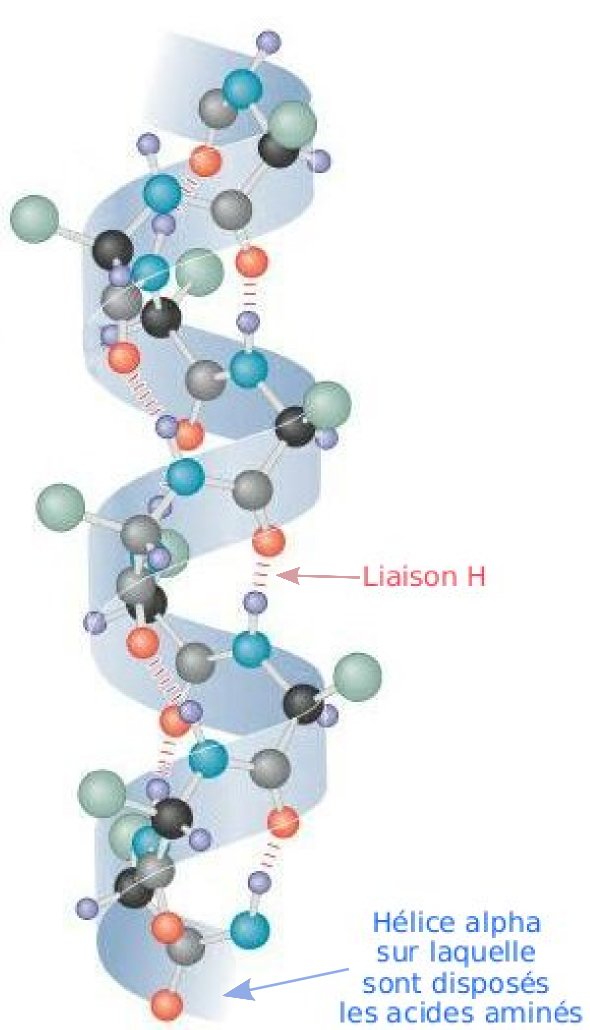
Son ejemplos las α–hélice y las láminas β, y también tipo colágeno (tres cadenas peptídicas retorcidas entre sí formando como un cordón).
Alfa hélice: Esta estructura se mantiene gracias a los enlaces de hidrógeno intracatenarios formados entre el grupo -NH de un enlace peptídico y el grupo -C=O del cuarto aminoácido que le sigue. La cadena polipeptídica se enrolla en espiral sobre sí misma debido a los giros producidos en torno al carbono alfa de cada aminoácido. Las cadenas laterales de los aminoácidos se sitúan en la parte externa del helicoide, lo que evita problemas de impedimentos estéricos. En consecuencia, esta estructura puede albergar a cualquier aminoácido, a excepción de la prolina, cuyo carbono no tiene libertad de giro, por estar integrado en un heterociclo. Por este motivo, la prolina suele determinar una interrupción en la conformación en α-hélice. Los aminoácidos muy polares (Lys, Glu) también desestabilizan la hélice porque los enlaces de hidrógeno pierden importancia frente a las interacciones electrostáticas de atracción o repulsión.
Láminas beta: Cuando la cadena principal de un polipéptido se estira al máximo que permiten sus enlaces covalentes se adopta una configuración espacial denominada estructura β, que suele representarse como una flecha. En esta estructura las cadenas laterales de los aminoácidos se sitúan de forma alternante a la derecha y a la izquierda del esqueleto de la cadena polipeptídica. Las estructuras β de distintas cadenas polipeptídicas o bien las estructuras β de distintas zonas de una misma cadena polipeptídica pueden interaccionar entre sí mediante puentes de hidrógeno, dando lugar a estructuras laminares llamadas por su forma hojas plegadas u hojas β. Cuando las estructuras β tienen el mismo sentido, la hoja β resultante es paralela, y si las estructuras β tienen sentidos opuestos, la hoja plegada resultante es antiparalela.
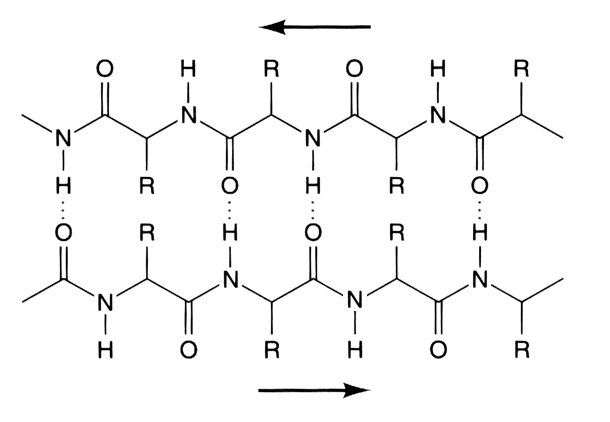
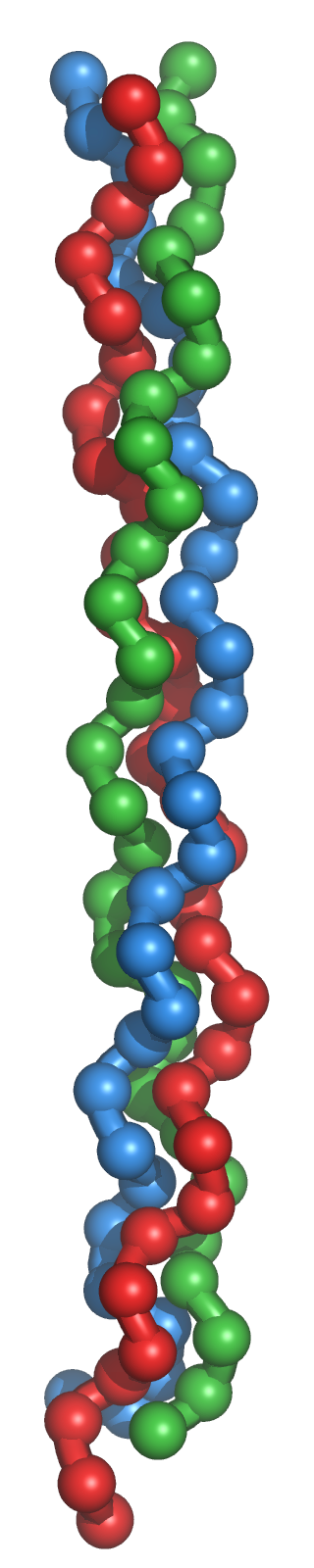
Tipo colágeno: Es una variedad particular de la estructura secundaria, característica del colágeno. El colágeno es una importante proteína fibrosa presente en tendones y tejido conectivo con función estructural ya que es particularmente rígida. Presenta una secuencia típica compuesta por la repetición periódica de grupos de tres aminoácidos. El primer aminoácido de cada grupo es Gly, y los otros dos son Pro (o hidroxiprolina) y un aminoácido cualquiera: -(G-P-X)-. La frecuencia periódica de la Prolina condiciona el enrollamiento peculiar del colágeno en forma de hélice levógira. La glicina, sin cadena lateral, permite la aproximación entre distintas hélices, de forma que tres hélices levógiras se asocian para formar un helicoide dextrógiro.
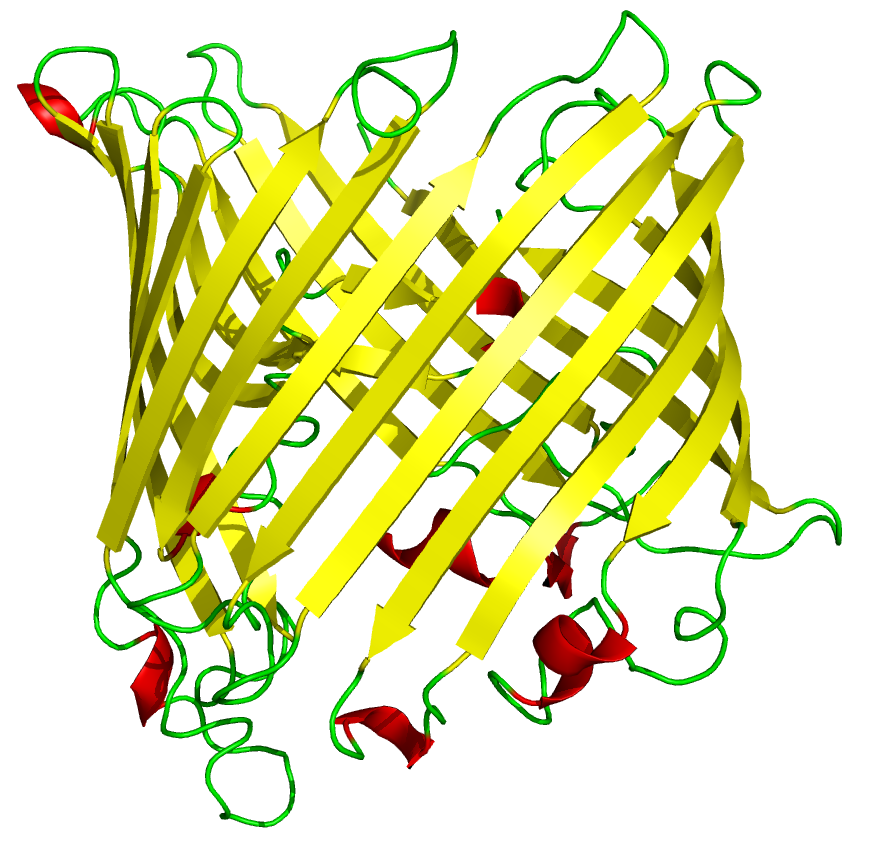
PARA TENER EN CUENTA: A pesar que las proteínas fibrosas tienen un solo tipo de estructura secundaria, las proteínas globulares pueden presentar varios tipos de estructura secundaria de la misma molécula.
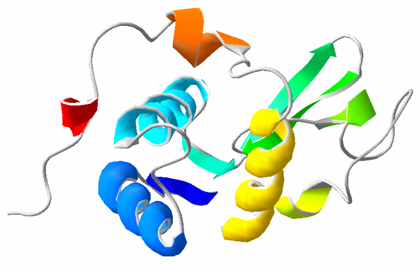
La unión entre los tipos de estructuras secundarias se llaman bucles (2 a 16 aa) y si son muy cortos giros (2 a 3 aa).
5.2. Nivel terciario
ESTRUCTURA TERCIARIA: Es el plegado de las cadenas polipeptídicas en dominios. Se refiere a la estructura tridimensional de la proteína globular entera. Algunos residuos de aa muy alejados en la estructura primaria quedan juntos en la terciaria.
La estructura terciaria de una proteína es la responsable directa de sus propiedades biológicas, ya que la disposición espacial de los distintos grupos funcionales determina su interacción con los diversos ligandos.
Se distinguen dos tipos de estructura terciaria:
• Proteínas con estructura terciaria de tipo fibroso en las que una de las dimensiones es mucho mayor que las otras dos. Son ejemplos el colágeno, la queratina del cabello o la fibroína de la seda, En este caso, los elementos de estructura secundaria (hélices α u hojas β) pueden mantener su ordenamiento sin recurrir a grandes modificaciones, tan sólo introduciendo ligeras torsiones longitudinales, como en las hebras de una cuerda.
• Proteínas con estructura terciaria de tipo globular, más frecuentes, en las que no existe una dimensión que predomine sobre las demás, y su forma es aproximadamente esférica. En este tipo de estructuras se suceden regiones con estructuras al azar, hélice α hoja β, acodamientos y estructuras supersecundarias.
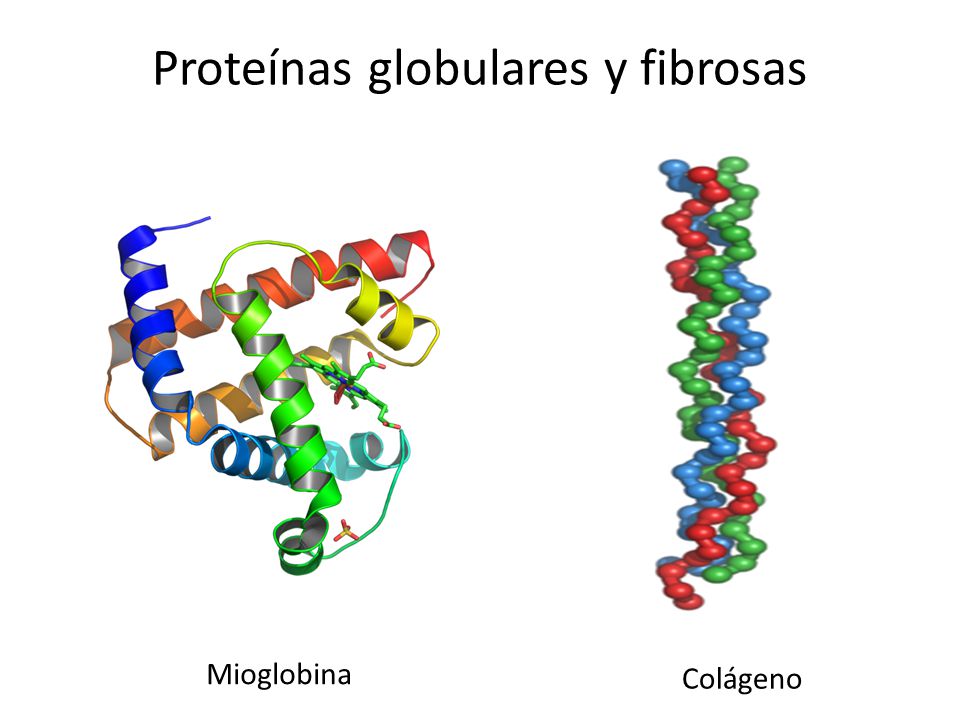
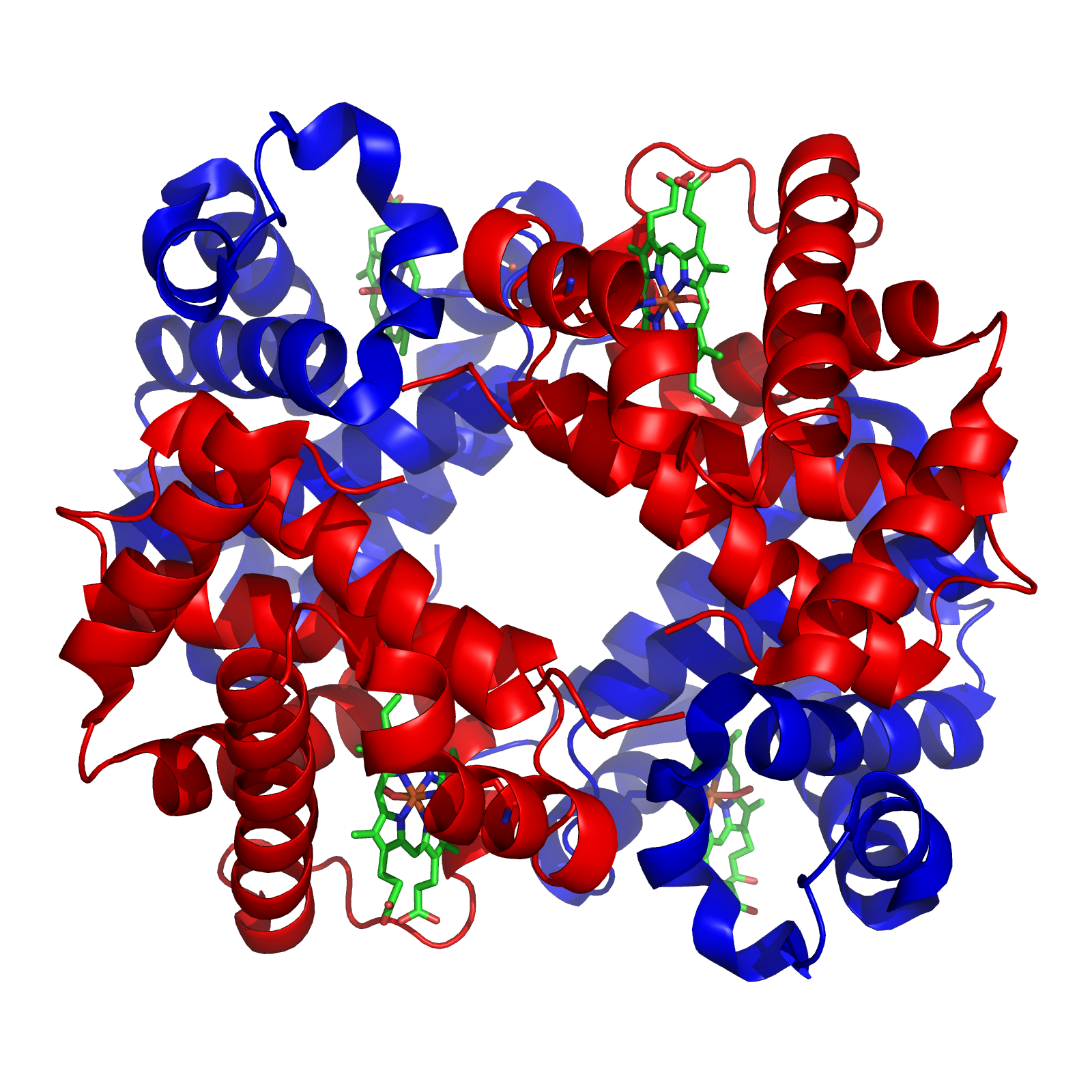
5.3. Nivel cuaternario
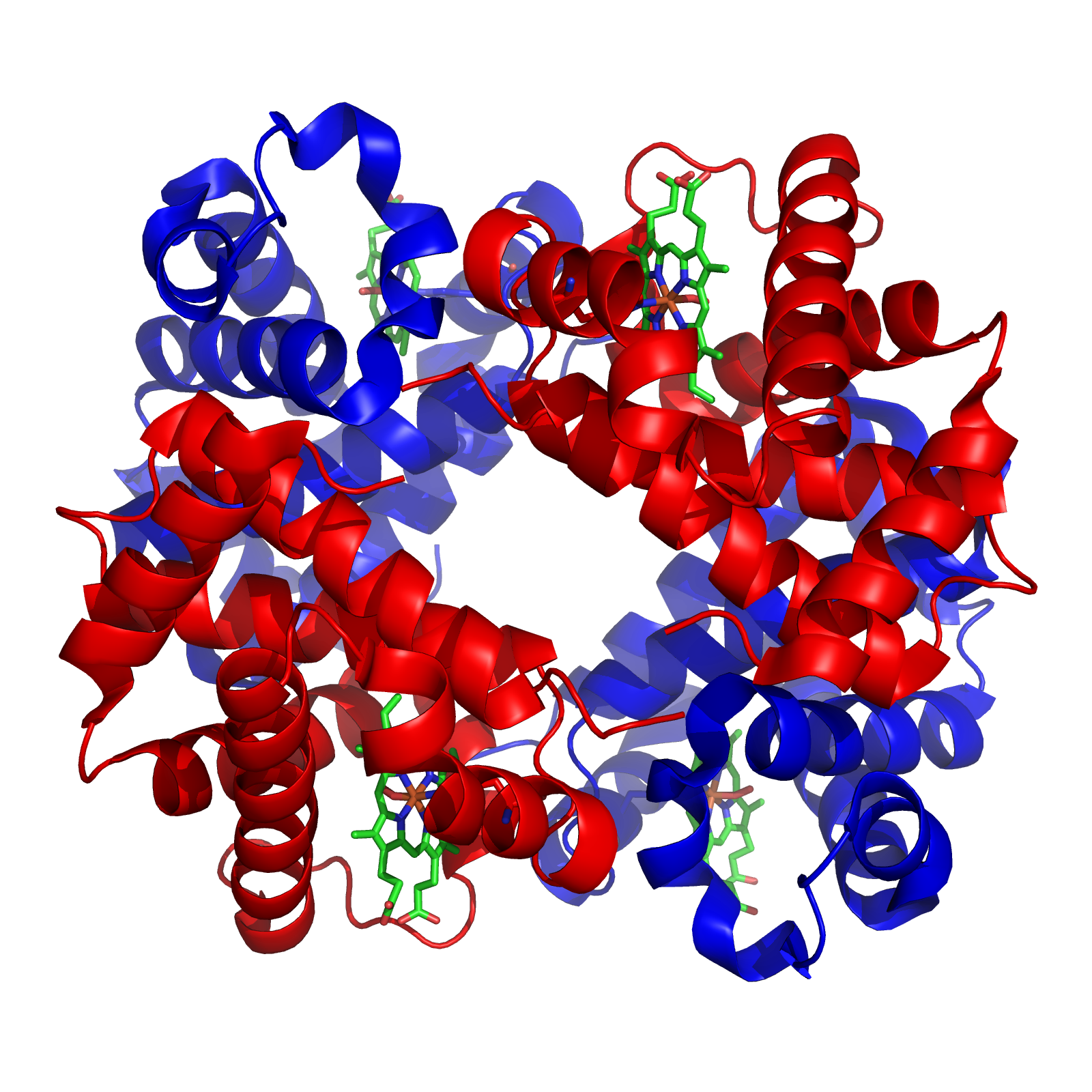
ESTRUCTURA CUATERNARIA: Algunas proteínas la presentan. Se limita a proteínas con múltiples unidades y se refiere a la organización de las mismas. Cada unidad es un polipéptido por separado. Se trata de proteínas oligoméricas. La estructura cuaternaria modula la actividad biológica de la proteína y la separación de las subunidades a menudo conduce a la pérdida de funcionalidad. Las fuerzas que mantienen unidas las distintas cadenas polipeptídicas son, en líneas generales, las mismas que estabilizan la estructura terciaria.
La estructura cuaternaria deriva de la conjunción de varias cadenas peptídicas que, asociadas, conforman un multímero, que posee propiedades distintas a la de sus monómeros componentes.
Por ejemplo la siguiente imagen representa a la hemoglobina.
5.4. En resumen
Observa las siguientes imágenes que representan lo anteriormente analizado en este capítulo.
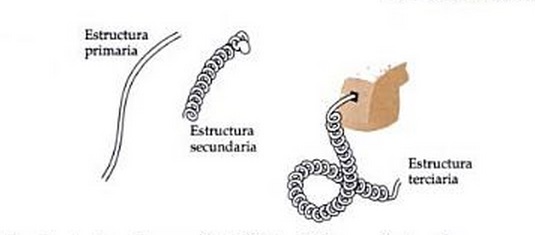
La siguiente imagen es una analogía que puede resultarte útil.
5.5. Aplicación a un ejemplo
La mioglobina es una pequeña proteína de color rojo brillante. Es muy común en las células musculares y en gran medida es la responsable del característico color rojo de la carne. Su trabajo es almacenar el dioxígeno que deberá ser usado en condiciones de trabajo muscular intenso.
La siguiente imagen representa a la mioglobina. Dicha proteína se encuentra formada por una cadena polipeptídica de 153 residuos aminoacídicos.
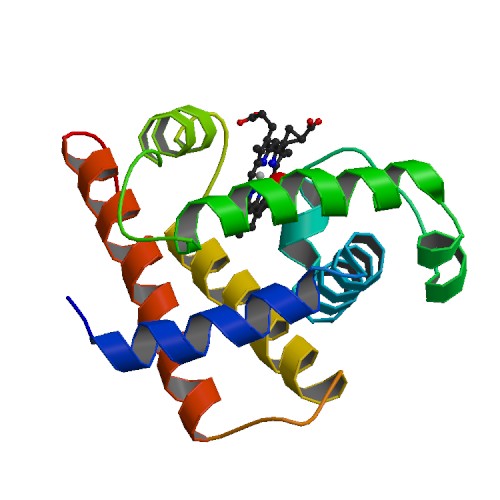
La siguiente imagen detalla aspectos estructurales de la mioglobina:
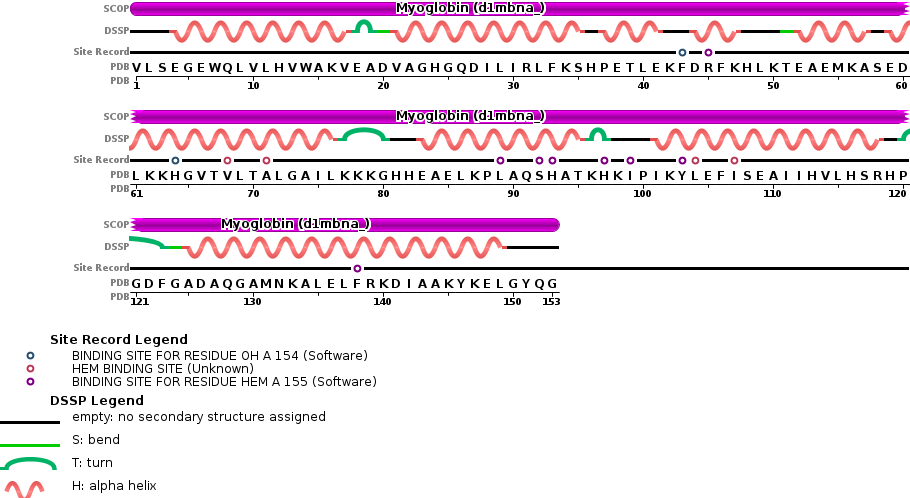
¿Qué niveles estructurales presenta?
- Primaria: 153 residuos aa.
- Secundaria: 9 alfa hélice, también giros y bucles.
- Terciaria: globular (forma esférica).
- Cuaternaria: no presenta (ya que se indica que presenta una sola cadena polipeptídica).
Función: transporte de dioxígeno.
6. Desnaturalización
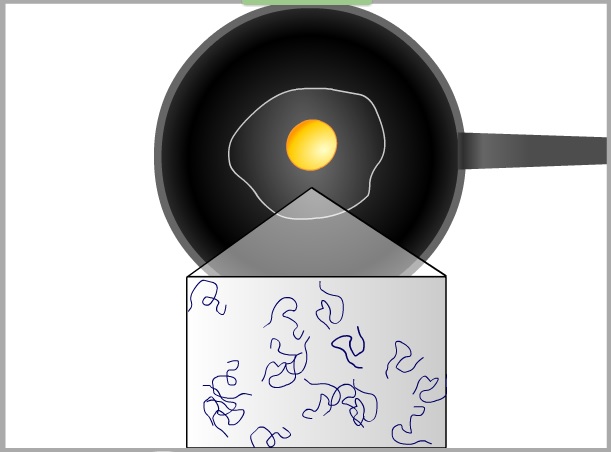
Visita el siguiente recurso para repasar lo que ocurre cuando una proteína se desnaturaliza, por ejemplo cuando cocinamos un huevo.
La forma de las proteínas puede verse afectada por el calor, los ácidos, las sales y la acción mecánica. Este cambio de forma se llama "desnaturalización" (modificación de la estructura natural) y, como consecuencia de este proceso, se producen variaciones en las texturas de las preparaciones. Las proteínas globulares se despliegan, y esto aumenta su afinidad con el agua. El estado final de la desnaturalización es la coagulación, en cuyo transcurso las proteínas se unen unas con otras, adquieren una forma diferente a la nativa y dejan pocos enlaces libres para relacionarse con el medio.
Los agentes desnaturalizantes como el calor, ácidos o bases, agitación, rayos x, oxidación o reducción, sales de metales pesados etc, actúan rompiendo las atracciones interpartícula como los enlaces de hidrógeno y puentes salinos. Desaparece la estructura secundaria, terciaria y cuaternaria, manteniendo el esqueleto covalente de la cadena polipeptídica. Al destruirse la ordenación tridimensional característica de la proteína la o las cadenas polipeptídicas se despliegan o desenrollan originando estructuras al azar.
Al desnaturalizarse la proteína pierde la actividad biológica y casi siempre la proteína coagula.
7. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
A continuación están los créditos por capítulo del libro.
7.1. Capítulo 1
Bibliografía consultada:
- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2012) Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
- Irazoquí, R; Rebollo, C y Soubirón, E. (2012). Primer año de Bachillerato. Química. Un abordaje sustentable. C. Suiza, Uruguay; Correo del Maestro.
- La Química del carbono. Recuperado de: www7.uc.cl/sw_educ/educacion/grecia/plano/html/pdfs/cra/quimica/NM2/RQ2O102.pdf
- Laborde, G. Las analogías como estrategia de enseñanza. Material de apoyo al curso de Didáctica I. Instituto de Profesores "Artigas". Recuperado de: http://www.uruguayeduca.edu.uy/recursos-educativos/1700
- Quintanilla, M., Merino, C. y Daza, S. (2010). Unidades didácticas en Química. Su contribución a la promoción de competencias de pensamiento científico. Volumen 3. Recuperado de: http://www7.uc.cl/sw_educ/educacion/grecia/plano/html/pdfs/destacados/LibroDQuiGrecia.pdf
- Alegría, M.; Franco, R.; Jaul, M. y Morales, E. (2007). Química: Estructura, comportamiento y transformaciones de la materia. Buenos Aires, Argentina: Santillana
Las imágenes utilizadas fueron tomadas de:
- Descriptiva: Corazones| Autor: ArtsyBee | Licencia: CC0 Dominio Público
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/44/Coraz%C3%B3n.svg/840px-Coraz%C3%B3n.svg.png
- https://www.lexercise.com/wp-content/uploads/2016/05/brain-147026_960_720.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/3/36/Adrenalin_-_Adrenaline.svg/1280px-Adrenalin_-_Adrenaline.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/2/2f/Dopamine.svg/2000px-Dopamine.svg.png
- https://commons.wikimedia.org/wiki/File:Serotonin.svg
- https://upload.wikimedia.org/wikipedia/commons/thumb/7/7f/Carbone_lewis.svg/1024px-Carbone_lewis.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/5/56/Methan_Lewis.svg/2000px-Methan_Lewis.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/5/5b/5-%28pentan-3-yl%29nonane.svg/2000px-5-%28pentan-3-yl%29nonane.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/2/2e/Benzene-2D-full.svg/1000px-Benzene-2D-full.svg.png
- https://commons.wikimedia.org/wiki/File:Benzol.svg
- https://cdn.pixabay.com/photo/2014/05/21/14/26/love-349631_960_720.png
- https://upload.wikimedia.org/wikipedia/commons/5/56/Methan_Lewis.svg
- https://upload.wikimedia.org/wikipedia/commons/8/8d/Ethene-2D-flat.png
- https://upload.wikimedia.org/wikipedia/commons/2/28/Ethyne-2D-flat.png
- https://upload.wikimedia.org/wikipedia/commons/3/35/Ethan_Lewis.svg
- https://upload.wikimedia.org/wikipedia/commons/a/a2/Propane-2D-flat.png
- https://upload.wikimedia.org/wikipedia/commons/c/cb/Butan_Lewis.svg
- https://upload.wikimedia.org/wikipedia/commons/5/52/N-Pentan.png
- https://upload.wikimedia.org/wikipedia/commons/5/58/Methane-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/3/3c/Ethane-A-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/e/e4/Propane-3D-balls-B.png/800px-Propane-3D-balls-B.png
- https://upload.wikimedia.org/wikipedia/commons/7/76/Butane-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/8/8a/Pentane-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/f/f7/Hexane-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/Heptane-2D-Skeletal.svg/2000px-Heptane-2D-Skeletal.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/45/Heptane.svg/2000px-Heptane.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/f/fb/Octane-2D-Skeletal.svg/2000px-Octane-2D-Skeletal.svg.png
- https://upload.wikimedia.org/wikipedia/commons/1/1c/Nonane-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/2/27/Heptan.1.svg/800px-Heptan.1.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/8/8d/Ethene-2D-flat.png/514px-Ethene-2D-flat.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/b/b6/Propene-2D-flat.svg/200px-Propene-2D-flat.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/0/03/Butene-2D-flat.png/229px-Butene-2D-flat.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/e/eb/Cis-trans-2-Buten.svg/800px-Cis-trans-2-Buten.svg.png
- https://upload.wikimedia.org/wikipedia/commons/c/c2/Ethylene-CRC-MW-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/b/bf/Propylene-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/5/51/But-1-ene-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/7/7e/Cis-but-2-ene-3D-balls.png/320px-Cis-but-2-ene-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/c/c6/Propylene_skeletal.svg/2000px-Propylene_skeletal.svg.png
- https://upload.wikimedia.org/wikipedia/commons/9/9c/But-1-ene-2D-skeletal.png
- https://upload.wikimedia.org/wikipedia/commons/2/28/Ethyne-2D-flat.png
- https://upload.wikimedia.org/wikipedia/commons/e/ee/Propyne-2D-flat.png
- https://upload.wikimedia.org/wikipedia/commons/a/af/Ethylacetylene.svg
- https://upload.wikimedia.org/wikipedia/commons/thumb/d/d7/Acetylene-2D-skeletal.svg/2000px-Acetylene-2D-skeletal.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/9/98/Propyne-2D-flat-2.svg/2000px-Propyne-2D-flat-2.svg.png
- https://upload.wikimedia.org/wikipedia/commons/9/9d/But-1-yne-2D-skeletal.png
- https://upload.wikimedia.org/wikipedia/commons/4/4d/Dimethylacetylene_skeletal.png
- https://upload.wikimedia.org/wikipedia/commons/8/8b/Acetylene-CRC-IR-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/f/f0/Butyne-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/5/51/2-Butyne-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/a/a4/Propyne-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/d/df/2-penteno.png
- https://upload.wikimedia.org/wikipedia/commons/d/df/4%2C4-Dimethyl-1-pentene.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/2/2e/4-Methyl-1-Pentene.svg/2000px-4-Methyl-1-Pentene.svg.png
- https://upload.wikimedia.org/wikipedia/commons/2/2a/2%2C3-dimetil-2-penteno.png
- https://cdn.pixabay.com/photo/2015/07/08/10/28/octene-835812_960_720.png
- https://upload.wikimedia.org/wikipedia/commons/0/08/1-nonene-chemical-formula-c-9-h-18-skeletal.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/f/f6/1-heptyne_structure.svg/512px-1-heptyne_structure.svg.png
- http://imagenes.montevideo.com.uy/imgnoticias/200909/248260.jpg
- https://upload.wikimedia.org/wikipedia/commons/thumb/9/92/Dado_-_dice.svg/1280px-Dado_-_dice.svg.png
- https://cdn.pixabay.com/photo/2013/07/12/19/18/sticky-note-154504_960_720.png
- Descriptiva: Saturated C4 hydrocarbons ball-and-stick| Autor: Fvasconcellos | Licencia: CC0 Dominio Público
- https://upload.wikimedia.org/wikipedia/commons/c/c4/2-methyl-propane_2.GIF
- https://upload.wikimedia.org/wikipedia/commons/thumb/1/16/Butane-condensed-structural-formulae.png/640px-Butane-condensed-structural-formulae.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/3/3b/Saturated_C4_hydrocarbons_ball-and-stick.png/872px-Saturated_C4_hydrocarbons_ball-and-stick.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/1/1d/Cis_2_butene_AND_trans_2_butene_8199.JPG/171px-Cis_2_butene_AND_trans_2_butene_8199.JPG
- https://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Cis-2-Buten.svg/220px-Cis-2-Buten.svg.png
- http://upload.wikimedia.org/wikipedia/commons/thumb/e/eb/Cis-trans-2-Buten.svg/400px-Cis-trans-2-Buten.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/c/cf/Neopentane-2D.png/320px-Neopentane-2D.png
- https://upload.wikimedia.org/wikipedia/commons/a/ad/Trans-1%2C2-dichloroethene.png
- http://upload.wikimedia.org/wikipedia/commons/thumb/2/2d/Cis-1%2C2-dichloroethene.png/240px-Cis-1%2C2-dichloroethene.png
- https://upload.wikimedia.org/wikipedia/commons/d/df/4%2C4-Dimethyl-1-pentene.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/f/fe/N-heptene_structure.svg/2000px-N-heptene_structure.svg.png
- https://upload.wikimedia.org/wikipedia/commons/f/fe/3-methylpentane.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/3/38/Pentane-2D-Skeletal.svg/2000px-Pentane-2D-Skeletal.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/41/2-methylbutane-2D-skeletal.svg/2000px-2-methylbutane-2D-skeletal.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/45/Heptane.svg/2000px-Heptane.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/3/30/Blausen_0389_EyeAnatomy_02.png/250px-Blausen_0389_EyeAnatomy_02.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/2/23/RetinalCisandTrans.svg/2000px-RetinalCisandTrans.svg.png
- Descriptiva: Etanol el alcohol molécula| Autor: ColiN00B | Licencia: CC0 Dominio Público
- https://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/Aldehyd_-_Aldehyde.svg/1104px-Aldehyd_-_Aldehyde.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/e/e3/Ketone-displayed.png/714px-Ketone-displayed.png
- https://upload.wikimedia.org/wikipedia/commons/b/b5/Carboxylic-acid.svg
- http://grupo-alcoholes.blogspot.com.uy/2011/06/clasificacion-de-los-alcoholes.html
- https://srgerman27.files.wordpress.com/2014/10/alcohol-etanol.gif
- https://upload.wikimedia.org/wikipedia/commons/3/3a/FormEstrCompl.JPG
- https://upload.wikimedia.org/wikipedia/commons/thumb/3/3c/2-methylpentanoic_acid.svg/2000px-2-methylpentanoic_acid.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/9/9f/Aldehyde.png/125px-Aldehyde.png
- http://upload.wikimedia.org/wikipedia/commons/thumb/b/b1/Hydroxy_Group_Structural_Formulae.svg/440px-Hydroxy_Group_Structural_Formulae.svg.png
- http://upload.wikimedia.org/wikipedia/commons/thumb/f/fd/Isopropanol-skeletal.png/300px-Isopropanol-skeletal.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/d/d8/Etil_alkol_yada_Etanol_Birincil_Alkol-.svg/2000px-Etil_alkol_yada_Etanol_Birincil_Alkol-.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/4b/Butanol_flat_structure.png/220px-Butanol_flat_structure.png
- https://upload.wikimedia.org/wikipedia/commons/b/b8/Propanol_flat_structure.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/3/3b/2-hexanol-Line-Structure.svg/800px-2-hexanol-Line-Structure.svg.png
- https://cdn.pixabay.com/photo/2015/07/30/11/02/pentanol-867210_960_720.png
- https://upload.wikimedia.org/wikipedia/commons/4/49/2-Methyl-2-butanol-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/8/8f/Methanol-alternative-3D-balls.png/640px-Methanol-alternative-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/5/5e/Heptanal.png
- https://upload.wikimedia.org/wikipedia/commons/b/b5/Acetone-displayed.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/40/Einfachste_Alkohol_Metanol-Seite001.svg/2000px-Einfachste_Alkohol_Metanol-Seite001.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/f/fb/Acetone-2D-skeletal.svg/2000px-Acetone-2D-skeletal.svg.png
- https://upload.wikimedia.org/wikipedia/commons/0/0a/2-Pentanone-3D-balls.png
- https://upload.wikimedia.org/wikipedia/commons/7/76/Formaldehyde-3D-balls-A.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/b/b8/Propanol_flat_structure.png/640px-Propanol_flat_structure.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/3/32/Propionic_acid_flat_structure.png/640px-Propionic_acid_flat_structure.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/6/62/Essigs%C3%A4ure_-_Acetic_acid.svg/2000px-Essigs%C3%A4ure_-_Acetic_acid.svg.png
- http://3.bp.blogspot.com/-vungH-fkGEI/UGDr5ESbuaI/AAAAAAAAAGw/9UmbKHG0N-4/s1600/ejercicio+3.jpg
- https://images-eu.ssl-images-amazon.com/images/I/71zw1c83LzL._AC_US200_.png
Materiales elaborados por los Profesores Anarella Gatto, Melody García, y Sebastián Mendieta. PORTAL URUGUAY EDUCA - 2017
7.2. Capítulo 2
Bibliografía consultada:
- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2012) Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
7.3. Capítulo 3
Bibliografía consultada:
- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2012) Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
- Alegría, Mónica y otros. (1999). Química II. Argentina: Santillana
Vídeos, páginas y/o simuladores utilizados:
Aldo Neñer (2011, 29 de mayo). Proteinas [Archivo de vídeo]. Recuperado de: https://youtu.be/_xxDqknxZro?list=PL4392AB16E065A654- González, J. (s.f.). Curso de Biomoléculas. Clasificación de las proteínas. Recuperado de; http://www.ehu.eus/biomoleculas/proteinas/prot1.htm
Las imágenes utilizadas fueron tomadas de:
- http://hemoglobina.net/files/img/hemoglobina.jpg
7.4. Capítulo 4
Bibliografía consultada:
- Lehninger y otros.
(2005) Principios de Bioquímica. Omega.
- Alegría, Mónica y otros. (1999). Química II. Argentina: Santillana
Vídeos, páginas y/o simuladores utilizados:
KhanAcademyEspanol. - Simulador de formación del enlace peptídico. Recuperado de: https://cienciascondgerman.wikispaces.com/file/view/11+Peptidico.swf
Las imágenes utilizadas fueron tomadas de:
- https://upload.wikimedia.org/wikipedia/commons/0/0e/Aminoacido.jpg
- http://upload.wikimedia.org/wikipedia/commons/4/46/L-D-Alanin.jpg
- http://www.bionova.org.es/biocast/documentos/figura/figtem08/figurat0805.jpg
- https://lidiaconlaquimica.files.wordpress.com/2015/07/proteinas-12-peprtido.gif
- http://4.bp.blogspot.com/-mtrDY0PaVm8/Vlx6J_RZezI/AAAAAAAACs4/moBByGkEse4/s1600/7259258986_d91179762f.jpg
7.5. Capítulos 5 y 6
Bibliografía consultada:
- Lehninger y otros. (2005). Principios de Bioquímica. Omega.
- Alegría, Mónica y otros. (1999). Química II. Argentina: Santillana
- Luque, V. Estructura y propiedades de las proteínas. Recuperado de: https://www.uv.es/tunon/pdf_doc/proteinas_09.pdf
- Koppmann, M (2011). Manual de Gastronomía Molecular. (2da Edición). Buenos Aires, Argentina: Siglo Veintiuno
Vídeos, páginas y/o simuladores utilizados:
RCSBProteinDataBank. ( - Simulador de desnaturalización. Porto, A. http://www.bionova.org.es/. Recuperado de: http://www.bionova.org.es/animbio/anim/dnareplicacion/menu.swf
- Protein Data Bank. 1MBN. The stereochemistry of the protein myoglobin. doi: 10.2210/pdb1MBN/pdb. Recuperado de: https://www.rcsb.org/structure/1MBN
Las imágenes utilizadas fueron tomadas de:
- https://www.wikidoc.org/images/b/bd/Insulin_glargine07.png
- https://upload.wikimedia.org/wikipedia/commons/9/96/AlphaHelixProtein_fr.jpg
- https://userscontent2.emaze.com/images/aef3244a-d7f3-4f67-a6be-57dddd005448/6332082dc71c0e81cb96eed0dacffd92.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/f/fb/Sucrose_porin_1a0s.png/250px-Sucrose_porin_1a0s.png
- https://www.thefamousbirthdays.com/photo/commons/d/d1/wk_37589_25399_large.jpg
- https://i.blogs.es/ebd1f9/lisozima/450_1000.png
- https://tiposde.com.mx/wp-content/uploads/2017/11/Globulares-y-fibrosas.jpg
- http://nextews.com/images/46/a2/46a264e654da0e42_354x242.jpg
- https://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/Main_protein_structure_levels_cs.svg/2000px-Main_protein_structure_levels_cs.svg.png
- Tomada de: Hill, J y Kolb, D. (1999). Química para el nuevo milenio. (8va Edición). México: Prentice Hall.
- Captura de pantalla del simulador de desnaturalización. Porto, A. http://www.bionova.org.es/. Recuperado de: http://www.bionova.org.es/animbio/anim/dnareplicacion/menu.swf
- Protein Data Bank. 1MBN. The stereochemistry of the protein myoglobin. doi: 10.2210/pdb1MBN/pdb. Recuperado de: https://www.rcsb.org/structure/1MBN