Material de apoyo
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Formato rejilla |
| Libro: | Material de apoyo |
| Imprimido por: | Invitado |
| Día: | lunes, 7 de abril de 2025, 12:45 |
1. Procedimiento
- A- ¿Cómo se pueden obtener y reconocer las
proteínas presentes en cada una de las distintas muestras?
PREPARACIÓN DE LA SOLUCIÓN DE OVOALBÚMINA
1. Separar la clara del huevo en un vaso de bohemia, agregar 100,0 mL de agua y agitar con varilla.
2. Filtrar la solución hacia otro vaso de bohemia, trabajar con la solución filtrada.
EXTRACCIÓN DE LA CASEÍNA
1. Colocar en un vaso de bohemia 40,0 mL de leche descremada y calentar hasta 40,0 ºC con agitación constante.
2. Agregar gota a gota de ácido etanoico (también llamado acético) 2,0 mol/L hasta precipitación total. Separar la caseína con ayuda de una media de nylon que ya no uses.
3. Lavar dos veces con etanol en un vidrio reloj y secar.
4. Realizar el ensayo de biuret para reconocer su naturaleza proteica.
5. Probar con otras muestras con las que también se cuente.
|
Reacciones de coloración a baja temperatura |
OBSERVACIONES |
|
||||
|
Muestra 1 |
Muestra 2 |
Muestra 3 |
Muestra 4 |
Muestra 5 |
||
|
Reacción de biuret: Agregar gotas de solución de sulfato de cobre (II) y solución de hidróxido de sodio |
|
|
|
|
|
|
|
Reconoce: |
|
|
||||
|
Positivo: |
|
|
|
|
|
|
Observa el vídeo (activa los subtítulos en español):
1.1. Parte B
B- Reacciones de precipitación:
Colocar en 4 tubos de ensayo 1,0 mL de la solución de ovoalbúmina y realizar cada uno de los siguientes ensayos, anotar observaciones.
|
Reacciones de precipitación |
Muestra: |
|
OBSERVACIONES |
|
|
Calentar el contenido del tubo de ensayo durante unos minutos |
|
|
Agregar gotas de ácido clorhídrico concentrado |
|
|
Agregar unos mL de etanol |
|
|
Agregar gotas de cloruro de mercurio (II) |
|
Observa el siguiente vídeo:
1.2. Parte C
Reacciones de coloración a alta temperatura:
Colocar en 3 tubos de ensayo 1,0 mL de la solución de ovoalbúmina o un trocito de caseína extraída y realizar cada uno de los siguientes ensayos, anotar observaciones.
|
Reacciones de coloración a alta temperatura |
RECONOCE |
POSITIVO |
OBSERVACIONES |
|
Reacción xantroproteica: Agregar gotas de ácido nítrico, calentar |
|
|
|
|
Reacción de Millon: Agregar gotas de Reactivo de Millon y calentar |
|
|
|
|
Reacción acetato de plomo: Agregar gotas de acetato de plomo (10 gotas al 5 %) e hidróxido de sodio (2 mL al 20 %), calentar. |
|
|
|
Observa los siguientes vídeos:
2. Post Lab
Reacciones de coloración:
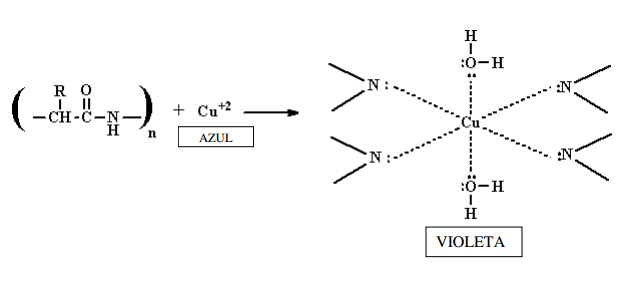
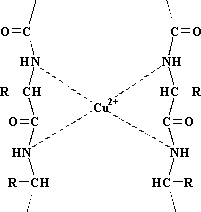
- Reacción de Biuret: Permite
caracterizar la unión peptídica y por lo tanto la dan todas las proteínas. El
par de electrones no compartidos que posee el nitrógeno, le permite unirse a
átomos o iones. El ion Cu2+se coordina con los nitrógenos del enlace
peptídico formando un ion complejo coloreado, cuyo color puede ir desde el azul
al violeta.
- Reacción
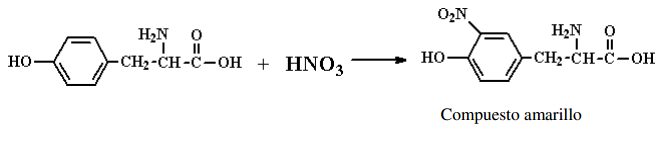
xantoproteica: El agregado
de HNO3 a una proteína sirve para caracterizar la presencia de
aminoácidos con grupos aromáticos, ya que la nitración de los grupos aromáticos
se observa por su coloración amarilla característica. Algunos de los aa que
presentan grupo aromático son: la fenilalanina, la tirosina y el triptófano.
Esta reacción es la que se produce en la piel cuando se moja con ácido nítrico.
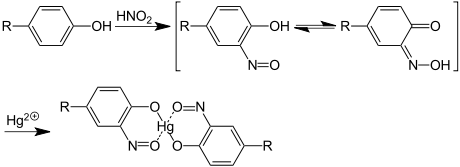
- Reacción de Millon: El reactivo es una solución de nitrato de mercurio en medio ácido. Esta reacción es característica de aminoácidos con grupos fenólicos, como por ejemplo la tirosina, dando lugar a un color rosado carne
- Reacción de aminoácidos azufrados: Se pone de manifiesto por la formación de un precipitado negruzco de sulfuro de plomo (II). Se basa esta reacción en la separación mediante un álcali, del azufre de los aminoácidos (metionina, cisteína), el cual al reaccionar con una solución de acetato de plomo (II), forma el sulfuro de plomo (II).
2.1. Desnaturalización
La forma de las proteínas puede verse afectada por el calor, los ácidos, las sales y la acción mecánica. Este cambio de forma se llama "desnaturalización" (modificación de la estructura natural) y, como consecuencia de este proceso, se producen variaciones en las texturas de las preparaciones. Las proteínas globulares se despliegan, y esto aumenta su afinidad con el agua. El estado final de la desnaturalización es la coagulación, en cuyo transcurso las proteínas se unen unas con otras, adquieren una forma diferente a la nativa y dejan pocos enlaces libres para relacionarse con el medio.
Los agentes desnaturalizantes como el calor, ácidos o bases, agitación, rayos x, oxidación o reducción, sales de metales pesados etc, actúan rompiendo las atracciones interpartícula como los enlaces de hidrógeno y puentes salinos. Desaparece la estructura secundaria, terciaria y cuaternaria, manteniendo el esqueleto covalente de la cadena polipeptídica. Al destruirse la ordenación tridimensional característica de la proteína la o las cadenas polipeptídicas se despliegan o desenrollan originando estructuras al azar.
Al desnaturalizarse la proteína pierde la actividad biológica y casi siempre la proteína coagula.
Reacciones de desnaturalización y coagulación:
- Calor: El calor hace que las moléculas vibren demasiado violentamente rompiendo enlaces de hidrógeno y puentes salinos. Provocando la desnaturalización y coagulación de la ovoalbúmina (como cuando cocinamos un huevo). Este método se emplea, muy a menudo, para investigar la presencia de albúmina en la orina.
- Alcohol:
Precipita
la ovoalbúmina, en seguida de agregado el alcohol la desnaturaliza por
deshidratación de la micela.
¿Qué ocurre cuando utilizamos alcohol o alcohol en gel como desinfectante? Se utilizan como desinfectantes (destrucción de microorganismos en objetos) y como antisépticos (destrucción de microorganismos en la piel). Mecanismo de acción: deshidratan al microorganismo, lesionan la membrana celular tornando a los lípidos que la componen más solubles en agua, y producen precipitación y desnaturalización de proteínas. La precipitación y desnaturalización de proteínas depende de la presencia de agua y materia orgánica. El alcohol etílico rectificado (95 %) provoca gran deshidratación en los microorganismos, de manera que impide su penetración en los mismos. Por lo tanto, las concentraciones más efectivas son las que oscilan entre el 60 % y 80 % en agua destilada, siendo la preparación más efectiva al 70 %. Concentraciones por debajo del 50 % no causan ningún efecto. La materia orgánica inactiva los alcoholes, por lo que se recomienda limpiar la superficie antes de desinfectar con alcohol. Las lesiones en la membrana celular se deben a que el alcohol penetra en la región hidrocarbonada, desorganizando la estructura lipídica.
- Ácidos fuertes:
Coagulan la ovoalbúmina. Si se agrega un exceso de
ácido, el coágulo se disuelve con la formación de sintoninas o ácido-albúminas.
Cuando se quema una porción de la piel, uno de los problemas graves es la
pérdida de agua. Las proteínas de la superficie de la piel se desnaturalizan y
coagulan, la corteza actúa entonces inhibiendo esta pérdida. Estos reactivos
pueden afectar tanto a los puentes salinos como a los enlaces de hidrógeno.
- Metales pesados: Rompen puentes salinos, formándose nuevos puentes con las sales de los iones pesados, de esta forma la proteína se desnaturaliza y coagula. Ingerir sales de metales pesados es muy peligroso, debido a que estos iones metálicos producen un tremendo caos entre las proteínas del organismo. Sobre todo las enzimas. Cuando estas sales se toman por accidente se pueden evitar que sus iones lleguen a la circulación general, haciéndolas precipitar en el estómago. Para ello la persona debe ingerir inmediatamente leche o clara de huevo. Los iones de los metales pesados desnaturalizan estas proteínas y quedan apresados en la masa coagulada. A continuación debe obligarse a la persona a que vomite para eliminar ese material del estómago; de otra manera los jugos digestivos comenzarían a trabajar y terminarían por liberar los iones venenosos.
3. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Protocolo elaborado por Sala de Química del Liceo Nº 2 de Pando
- Post Lab elaborado por Sala de Química del Liceo El Pinar
- Koppmann, M (2011). Manual de Gastronomía Molecular. (2da Edición) Buenos Aires, Argentina: Siglo Veintiuno
- Vignoli, R. Esterilización, desinfección y antisepsia. Recuperado de: http://www.higiene.edu.uy/cefa/2008/esterilizacionydesinfeccion.pdf
- Lozano, J. Laboratorio de Química Orgánica. Guía nº 9: Ensayos para reconocimiento de aminoácidos. Recuperado de: http://avalon.utadeo.edu.co/comunidades/estudiantes/ciencias_basicas/organica/guia_9_aminoacidos.pdf
- Simulador de desnaturalización. Porto, A. http://www.bionova.org.es/. Recuperado de: http://www.bionova.org.es/animbio/anim/proteodesnat.swf
- Proteínas. Escuela Europea de Luxemburgo. Sección española. Bio 4. Recuperado de: http://www.euroschool.lu/prof.montilla/ficheroactivi/actividadesbio4_6/PPROTEINAS
Vídeos, páginas y/o simuladores utilizados:
JamJarMMX. (2012, 10 de abril). Biuret Test for Protein. [Archivo de vídeo]. Recuperado de: https://youtu.be/ufec89A47uMVideotutoriales Informática Educativa CEEA Erasmus Videotutoriales Informática Educativa Amrita Vlab Videotutoriales Informática Educativa . (2016, 13 de diciembre). Identificación de Aminoácidos Azufrados. [Archivo de vídeo]. Recuperado de: https://youtu.be/sQ6jn0lR5EM
Las imágenes utilizadas fueron tomadas de:
- http://3.bp.blogspot.com/-CAI7FO-Ojh0/UUcx88WnAKI/AAAAAAAAAdg/jtv2C8tp23E/s1600/Complejo+Cu+urea.png
- http://3.bp.blogspot.com/-WqD4ZZ6KXqA/U5Ei58ahimI/AAAAAAAAAAo/NtGQjEwVhiw/s1600/2.png
- http://3.bp.blogspot.com/-qmQD74UDlkU/T8v8sA5h8aI/AAAAAAAAAAs/rkiYWb5X5PY/s1600/Sin+t%C3%ADtulo+1.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/d/d7/Millon_Reaction_Principle_V.1.svg/460px-Millon_Reaction_Principle_V.1.svg.png