Material de apoyo
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Formato rejilla |
| Libro: | Material de apoyo |
| Imprimido por: | Invitado |
| Día: | viernes, 4 de abril de 2025, 00:48 |
1. Actividad 1: Síntesis de una jabón de coco y análisis de sus propiedades
a) Obtención del jabón de coco glicerinado
- Medir 50,0 mL de solución hidroalcóholica de NaOH y verter en recipiente esmaltado.
- Calentar suavemente hasta entibiar.
- Medir 40,0 mL de aceite de coco y agregarlo lentamente en el recipiente agitando con varilla.
- Seguir calentando suavemente y agitando hasta que se forme una pasta.
- Retirar del calentador, sacar el jabón del recipiente mediante una espátula y colocarlo en molde.
- Preparar solución acuosa con el jabón obtenido.
b) Acción emulsionante del jabón:
- Agregar a un tubo con 3,0 mL de solución jabonosa y 2 gotas de aceite
- Agitar y observar.
- Colocar en un tubo de ensayo 3,0 mL de H2O y adicionar 2 gotas de aceite
- Agitar y observar.
c) Acción detergente
- Colocar en un tubo de ensayo 3,0 mL de solución jabonosa y en otro 3,0 mL de agua.
- Agregar a cada tubo una pizca de dióxido de manganeso y agitar fuertemente.
- Filtrar el contenido de cada tubo por separado y observar.


- Colocar en un vaso de bohemia 20,0 mL de solución jabonosa y en otro 20,0 mL de agua.
- Espolvorear en ambos una pequeña cantidad de azufre en polvo. Observar.




2. Actividad 2: Estudio de los glúcidos
a. Estudio de las propiedades diferentes azúcares
- Preparación de Reactivo de Fehling: Este reactivo se lo prepara en el momento de usar ya que es inestable. Colocar en cada tubo de ensayo volúmenes iguales (10 gotas c/u) de solución de Fehling A y Fehling B. Calentar hasta ebullición, si el color azul intenso se mantiene el reactivo se encuentra en buenas condiciones.
- Agregar al Reactivo de Fehling a una punta de espátula de cada azúcar sólida.
- Calentar a ebullición.
|
Azúcar |
Reactivo de Fehling |
|
Glucosa |
|
|
Fructosa |
|
|
Sacarosa |
|
|
Maltosa |
|
|
Lactosa |
|
ATENCIÓN: El resultado observado en el vídeo para la maltosa no es correcto, ya que debió dar positivo porque es un glúcido reductor.
b. Reconocimiento de azúcares reductores con el Reactivo de Tollens
El reactivo de Tollens se prepara en el momento de usar ya que es inestable.
- Colocar en un tubo de ensayo 3 mL solución de nitrato de plata (AgNO3) y agregar una gota de solución de hidróxido de sodio al 10%. Se forma un precipitado negro.
- Posteriormente se agrega gota a gota de solución de amoníaco (NH3) hasta disolución total del precipitado. Ya quedó preparado el reactivo.
- Agregar un volumen igual de solución de glucosa al 10%. Calentar suavemente y observar.
c. Hidrólisis de la sacarosa
- Colocar en matraz Erlenmeyer 1 punta de espátula de sacarosa, agregar agua y disolver.
- Añadir 2 gotas de HCl cc.
- Calentar a la llama del mechero durante unos 5 minutos.
- Dejar enfriar y neutralizar añadiendo solución de hidróxido de sodio. (Comprobar presencia de medio básico)
- Realizar la prueba de Fehling como se indica en la parte A.
- Observar y anotar los resultados.
|
Glúcido |
Reactivo de Fehling |
|
Sacarosa |
|
|
Productos de la hidrólisis |
|
d. Reconocimiento de almidón
- Colocar en un tubo un poco de solución de almidón y agregar unas gotas de tintura de yodo. Observar la coloración.
- Sobre cada alimento agregar unas gotas de tintura de yodo. Anotar observación.
|
Alimento |
Coloración con el agregado de tintura de iodo |
|
|
|
|
|
|
3. Post Lab
- SÍNTESIS DEL JABÓN
El aceite de coco está formado por TG en un gran porcentaje por los ácidos grasos láurico, mirístico y palmítico (ácidos grasos saturados, lo que explica que gran parte del año a temperatura ambiente el aceite de coco se encuentre sólido).
Al saponificarlo con solución hidroalchólica de hidróxido de sodio se formarán las siguientes sales (principalmente):
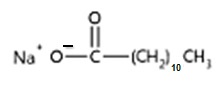
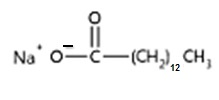
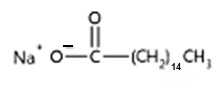
Laurato de sodio / Miristato de sodio / Palmitato de sodio
El jabón de coco obtenido es glicerinado porque no se le quita la glicerina en el proceso. Comercialmente la glicerina es extraída y se vende como jabón a parte.
- ACCIÓN EMULSIONANTE:
La molécula de jabón tiene una parte hidrofílica (afín por el agua) y una parte hidrofóbica (repele el agua). Si se agita un aceite con una solución jabonosa, el aceite se dispersa en pequeñas gotitas y se forma una emulsión. Cada gotita de aceite tiene una película superficial de moléculas de jabón con los grupos con carga negativa hacia la fase acuosa y la porción hidrofóbica en el interior de la gota de aceite. La carga negativa de la partícula impide que se junten estabilizando así la emulsión.
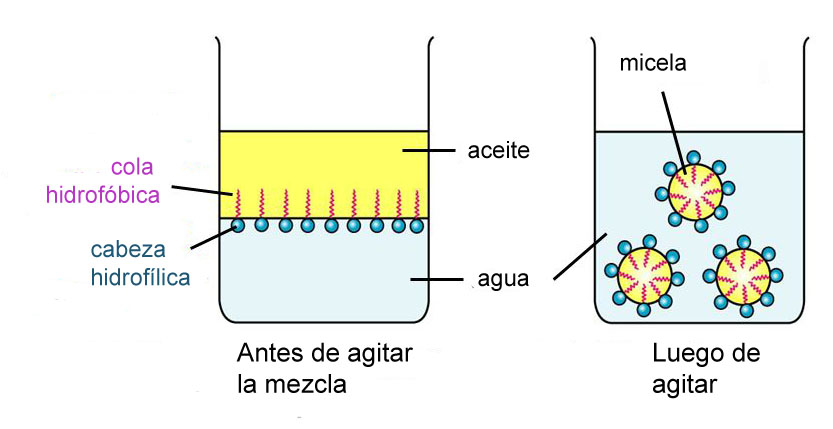
Este principio lo aprovechamos cuando queremos quitar una mancha grasosa de una prenda por ejemplo.
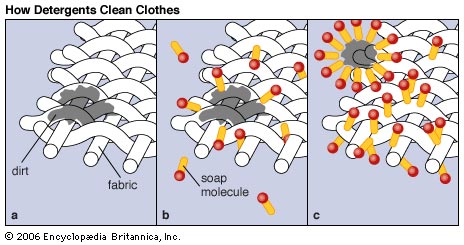
- ACCIÓN DETERGENTE y EFECTO SOBRE LA TENSIÓN SUPERFICIAL DEL AGUA:
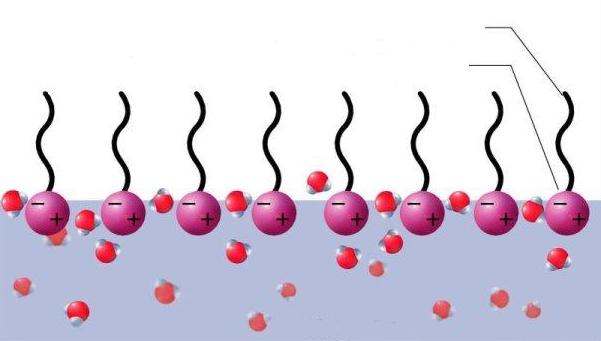
Una propiedad importante de los jabones es su facultad de disminuir la tensión superficial del agua, por consiguiente una solución jabonosa moja mejor que el agua pura. Se dice que el jabón es un agente humectante o tensoactivo.
Este fenómeno proviene del hecho de que una superficie acuosa la parte hidrofílica de la molécula de jabón se "sumerge" bajo la superficie, mientras que la parte hidrofóbica, se orienta hacia el exterior, hacia el aire. Estos cambios en la superficie disminuyen la tensión superficial del agua. Este poder humectante explica la separación de las partículas de dióxido de manganeso (MnO2), haciéndolas tan pequeñas que pueden atravesar los poros del papel de filtro. El poder humectante por la disminución de la tensión superficial es la primera etapa de la acción de limpieza del jabón ya que permite que el agua se "meta" entre las fibras de la ropa.
3.1. Estudio de los glúcidos
PODER REDUCTOR DE LOS GLÚCIDOS:
- Reactivo de Fehling
Los monosacáridos pueden ser oxidados por agentes relativamente suaves como los iones férrico (Fe3+) y cúprico (Cu2+). En estas reacciones el carbono carbonílico se oxida a ácido carboxílico. Estos glúcidos capaces de reducir iones férricos o cúpricos se llaman REDUCTORES.
La siguiente expresión representa lo que está ocurriendo en el caso de que el glúcido sea reductor (ensayo positivo):
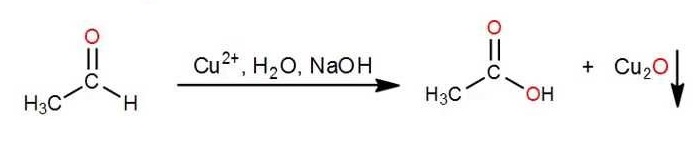
El óxido de cobre (I) - Cu2O- formado es de color ladrillo.
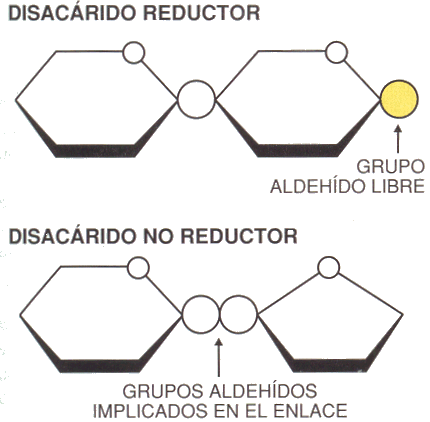
En el caso de los disacáridos, el extremo de la cadena que contiene el carbono anomérico libre (que no forma parte del enlace glucosídico) se conoce como el extremo reductor de la cadena. Los enlaces glucosídicos se hidrolizan con facilidad por acción de ácidos (pero son resistentes a la hidrólisis básica).
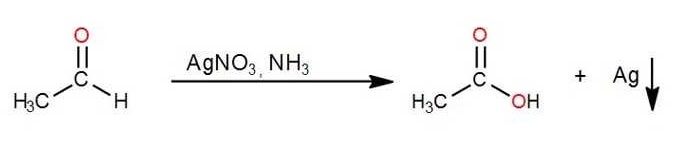
- Reactivo de Tollens:
También se puede analizar el poder reductor de los glúcidos con el reactivo de Tollens. En el caso de que la reacción sea positiva se observa un espejo de plata metálica en las paredes del recipiente (Ag).
La siguiente expresión representa lo que ocurre:
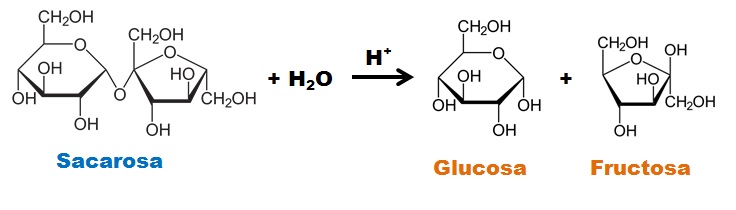
HIDRÓLISIS DE LA SACAROSA:
La sacarosa es un disacárido no reductor ya que ambos carbonos anoméricos (presentan el grupo carbonilo) se encuentran formando parte del enlace glucosídico. En medio ácido la sacarosa se hidroliza, formando glucosa y fructosa. Tanto la glucosa como la fructosa son monosacáridos reductores.
Al estudiar el poder reductor de la sacarosa el resultado es negativo (color azul), pero los productos de su hidrólisis dan positivo al test de Fehling, observándose un color ladrillo.
RECONOCIMIENTO DE ALMIDÓN:
En términos generales, los almidones contienen aproximadamente 17-27% de amilosa, y el resto de amilopectina. El yodo reacciona con la amilosa y genera un fuerte color azul característico debido al complejo que se establece entre una molécula de éste con cada 7-8 glucosas; para desarrollar adecuadamente la coloración se requiere un mínimo de 40 residuos de monosacárido, las cadenas muy cortas de amilosa, en lugar de azul producen un color rojo. Aparentemente el complejo amilosa-yodo se establece por la inclusión del I2 en la hélice, mecanismo semejante al que se observa en los monoglicéridos que se usan en la elaboración del pan. Por otra parte, la amilopectina sólo forma complejos con una pequeña cantidad de I2 y desarrolla una coloración roja.
4. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Protocolo elaborado por Sala de Química del Liceo Nº 2 de Pando
- Post Lab elaborado por Sala de Química del Liceo Nº 1 de Rivera
- Badui, S. (2006). Química de los alimentos. (Cuarta edición). México: Pearson.
- Lehninger y otros. (2005). Principios de Bioquímica. Omega.
Vídeos, páginas y/o simuladores utilizados:
amritacreate . (2015, abril 16). Saponification : The process of Making Soap - MeitY OLabs. [Archivo de vídeo]. Recuperado de: https://youtu.be/VmQV3Qs9Qzkfq-experimentos Ruben Sebastian. (2014, marzo 16). Experimento casero: tensión superficial del agua. [Archivo de vídeo]. Recuperado de: https://youtu.be/gJkyHNG9Mdc Videotutoriales Informática Educativa . (2017, enero 12). Prueba de Fehling. [Archivo de vídeo]. Recuperado de: https://youtu.be/kKkoyRBBUBYkoen2all . (2013, marzo 14). Chemistry experiment 16 - Silver mirror. [Archivo de vídeo]. Recuperado de: https://youtu.be/biV1tzpUAwUviuisomriu . (2011, octubre 30). Hidrolisis de la sacarosa. [Archivo de vídeo]. Recuperado de: https://youtu.be/rQd4ODSjnd0Videotutoriales Informática Educativa . (2016, diciembre 13). Reacción de Lugol. [Archivo de vídeo]. Recuperado de: https://youtu.be/NIxsxbphsKEEmilJimenezTV . (2017, abril 9). Experimento para identificar almidón en los alimentos. [Archivo de vídeo]. Recuperado de: https://youtu.be/dqn-JQC3MLk
Las imágenes utilizadas fueron tomadas de:
- http://4.bp.blogspot.com/-jcXqNx4ZkXQ/VjNwBAf7aGI/AAAAAAAAAIY/IxrE4bbuZEM/s1600/11692977_1055526461142990_666005898_n.jpg
- http://2.bp.blogspot.com/-AHuMeHv00M8/VjNwi-oRsTI/AAAAAAAAAIg/ycvxwuI1WVs/s1600/11720544_1055526501142986_1572379750_n.jpg
- http://4.bp.blogspot.com/-MMYYE1NaFz8/VjNrWl-5z7I/AAAAAAAAAH0/wxUHrDGFplI/s1600/11655429_1055526297809673_1166934050_n.jpg
- http://1.bp.blogspot.com/-QBArOMeYGtw/VjNr7sR1VzI/AAAAAAAAAH8/7TlHN67vHv4/s1600/11655201_1055526351143001_844107379_n.jpg
- http://1.bp.blogspot.com/-J_IF-94jCMw/VjNuq-KUPOI/AAAAAAAAAII/VZtGhRDFOhI/s1600/11714402_1055526307809672_1998276948_n.jpg
- http://3.bp.blogspot.com/-cuH9vNsnAkA/VZ2oZ8wZF_I/AAAAAAAAAC0/fEN2iq46VOA/s1600/dddd.jpg
- https://3.bp.blogspot.com/-QXTeS1bhqGg/WAqoWK5UDlI/AAAAAAAAANs/ochdpHtO1YM4oSoiguogBgRV3LD18ROiACLcB/s1600/agua-aceite-detergente.jpg
- https://media1.britannica.com/eb-media/71/94571-036-7DE8ED64.jpg
- https://upload.wikimedia.org/wikipedia/commons/0/03/Surfactant.jpg
- https://1.bp.blogspot.com/-nS5AuuWdfWA/Vuo8NrzoJHI/AAAAAAAAAXk/uUh-kImxBO4scPPAdM1IqeBs1FurqpwfA/s1600/alcoholes%2B19.jpg
- https://www.um.es/molecula/gragluci/reduce.gif
- https://upload.wikimedia.org/wikipedia/commons/thumb/1/1a/Saccharose2.svg/220px-Saccharose2.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/c/c6/Alpha-D-Glucopyranose.svg/157px-Alpha-D-Glucopyranose.svg.png
- https://upload.wikimedia.org/wikipedia/commons/thumb/6/67/Beta-D-Fructofuranose.svg/179px-Beta-D-Fructofuranose.svg.png
- http://upload.wikimedia.org/wikipedia/commons/7/7f/IodineStarch_en.svg