Material de lectura
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Formato rejilla |
| Libro: | Material de lectura |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:57 |
Tabla de contenidos
1. Repasando algunos conceptos base
- ¿Qué es la cantidad química?
Todas las muestras de sustancias tienen propiedades comunes que son medibles, y constituyen magnitudes físicas. Estas muestras de sustancias tienen la propiedad de ser atraídas por el campo gravitatorio de la tierra, y de ofrecer determinada resistencia a modificar su estado de reposo o movimiento. Esto se define como la magnitud física masa, cuyo símbolo es m y cuya unidad es el kilogramo en el Sistema Internacional de Unidades (SI).
Una magnitud que muchas veces usamos en Química es la cantidad química, cuyo símbolo es n y su unidad es el mol en el SI.
El mol, se define como "la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos de carbono hay en 0,012 kg de carbono-12" (IUPAC 1967, BOE de 3-11-1989).
La expresión "entidades elementales" refiere a átomos, moléculas, iones, electrones u otras partículas con dimensiones del orden ultramicroscópico.
El número de átomos que hay en 12 g de carbono puro es 6,02 x 1023. Este número se conoce como Constante de Avogadro, en honor al científico italiano Amadeo Avogadro. Este número es muy grande pues corresponde a 602.000 trillones.
- Masa Molar:
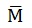
La cantidad química (n) y la masa (m) de una sustancia, se relacionan a través de la masa molar.
Es importante tener en cuenta que por definición, la Masa Molar de un elemento es la masa de un mol del mismo expresada en gramos y la unidad es g/mol.
Para poder saber la Masa Molar de un compuesto, debemos sumar las masas molares de todos los elementos que lo conforman.
Por ejemplo:

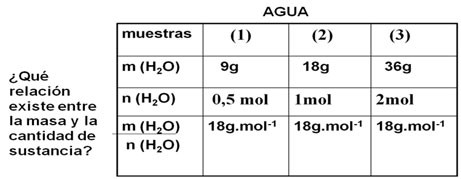
Relación cantidad química (n) y masa molar
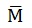
La magnitud cantidad química es directamente proporcional a la masa molar.
Expresión matemática: m = n x
 n = m /
n = m / 
Por ejemplo:
1.
2. El fosgeno (COCl2), es un gas venenoso que se usó como arma letal en la Primera Guerra Mundial. ¿Qué cantidad química son 24,5 g de fosgeno?
 Carbono: 12,0 g/mol
Carbono: 12,0 g/mol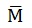 Oxígeno: 16,0 g/mol
Oxígeno: 16,0 g/mol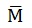 Cloro: 35,0 g/mol x 2
Cloro: 35,0 g/mol x 2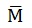 COCl2= 98,0 g/mol
COCl2= 98,0 g/moln = m /
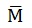 = 24,5 g / 98,0 g/mol = 0,250 mol
= 24,5 g / 98,0 g/mol = 0,250 mol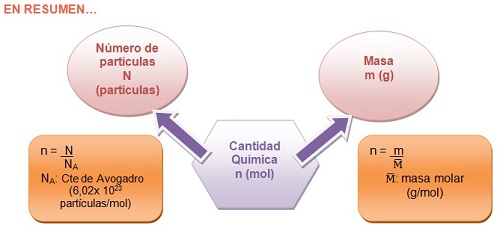
1.1. Cambios físicos y químicos
Comenzando...
En el curso de tercer año de Química aprendiste que podemos clasificar los cambios que ocurren constantemente a nuestro alrededor como físicos o químicos. Los cambios físicos son aquellas transformaciones en las que la composición de la materia no se modifica, por ejemplo cuando colocas agua en el congelador, se transforma en hielo pero sigue siendo agua (fórmula química: H2O). Por el contrario cuando ocurren cambios químicos se modifica la composición de la materia. Un ejemplo de un cambio químico es cuando cocinas una torta de chocolate.

Formas de representar la materia y sus interacciones:
- Nivel macroscópico: Cuando ocurre un cambio químico se forman nuevas sustancias. Llamamos reactivos a las sustancias presentes inicialmente en el sistema y productos a las sustancias que se obtienen luego de la transformación. En un sistema cerrado, al ocurrir el cambio, la masa del sistema se conserva.
Por ejemplo, si reaccionan gas dicloro y sodio metálico, se forma cloruro de sodio. Como podrás ver a continuación al agregar una gota de agua comienza la reacción, y luego de la explosión se observa un polvo de color blanco.
- Nivel ultra microscópico: Al ocurrir una reacción química se rompen unos enlaces químicos y se forman otros nuevos. Los átomos de los elementos que intervienen se reordenan dando lugar a la formación de nuevas sustancias, es decir, los reactivos y los productos están formados por los mismos elementos.
En el caso de la formación de cloruro de sodio, se rompe el enlace metálico que une a las partículas del sodio, también se rompe el enlace covalente que mantiene unidos a los átomos de cloro (formando la molécula de dicloro). Y se forma un enlace iónico (o unión iónica) entre las partículas de sodio y cloro formando el compuesto cloruro de sodio,
- Nivel simbólico: Podemos simbolizar una reacción química a través de una ecuación. En las ecuaciones químicas se representa a cada sustancia con su fórmula correspondiente y se indica el estado de agregación en que se encuentra cada sustancia (sólido, líquido, gas, vapor, acuoso).
Podemos representar la reacción entre el dicloro y el sodio metálico de la siguiente manera:

La expresión anterior se puede leer de la siguiente forma; el sodio metálico sólido y (+) el dicloro gaseoso reaccionan para formar (→) cloruro de sodio sólido.
Para expresar la igualdad del número de átomos de todos los elementos que intervienen debemos "balancear" o "igualar" la expresión anterior. Observamos que el número de átomos de cloro en los reactivos es 2 y en el producto es 1. Para balancear debemos colocar números delante de las fórmulas químicas (nunca en el medio o al final de las mismas porque cambiaríamos dichas fórmulas) hasta lograr la igualdad. Colocamos un 2 delante de la fórmula del cloruro de sodio (NaCl) y revisamos
Na + Cl2 → 2 NaCl
Ahora debemos igualar el número de átomos de sodio. Colocamos un 2 delante de la fórmula del sodio metálico (Na) y revisamos nuevamente.
2 Na + Cl2 → 2 NaCl
Lista la igualación o balanceo.
Este método para balancear las expresiones se conoce como MÉTODO POR TANTEO. Se utiliza para expresiones sencillas.
Para aplicarlo primero debes chequear el número de átomos de cada elemento. Si el número de los átomos de todos los elementos coincide, la expresión ya está balanceada.
De lo contrario, comenzamos por el elemento que se encuentre con diferencia, le ubicamos un número delante (recuerda que el número que utilices multiplicará al subíndice, si lo hay) para igualar el número de átomos del mismo.
Luego que hayamos balanceado correctamente el número de átomos de dicho elemento, debemos chequear los demás elementos químicos hasta asegurarnos que todos están correctamente balanceados.
1.2. Balanceo de expresiones
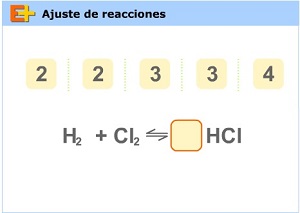
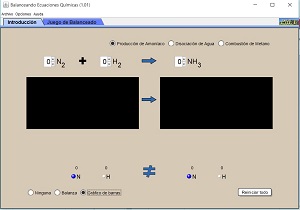
- Utiliza el simulador Ajuste de reacciones para practicar el balanceo de expresiones.
Recuerda que deberás colocar delante de la fórmula de cada compuesto indicado (sea reactivo o producto) un número (coeficiente estequiométrico) que iguale la cantidad de átomos de cada uno de los elementos hasta tener la misma cantidad de átomos antes y después del cambio.
- Con el siguiente simulador podrás continuar aplicando los conceptos de este módulo.
Comenzamos con la pestaña introducción.
1.3. Cálculos estequiométricos
- ¿Cómo funcionaban los antiguos flashes? El flash fotográfico es un dispositivo utilizado para iluminar de forma artificial una escena que se quiere fotografiar. Los primeros flashes estaban compuestos por mezclas que incluían magnesio en polvo, estas mezclas al explotar emitían luz. ¿Qué ocurre durante la combustión del magnesio? Observa el siguiente vídeo.
- Formas de representar la materia y sus interacciones
Podemos describir el cambio ocurrido en tres niveles distintos.
- A nivel macroscópico la tira de magnesio entra en combustión y se observa un destello blanco.
- A nivel ultra microscópico se rompen enlaces químicos de las sustancias llamadas reactivos y se forman nuevas sustancias llamados productos que tienen nuevos enlaces químicos.
- A nivel simbólico, muy usado en Química, podemos representar el cambio a través de la siguiente ecuación química:
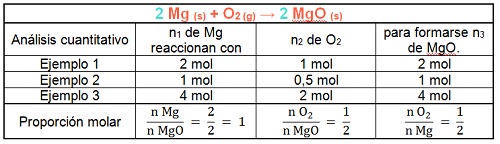
2 Mg + O2 → 2 MgO
Se puede leer la representación anterior de la siguiente manera: el magnesio y el dioxígeno reaccionan para formar óxido de magnesio.
Como vimos en el módulo 14, los cambios químicos se pueden representar a través de una ecuación. Como también analizamos, al ocurrir cambios químicos los elementos químicos se conservan, por lo que podemos afirmar que el número de átomos es el mismo antes y después del cambio. Para representar esta igualdad del número de átomos "balanceamos" o "igualamos" la expresión. En el ejemplo anterior colocamos un dos delante de la fórmula del magnesio sólido y un dos delante de la fórmula del óxido de magnesio para igualar el número de átomos que intervienen en el cambio. Estos números que utilizamos se llaman coeficientes estequiométricos. Los coeficientes estequiométricos permiten establecer la proporción molar en que se combinan los reactivos y se forman los productos.
2 Mg (s) + O2 (g) → 2 MgO (s)
La representación anterior también se puede leer dos moles de magnesio sólido y un mol de dioxígeno gaseoso reaccionan para formar dos moles de óxido de magnesio sólido.
1.4. Proporciones molares y cálculos sencillos
Como puedes observar en el siguiente cuadro, las proporciones en que se combinan los reactivos (Mg y O2) y se forma el producto (MgO) no varían.
- Ejemplo 1
Se tienen 3,50 mol de magnesio sólido, ¿con qué cantidad química de dioxígeno reaccionará al ocurrir su combustión?
Planteo:
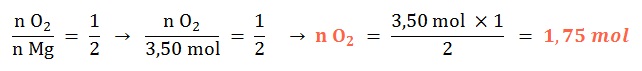
- Ejemplo 2
Se tienen 1,33 mol de dioxígeno gaseoso, ¿con qué cantidad química de magnesio sólido reaccionará al ocurrir su combustión?
Planteo:
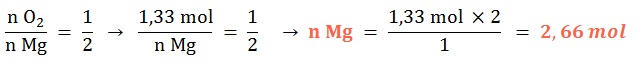
- Ejemplo 3
Si reaccionan 8,62 mol de magnesio sólido ¿qué cantidad química de óxido de magnesio sólido se formará?
Planteo:
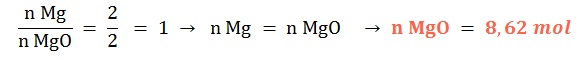
- Ejemplo 4
Si reaccionan 5,31 mol de dioxígeno gaseoso ¿qué cantidad química de óxido de magnesio sólido se formará?
Planteo:
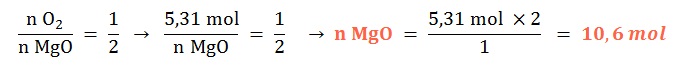
- Ejemplo 5
Si reaccionan 43,5 g de dioxígeno gaseoso ¿qué cantidad química de óxido de magnesio sólido se formará?
Planteo:
Primeramente calcularemos a qué cantidad química de dioxígeno se corresponden esos 43,5 g.

Y luego realizamos el cálculo tomando en cuenta la proporción molar:
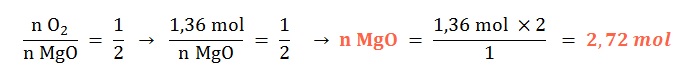
2. Termoquímica
La termoquímica estudia aquellas transformaciones que se acompañan de liberación o de absorción de calor.
El calor, es la energía transferida, a través de paredes conductoras, entre un sistema y su ambiente (o entre sistemas en contacto) cuando sus temperaturas son diferentes. Es un mecanismo de intercambio de energía.
Calor se simboliza con la letra Q. La unidad en el sistema internacional de unidades para calor es Joule y se simboliza con la letra J. En termoquímica es frecuente expresar el calor en kilojoules (kJ). Cotidianamente es común usar otra unidad del calor, la caloría (cal).
Equivalencias: 1kJ – 1000 J 1kcal – 1000 cal 1 cal – 4,18 J
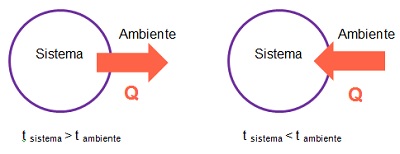
Como puedes observar en la imagen anterior, si un sistema se encuentra a mayor temperatura que el ambiente, la energía en forma de calor se transfiere desde el sistema hacia el ambiente. Por el contrario si la temperatura del sistema es menor que la del ambiente, la energía en forma de calor se transfiere desde el ambiente hacia el sistema.
Es posible determinar si un sistema gana o pierde energía en forma de calor según se produzca en el ambiente o entorno una disminución o aumento de temperatura respectivamente.
2.1. Clasificación termoquímica de los reacciones
Las reacciones químicas que ocurren con la liberación de energía se denominan exotérmicas, mientras que las que ocurren con la absorción de energía se denominan endotérmicas.
Por ejemplo cuando encendemos la estufa, se libera energía proveniente de la combustión de la leña, es por lo tanto un proceso exotérmico. Mientras que para cocinar un alimento se absorbe energía, siendo un proceso endotérmico.


2.2. ¿Cómo se calcula el calor?
Se puede determinar el intercambio de energía por calor que experimenta un cuerpo sabiendo su temperatura inicial y final, su masa y el calor específico del material que forma el cuerpo. El calor se calcula con la siguiente ecuación:
Q = m . ce . Δt
Siendo: Q → calor absorbido o liberado por el cuerpo
m → masa del cuerpo
Ce → calor específico (valor característico para cada material)
Δt = tf - ti → variación de temperatura (temperatura final menos temperatura inicial)
Para tener en cuenta:
- si el sistema absorbe energía, la temperatura del cuerpo aumenta, es decir la temperatura final es mayor que la inicial, por lo tanto la Δt es positivo y el Q es positivo: Δt > 0 → Q > 0.
- si el sistema libera energía, la temperatura del cuerpo disminuye, es decir la temperatura final es menor que la inicial, por lo tanto Δt es negativo y el Q es negativo. Δt < 0 → Q < 0.
Usando la misma ecuación pero operando matemáticamente se pueden determinar las magnitudes masa, calor específico o variación de temperatura, según se desee y dependiendo de los datos experimentales que se tengan.
La tabla a continuación contiene la misma información del esquema en otro formato:
Magnitud | Ecuación | Unidades |
Calor (Q) | Q = m . ce . ∆t
| J o cal |
Calor específico (ce) | ce = Q/m.∆t
| J/g°C o cal / g°C |
Masa (m) |
m = Q/ce .∆t | g |
Variación de temperatura (∆t) | ∆t = Q/ m. ce
| °C |
Materiales | Ce (J/g°C) | Ce (cal/g°C) |
Agua | 4,180 | 1,000 |
Hielo | 2,215 | 0,530 |
Etanol | 2,508 | 0,600 |
Cobre | 0,389 | 0,093 |
Plata | 0,233 | 0,056 |
Aluminio | 0,944 | 0,226 |
Hierro | 0,456 | 0,109 |
Platino | 0,134 | 0,032 |
Oro | 0,130 | 0,031 |
2.3. Determinación de las transferencias de energía
Tanto la ganancia como la pérdida de energía de un sistema que se encuentre en un recipiente con paredes conductoras se manifiestan en el ambiente o entorno.
Es posible determinar si un sistema gana o pierde energía en forma de calor según se produzca en el entorno una disminución o aumento de temperatura respectivamente.
Un calorímetro consiste en un recipiente de material aislante térmico que en su interior contiene agua. Dentro de ese recipiente se encuentra otro, metálico, en el que se colocan las sustancias a reaccionar. Se mide la temperatura del agua circundante antes de la reacción y al finalizar la misma. La variación de temperatura del agua permite determinar si la reacción producida liberó o absorbió calor.
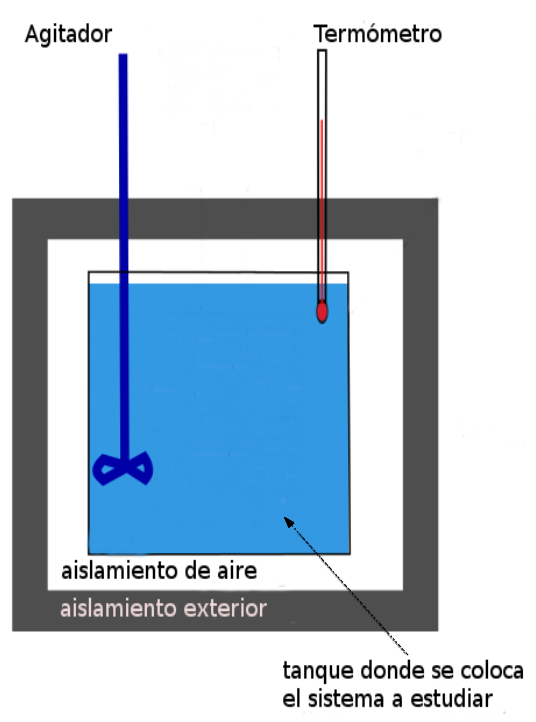
Conociendo la masa de agua utilizada y su calor específico, es posible calcular el calor liberado o absorbido aplicando la ecuación matemática:
Q = m . ce . Δt
2.4. Bomba calorimétrica
Para determinar el poder calorífico de una sustancia, como los combustibles por ejemplo, se utiliza un instrumento llamado bomba calorimétrica. La reacción de combustión se produce en un recipiente metálico cerrado herméticamente donde los gases que intervienen permanecen contenidos en él, es decir que el volumen es constante.
El combustible cuyo poder calorífico se desea determinar se coloca en un crisol para combustible (si el combustible es sólido, deberá colocarse en forma de pastilla) dentro de la bomba calorimétrica. Adicionalmente se agrega el dioxígeno necesario para la combustión. La bomba calorimétrica se rodea de una masa de agua que absorberá el calor liberado por el combustible. Todo esto se realiza dentro de una zona adiabática para evitar fuga de calor que afecte el proceso. Debemos tomar en cuenta que la propia bomba absorbe parte del calor liberado en la combustión debido a que no es un sistema perfectamente adiabático.
Observa el siguiente vídeo:Prueba con el siguiente simulador, da play y presta atención a los cálculos que realiza. Selecciona los diferentes alimentos y completa la siguiente tabla:
| Alimento | masa del alimento | t0 (ºC) | tmáx (ºC) | Δt (ºC) | m H2O (kg) | ce H2O (kcal/kg.ºC) | Q (kcal) |
|---|---|---|---|---|---|---|---|
| 1- | |||||||
| 2- | |||||||
| 3- | |||||||
| 4- | |||||||
| 5- | |||||||
| 6- | |||||||
| 7- | |||||||
| 8- |
3. Interpretación de las transferencias de energía: entalpía
En termoquímica se identifica el calor liberado o absorbido a presión constante con la variación de una propiedad del sistema, llamada entalpía, que se simboliza con la letra H. El cambio de entalpía de un sistema durante una reacción química es igual al calor liberado o absorbido a presión constante.
La entalpía de un sistema disminuye si durante una transformación a presión constante se libera calor (Q). La entalpía de un sistema aumenta si durante una transformación a presión constante se absorbe Q.
La variación de entalpia se determina: ∆H = H final – H inicial
- En un proceso exotérmico ∆H es menor a cero. ∆H<0
- En un proceso endotérmico ∆H es mayor a cero. ∆H>0
Observa las siguientes animaciones:
Por ejemplo:
1. La combustión completa del metano, se puede representar por la siguiente ecuación termoquímica:
CH4 (g) + 2 O2(g) → CO2 (g) + 2 H2O(l) ∆H = - 890,4 kJ/mol.
Esto significa que por cada mol de metano (CH4) que se quema se liberan 890,4 kJ. Es un proceso exotérmico.
2. La formación de la hidracina se puede representar por la siguiente ecuación termoquímica:
2 H2(g) + N2(g) → N2H4 (g) ∆H = + 95,4 kJ/mol.
Esto significa que por cada mol de hidracina (N2H4) formada se absorben 95,4 kJ. Es un proceso endotérmico.
3.1. Diagrama entálpico
En termoquímica se denomina diagrama entálpico a la gráfica que permite representar los cambios de entalpía en las reacciones químicas. Un diagrama entálpico se construye en un par de ejes cartesianos; en el eje de las ordenadas se representa la entalpía (H) y en el de las abscisas el avance de la reacción. Los siguientes diagramas entálpicos representan de forma genérica un proceso endotérmico y uno exotérmico.
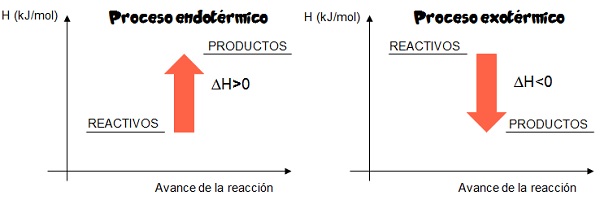
Con la ayuda del siguiente simulador repasa las diferencias entre los diagramas entálpicos de los procesos exotérmicos y endotérmicos.

Haz clic en la palabra reaccionantes y/o en productos, arrástralos cambiando su posición en el diagrama.
3.2. Características de la entalpía
- La entalpía es una propiedad intensiva. Por lo tanto las variaciones de entalpía de los procesos químicos dependen de la cantidad de reactivos que se consumen y de la cantidad de productos que se forman.
H2 (g) + Cl2(g) → 2 HCl (g) ∆H = - 184,6 kJ/mol
1/2 H2 (g) + 1/2 Cl2(g) → HCl (g) ∆H = - 92,3 kJ/mol
- La variación de la entalpía de las reacciones depende del estado físico de las sustancias intervinientes.
En las ecuaciones termoquímicas es necesario indicar el estado de agregación de las sustancias reaccionantes como de las que se producen.
Por ejemplo, el calor liberado por cada mol de metano que se quema a presión constante es diferente según se considere al agua formado en estado gaseoso o en estado líquido.
CH4 (g) + 2 O2(g) → CO2 (g) + 2 H2O (g) ∆H = - 802,4 kJ/mol
CH4 (g) + 2 O2(g) → CO2 (g) + 2 H2O (l) ∆H = - 890,4 kJ/mol
- En el caso de las transformaciones reversibles la variación de entalpía del proceso directo tiene el mismo valor numérico pero de signo contrario al del proceso inverso.
N2 (g) + 3 H2(g) → 2 NH3 (g) ∆H = - 92 kJ/mol
Si se considera el proceso inverso, al descomponerse dos moles de amoníaco gaseoso formando dos moles de dinitrógeno y tres moles de dihidrógeno gaseosos, se absorben 92 kJ.
2 NH3 (g) → N2 (g) + 3 H2(g) ∆H = + 92 kJ/mol
3.3. Entalpía de combustión
La variación de entalpía de combustión (ΔHcomb) representa la energía en forma de calor liberada en una combustión para 1 mol del reactivo que se quema. La combustión es un proceso exotérmico donde se libera energía.
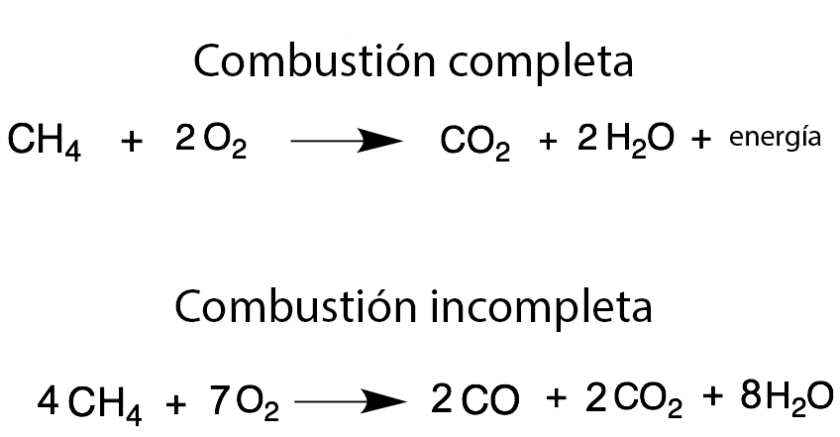
La combustión puede ser:- completa: con el aporte necesario de dioxígeno gaseoso, formándose dióxido de carbono y agua, o
- incompleta: si la cantidad de dioxígeno presente es menor a la necesaria, formándose monóxido de carbono y hollín (carbono sólido).
La siguiente tabla indica el ΔHcomb para algunas sustancias:
| Sustancia | Fórmula | ΔHcomb (kJ/mol) |
|---|---|---|
| Octano | C8H18 (l) | - 5471 |
| Glucosa | C6H12O6 (s) | - 2808 |
| Sacarosa | C12H22O11 (s) | - 5645 |
| Metano | CH4 (g) | - 802,4 |
3.4. Entalpía de formación
ΔHfº: La entalpía de formación estándar es la entalpía de la reacción estándar para la formación de una sustancia a partir de sus elementos en su forma más estable.
Es el cambio de calor relacionado cuando se forma un mol de un compuesto a partir de sus elementos a presión de 1 bar.
Por convención la ΔHfº para una sustancia simple es cero.
La siguiente tabla de datos contiene información sobre la entalpía de formación estándar de algunas sustancias compuestas:


- Lo primero que vamos a hacer es balancear la expresión anterior, en este caso ya está balanceada (coinciden el número de átomos de carbono en reactivos y productos -2-; el de hidrógenos 4+2 = 6 y 5+1 = 6; y el de oxígenos 1 en cada lado).
- Luego en la tabla vamos a buscar el ΔHfº de cada uno de los compuestos que aparecen en la reacción:
- Aplicamos la siguiente expresión sabiendo que n es 1 ya que la ecuación ya estaba igualada: ΔHrº = ∑ n ΔHfº productos - ∑ n ΔHfº reactivos
3.5. Ley de Hess
“La entalpía de la reacción global es la suma de las entalpías de los pasos de la reacción en que la reacción puede ser dividida” o “cuando los reactivos se convierten en productos, el cambio de entalpía es el mismo independientemente de que se efectúe la reacción en un paso o en una serie de pasos”.
Se aplica aún cuando las reacciones intermedias o la reacción global realmente no puedan llevarse a cabo.
Se utiliza para predecir las entalpías de reacciones que no se pueden medir directamente en el laboratorio, la reacción es muy lenta, o suceden reacciones secundarias que producen otras sustancias además del compuesto de interés.
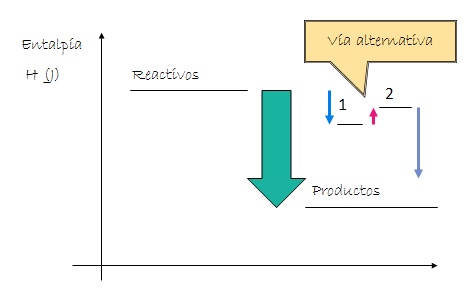

El calor liberado o absorbido a presión constante (entalpía) en una transformación química depende únicamente de cuál es la situación de partida y cuál es la situación final del sistema y no depende del camino seguido durante el proceso.
Si ciertos reactivos se convierten en determinados productos (en las mismas condiciones), la variación de entalpía tiene el mismo valor independientemente que el proceso se realice en uno o varios pasos.
Por ejemplo, la variación de la entalpía del proceso de obtención de dióxido de carbono a partir de carbono grafito y dioxígeno gaseoso tiene el mismo valor ya sea que la transformación tenga lugar en una etapa o en dos etapas.
- Proceso en una etapa:
C (grafito) + O2 (g) → CO2 (g) ∆H1 = - 393 kJ/mol
- Proceso en dos etapas:
C (grafito) + 1/2 O2 (g) → CO (g) ∆H2 = - 111 kJ/mol
CO (g) + 1/2 O2 (g) → CO2 (g) ∆H3 = - 282 kJ/mol
Entonces:
∆H1 = ∆H2 + ∆H3
- 393 kJ/mol = - 111 kJ/mol + ( - 282 kJ/mol)
Si se parte de carbono grafito y dioxígeno gaseoso y se obtiene dióxido de carbono gaseoso el calor liberado a presión constante es 393 kJ/mol, no importa si se forma directamente el dióxido de carbono, o si en una primera etapa se obtiene monóxido de carbono (CO) y este luego reacciona con más dioxígeno produciéndose dióxido de carbono gaseoso.
5. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Alegría, Mónica y otros. (1999). Química II. Argentina: Santillana
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill
- Masterton, W. y Hurley, C. (2004). Principios y reacciones. (4ta edición). Madrid, España: Thomson.
Vídeos, páginas y/o simuladores utilizados:
- Ajuste de reacciones. Educaplus. http://www.educaplus.org/game/ajuste-de-reacciones
- Balanceando Ecuaciones Químicas. PhET. https://phet.colorado.edu/sims/html/balancing-chemical-equations/latest/balancing-chemical-equations_es_PE.html
- luis alberto Molina. (2012, 16 de octubre). SODIO Y AGUA EN CLORO. [Archivo de vídeo]. Recuperado de: https://www.youtube.com/watch?v=mBpFDL_sjIg&feature=youtu.be
- Profesor Rodrigo Araya. (2014, 14 de diciembre). Combustion de una cinta de magnesio. [Archivo de vídeo]. Recuperado de: https://www.youtube.com/watch?v=XyrOvg3pS88&feature=youtu.be
David Read . (2008, septiembre 16). Bomb calorimetry. [Archivo de vídeo]. Recuperado de: https://youtu.be/ohyA9amFfsc- Simulador de bomba calorimétrica. Recuperado de: http://highered.mheducation.com/sites/9834092339/student_view0/chapter48/bomb_calorimeter.html
- Endothermic reaction. Middle School Chemistry. ACS. Recuperado de: http://www.middleschoolchemistry.com/multimedia/chapter6/lesson7#endothermic
- Exothermic reaction. Middle School Chemistry. ACS. Recuperado de: http://www.middleschoolchemistry.com/multimedia/chapter6/lesson7#exothermic
- Variación de la entalpía. Educaplus. http://www.educaplus.org/game/variacion-de-la-entalpia
Pablovic Ruiz . (2012, diciembre 21). Entalpía con calores de formación (Pablovic). [Archivo de vídeo]. Recuperado de: https://youtu.be/pX3IoSrhzSE- Ecomundo Virtual. (2014, noviembre 24). Ley de Hess Aplicación en la termodinámica. [Archivo de vídeo]. Recuperado de: https://youtu.be/-UXURxdkkkY
- Pablovic Ruiz. (2013, enero 2). Entalpía a partir de reacciones intermedias (Pablovic). [Archivo de vídeo]. Recuperado de: https://youtu.be/fTngdUBVxw0
QuantumFracture . (2015, marzo 12). Las Leyes de la Termodinámica en 5 Minutos. [Archivo de vídeo]. Recuperado de: https://youtu.be/Bvfn6eUhUAc
Las imágenes utilizadas fueron tomadas de:
- http://quimica.cubaeduca.cu/images/mgthumbnails/461x179-images-stories-quimica-tabla-guaa.jpg
- https://www.flickr.com/photos/stevendepolo/3072821281
- https://pixabay.com/es/pastel-de-chocolate-dulce-chocolate-476348/
- https://cdn.pixabay.com/photo/2013/08/16/10/56/fire-173072_960_720.jpg
- http://c1.peakpx.com/wallpaper/390/52/867/frying-pan-pan-kitchen-fried-sear-wallpaper-thumb.jpg
- https://upload.wikimedia.org/wikipedia/commons/thumb/0/0c/Drawing-kalorimeter.svg/963px-Drawing-kalorimeter.svg.png
- https://curiosoando.com/wp-content/uploads/2016/07/metano-combustion-incompleta.png
- http://www.100ciaquimica.net/images/temas/tema5/ima/leyhess.gif