Material de lectura
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Formato rejilla |
| Libro: | Material de lectura |
| Imprimido por: | Invitado |
| Día: | viernes, 4 de abril de 2025, 00:46 |
1. Equilibrio químico
Un estado de equilibrio químico se caracteriza por:
- La
constancia en las propiedades macroscópicas, es decir que si el sistema está en
equilibrio químico no se aprecia ningún cambio en sus propiedades. Ello lleva a
concluir que la composición del sistema no varía. Macroscópicamente las concentraciones de todas las especies intervinientes
no varían. No hay transformación química.
- A
nivel microscópico es difícil pensar que las partículas no estén en movimiento:
ello indica que el efecto de los choques entre las partículas de reactivos para
formar productos, se compensa con el de los choques entre las partículas de los
productos para formar reactivos. Esto suele expresarse afirmando que en el
estado de equilibrio químico las velocidades de la reacción directa y de la
reacción inversa son iguales. Microscópicamente
continúan formándose partículas de los productos a partir de las partículas de
los reactivos y viceversa. Tienen lugar dos reacciones químicas opuestas.
Analogía: Lo podemos comparar con el movimiento de esquiadores en un centro de esquí repleto de personas, donde el número de esquiadores que suben a la montaña por el teleférico es igual al número de esquiadores que bajan deslizándose. Aunque hay un acarreo constante de esquiadores, la cantidad de personas que hay en la cima y la que está en la base de la ladera no cambia.
Observa el siguiente vídeo, recuerda activar los subtítulos y traducirlos al español:
1.2. Ejemplo 2 yoduro de hidrógeno
Observa el siguiente vídeo, selecciona los subtítulos en español (están disponibles también en español):
1.3. K: constante de equilibrio
Este proceso puede generalizarse con la siguiente reacción reversible, siendo a,b,c y d los coeficientes estequiométricos de las especies reactivas A, B, C y D a una temperatura dada:
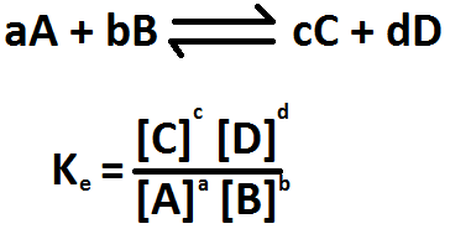
Donde K es la CONSTANTE DE EQUILIBRIO. La ecuación anterior es la expresión matemática de la ley de acción de las masas, propuesta por los químicos noruegos Cato Guldberg y Peter Waage, en 1864. Esta ley establece que para una reacción incompleta en equilibrio y a una temperatura constante, una relación determinada de concentraciones de reactivos y productos tiene un valor constante K (la constante de equilibrio).
- Aunque
las concentraciones pueden variar, el valor de K para una reacción dada
permanece constante, siempre y cuando la reacción esté en equilibrio y la
temperatura no cambie.
- K
no tiene unidades.
Valor de K:
- sólo
varía con la temperatura
- es constante a una T (temperatura) dada
- es
independiente de las concentraciones iniciales.
1.4. Evolución de un sistema hacia el equilibrio
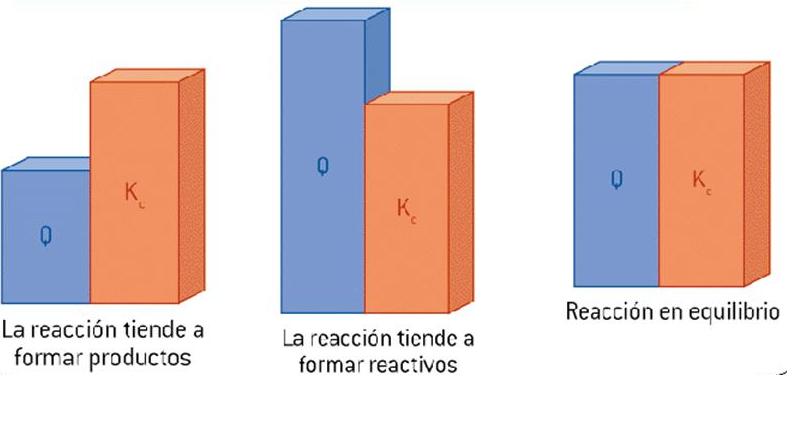
No es suficiente que en un sistema coexistan reactivos y productos para que se encuentre en equilibrio. Esto ocurre si las concentraciones de ambos corresponden a las del equilibrio a esa temperatura. Para evaluar esto definimos Q como la relación entre las concentraciones en cualquier instante.
- Si Q
coincide con K el
sistema alcanzó el equilibrio.
- Si Q <
K, la
concentración de los productos es menor que la que corresponde al valor de
dicha concentración en el equilibrio, a la misma temperatura, y el sistema
evolucionará hacia la formación
de productos.
- Si Q >
K se
da la situación inversa y se descompondrá
parte del producto para
formar reactivo.
Observa el siguiente vídeo:
1.5. Composición de un sistema en el equilibrio
Por EJEMPLO, si consideramos la siguiente reacción:
N2 (g) + O2 (g) ↔ 2 NO (g)
- En teoría, un mol de dinitrógeno se combina con un mol de dioxígeno
para producir dos moles de monóxido de nitrógeno.
- En la práctica, la cantidad de
NO obtenida será menor, pero la relación de combinación se conservará.
- Así si
reaccionan x mol de cada reactivo se
formarán 2x mol de producto:
N2 (g)) + O2 (g) ↔ 2 NO (g) | |||
[ ]i | 1 mol/L | 1 mol/L | 0 |
[ ]eq | 1-x | 1-x | 2x |
[ ]eq |
|
|
|
2.1. Resumen
- Efecto de la concentración:
|
Cambio |
Q |
Dirección del cambio A + B ↔ C + D |
|
Aumenta la concentración de A o B |
Q < K |
→ derecha |
|
Aumenta la concentración de C o D |
Q > K |
izquierda ← |
|
Disminuye la concentración de A o B |
Q > K |
izquierda ← |
|
Disminuye la concentración de C o D |
Q < K |
derecha → |
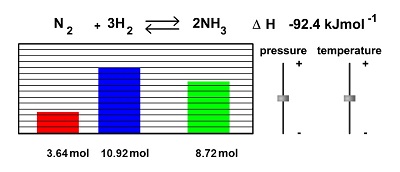
- Efecto de la presión:
No todos los sistemas se ven afectados. por las variaciones de presión (y por ende de volumen). Los cambios de presión normalmente no alteran las concentraciones de los reactivos en las fases condensadas ya que los líquidos y sólidos son prácticamente incompresibles. En cambio, las concentraciones de los gases son muy susceptibles a los cambios de presión.
*un descenso de V (aumento de P) desplaza la reacción en el sentido que produce la menor cantidad química de gas.
*un aumento de V (descenso de P) desplaza la reacción en el sentido que produce la mayor cantidad química de gas.
* si no hay cambio en la cantidad química de los gases en reacción, un cambio en V o P no produce modificaciones en el sistema.
- Efecto de la temperatura:
En general, un aumento de temperatura favorece siempre la reacción endotérmica. Si la reacción directa es exotérmica, un aumento de temperatura produce siempre una disminución del valor de K.
3. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Alegría, M., Franco, R., Jaul, M. y Morales, E. (2007). Química. Estructura, comportamiento y transformaciones de la materia. Buenos Aires, Argentina: Santillana
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill
- Masterton, W. y Hurley, C. (2004). Principios y reacciones. (4ta edición). Madrid, España: Thomson.
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (5ta edición). Madrid, España: Mc Graw Hill.
- Del Pozo, V. (2012-2013). Universidad de Valladolid. Unidad didáctica El equilibrio Químico. Recuperado de: http://uvadoc.uva.es/bitstream/10324/3476/1/TFM-G170.pdf
Vídeos, páginas y/o simuladores utilizados:
- Simulador amoniaco y factores que afectan el equilibrio químico. http://www.freezeray.com/flashFiles/ammoniaConditions.htm
- Simulador óxidos de nitrógeno. http://www.mhhe.com/physsci/chemistry/animations/chang_7e_esp/kim2s2_5.swf
TED-Ed. (2013, julio 23). What is chemical equilibrium? - George Zaidan and Charles Morton. [Archivo de vídeo]. Recuperado de: https://youtu.be/dUMmoPdwBy4FuseSchool - Global Education. (2013, mayo 22). What is Dynamic Equilibrium? | The Chemistry Journey | The Fuse School. [Archivo de vídeo]. Recuperado de: https://youtu.be/wlD_ImYQAgQ KhanAcademyEspanol - FuseSchool - Global Education. (2013, junio 3). Le Chatelier's Principle Part 1 | The Chemistry Journey | The Fuse School. [Archivo de vídeo]. Recuperado de: https://youtu.be/7zuUV455zFs
- FuseSchool - Global Education. (2013, junio 27). Le Chatelier's Principle: Part 2 | The Chemistry Journey | The Fuse School. [Archivo de vídeo]. Recuperado de: https://youtu.be/XhQ02egUs5Y
Las imágenes utilizadas fueron tomadas de:
- https://upload.wikimedia.org/wikipedia/commons/4/4d/Constant_d%27equilibri.png
- https://quimicadaniel.files.wordpress.com/2014/09/5096e-copiade21.jpg