¿Qué es la entalpía?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué es la entalpía? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:53 |
1. Clasificación termoquímica de los procesos
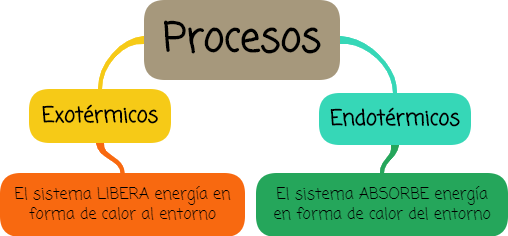
La termoquímica estudia aquellas transformaciones que se acompañan de liberación o de absorción de calor.
Las transformaciones o cambios ya sean físicos o químicos que ocurren con la liberación de energía se denominan exotérmicos, mientras que los que ocurren con la absorción de energía se denominan endotérmicos.
Los procesos endotérmicos son aquellos en los que el sistema absorbe energía en forma de calor del medio.
Los procesos exotérmicos son aquellos en los que el sistema libera energía en forma de calor al medio.
2. Interpretación de las transferencias de energía: entalpía
En termoquímica se identifica el calor liberado o absorbido a presión constante (QP) con la variación de una propiedad del sistema, llamada entalpía, que se simboliza con la letra H. El cambio de entalpía de un sistema durante una reacción química es igual al calor liberado o absorbido a presión constante.
![]()
La mayoría de las reacciones químicas y cambios físicos tienen lugar a presión constante (normalmente la atmosférica).
La entalpía de un sistema disminuye si durante una transformación a presión constante se libera calor (Q). La entalpía de un sistema aumenta si durante una transformación a presión constante se absorbe Q.
La variación de entalpía se determina: ∆H = H final – H inicial / ∆H = H productos – H reactivos
- En un proceso exotérmico ∆H es menor a cero. ∆H<0
- ¿Qué ocurre a nivel ultramicroscópico en un proceso exotérmico? Observa la siguiente Animación 1
- En un proceso endotérmico ∆H es mayor a cero. ∆H>0
- ¿Qué ocurre a nivel ultramicroscópico en un proceso endotérmico? Observa la siguiente Animación 2
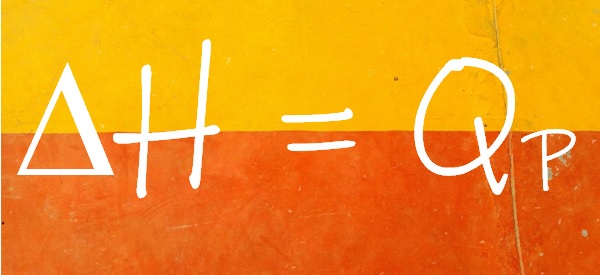
2.1. Diagrama entálpico
En termoquímica se denomina diagrama entálpico a la gráfica que permite representar los cambios de entalpía en las reacciones químicas. Un diagrama entálpico se construye en un par de ejes cartesianos; en el eje de las ordenadas (eje y) se representa la entalpía (H) y en el de las abscisas (eje x) el avance de la reacción. Los siguientes diagramas entálpicos representan de forma genérica un proceso endotérmico y uno exotérmico.

Con la ayuda del siguiente simulador repasa las diferencias entre los diagramas entálpicos de los procesos exotérmicos y endotérmicos.

Haz clic en la palabra reaccionantes y/o en productos, arrástralos cambiando su posición en el diagrama.
2.2. Características de la entalpía
- La entalpía es una propiedad extensiva. Por lo tanto las variaciones de entalpía de los procesos químicos dependen de la cantidad de reactivos que se consumen y de la cantidad de productos que se forman.
H2 (g) + Cl2 (g) → 2 HCl (g) ∆H = - 184,6 kJ
½ H2 (g) + ½ Cl2 (g) → HCl (g) ∆H = - 92,3 kJ
- La variación de la entalpía de las reacciones depende del estado físico de las sustancias intervinientes.
En las ecuaciones termoquímicas es necesario indicar el estado de agregación de las sustancias reaccionantes como de las que se producen.
Por ejemplo, el calor liberado por cada mol de metano que se quema a presión constante es diferente según se considere al agua formado en estado gaseoso o en estado líquido.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (g) ∆H = - 802,4 kJ
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l) ∆H = - 890,2 kJ
- En el caso de las transformaciones reversibles la variación de entalpía del proceso directo tiene el mismo valor numérico pero de signo contrario al del proceso inverso.
N2 (g) + 3 H2 (g) → 2 NH3 (g) ∆H = - 92 kJ
Si se considera el proceso inverso, al descomponerse dos moles de amoníaco gaseoso formando dos moles de dinitrógeno y tres moles de dihidrógeno gaseosos, se absorben 92 kJ.
2 NH3 (g) → N2 (g) + 3 H2 (g) ∆H = + 92 kJ
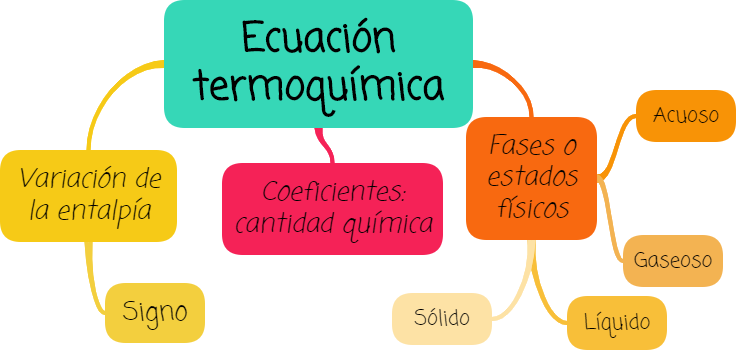
3. Ecuación termoquímica
Es una ecuación química que muestra la relación entre las entalpías de los reactivos y los productos. A la derecha de la ecuación química ajustada figura el valor y el signo de la variación de la entalpía para la reacción, y su signo indica el tipo de proceso exotérmico o endotérmico, los coeficientes indican la cantidad química de cada sustancia (1 mol, 2 mol, etc), y se especifican las fases o estados físicos de todas las especies (s- sólido, l- líquido, g- gaseoso, ac- acuoso).
H2 (g) + ½ O2 (g) → H2O (l) ΔH = - 286 kJ
La mayoría de los datos termoquímicos se informan para 25 ºC y 1 bar (0,987 atm), dicha temperatura es la más común en los cuadros de datos aunque no es la definición del estado estándar.
4. Limitaciones de la definición de entalpía
En este módulo hemos trabajado con una definición simplificada de la variación de la entalpía. Dicha definición presenta limitaciones. Uno de los aspectos del campo de validez o las limitaciones de la definición que hemos trabajado es, por ejemplo, que el calor de reacción producido a presión constante en un cambio químico no será equivalente a ∆H si, por ejemplo, en el proceso se está produciendo al mismo tiempo trabajo eléctrico.
De forma más completa podemos definir la variación de la entalpía (∆H) como el calor producido o absorbido por el sistema cuando el proceso se realiza a presión y temperatura constantes pero siempre que no hayan otros procesos de transferencia de energía como, por ejemplo, realización de trabajo eléctrico o emisión de radiaciones distintas a las admitidas en la noción de calor.
5. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Alegría, M., Bosack, A., Deprati, A., Dal Fávero, M., Franco, R., Jaul, M. y Morales, E. (1999). Química II Dinámica de las transformaciones. Introducción a la Química biológica, ambiental e industrial. Argentina: Santillana.
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill.
- Masterton, W. y Hurley, C. (2004). Principios y reacciones. (4ta edición). Madrid, España: Thomson.
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
- Solbes, J., Furió-Gómez, C. y Furió-Más, C. (2006). Análisis crítico de la representación del tema de la termodinámica en libros de texto de Bachillerato y Universidad. Didáctica de las ciencias experimentales y sociales, ISSN 0214-4379, 20, pp. 47-68. Recuperada de: https://www.researchgate.net/publication/44163287_Analisis_critico_de_la_representacion_del_tema_de_la_termodinamica_en_libros_de_texto_de_Bachillerato_y_Universidad
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (Quinta edición). Madrid, España: Mc Graw Hill.
Vídeos, páginas y/o simuladores utilizados:
- Endothermic reaction. Middle School Chemistry. ACS. Recuperado de: http://www.middleschoolchemistry.com/multimedia/chapter6/lesson7#endothermic
- Exothermic reaction. Middle School Chemistry. ACS. Recuperado de: http://www.middleschoolchemistry.com/multimedia/chapter6/lesson7#exothermic
- Variación de la entalpía. Educaplus. http://www.educaplus.org/game/variacion-de-la-entalpia