¿Qué son la entalpía de formación y de combustión estándar?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué son la entalpía de formación y de combustión estándar? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:55 |
1. Entalpía de formación estándar
![]()
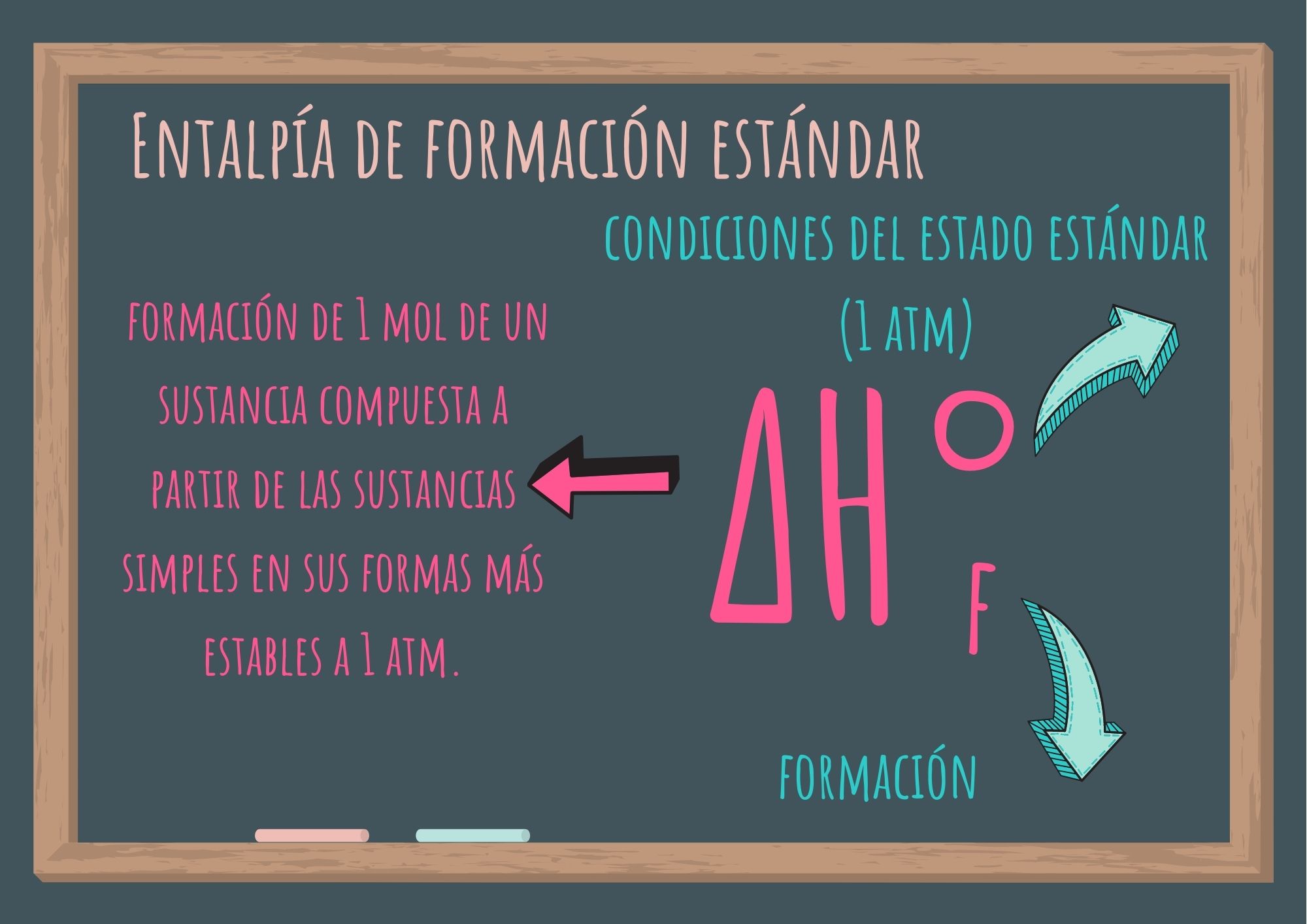
Se denomina entalpía de formación estándar a la variación de entalpía correspondiente a la formación de 1 mol de una sustancia compuesta a partir de las sustancias simples en sus formas más estables a 1 atm (presión de 1 atmósfera).
![]()
Se simboliza ΔH°f : donde el exponente "°" representa las condiciones del estado estándar (1 atm), y el subíndice "f", significa formación.
A pesar de que el estado estándar no especifica una temperatura, se suelen utilizar valores de ΔH°f medidos a 25,0 °C.
![]()
Por convención, la entalpía de formación estándar de cualquier sustancia simple en su forma más estable es igual a cero. Analicemos los siguientes ejemplos:
- Sustancias simples formadas por el elemento oxígeno: El dioxígeno (O2) es más estable que el ozono (O3), la otra forma alotrópica del oxígeno a 1 atm. Por lo que ΔH°f (O2) = 0 kJ/mol mientras que ΔH°f (O3) = 143 kJ/mol.
- Sustancias simples formadas por el elemento carbono: El grafito es una forma alotrópica del carbono más estable que el diamante a 1 atm, por lo tanto ΔH°f (C graf) = 0 kJ/mol y ΔH°f (Cdiam) = 1,9 kJ/mol.
Nota: Existen sustancias simples con propiedades diferentes pero formadas por el mismo elemento, llamadas variedades alotrópicas o alótropos. Si las propiedades características (punto de fusión, punto de ebullición, dureza, densidad, entre otras) son distintas significa que se trata de sustancias diferentes.
![]()
La entalpía de formación estándar del agua líquida es - 285,8 kJ/mol, lo que se representa:
H2 (g) + ½ O2 (g) → H2O (l)
ΔH°f (H2O, l) = - 285,8 kJ/mol
La entalpía de formación estándar del dióxido de carbono gaseoso es - 393,5 kJ/mol, lo que se representa:
C (graf) + O2 (g) → CO2 (g)
ΔH°f (CO2, g) = - 393,5 kJ/mol
La entalpía de formación estándar del metano gaseoso es - 74,9 kJ/mol, lo que se representa:
C (graf) + 2 H2 (g) → CH4 (g)
ΔH°f (CH4, g) = - 74,9 kJ/mol
La entalpía de formación estándar del etanol líquido es - 277,7 kJ/mol, lo que se representa:
2 C (graf) + 3 H2 (g) + ½ O2 (g) → C2H6O (l)
ΔH°f (C2H6O, l) = - 277,7 kJ/mol
La entalpía de formación estándar del óxido de magnesio sólido es - 601,6 kJ/mol, lo que se representa:
Mg (s) + ½ O2 (g) → MgO (s)
ΔH°f (MgO, s) = - 601,6 kJ/mol
Puedes consultar el siguiente enlace y encontrarás al final una tabla con la entalpía de formación estándar de varias sustancias.
![]()
2. Entalpía de reacción estándar
![]()
La importancia de las entalpías estándar de formación radica en que, una vez que se conocen sus valores, se puede calcular la entalpía de reacción estándar, que se define como la variación de la entalpía de una reacción que se efectúa a 1 atm de presión. Es la variación de la entalpía de la reacción cuando los reactivos en su estado estándar se transforman en productos en su estado estándar.
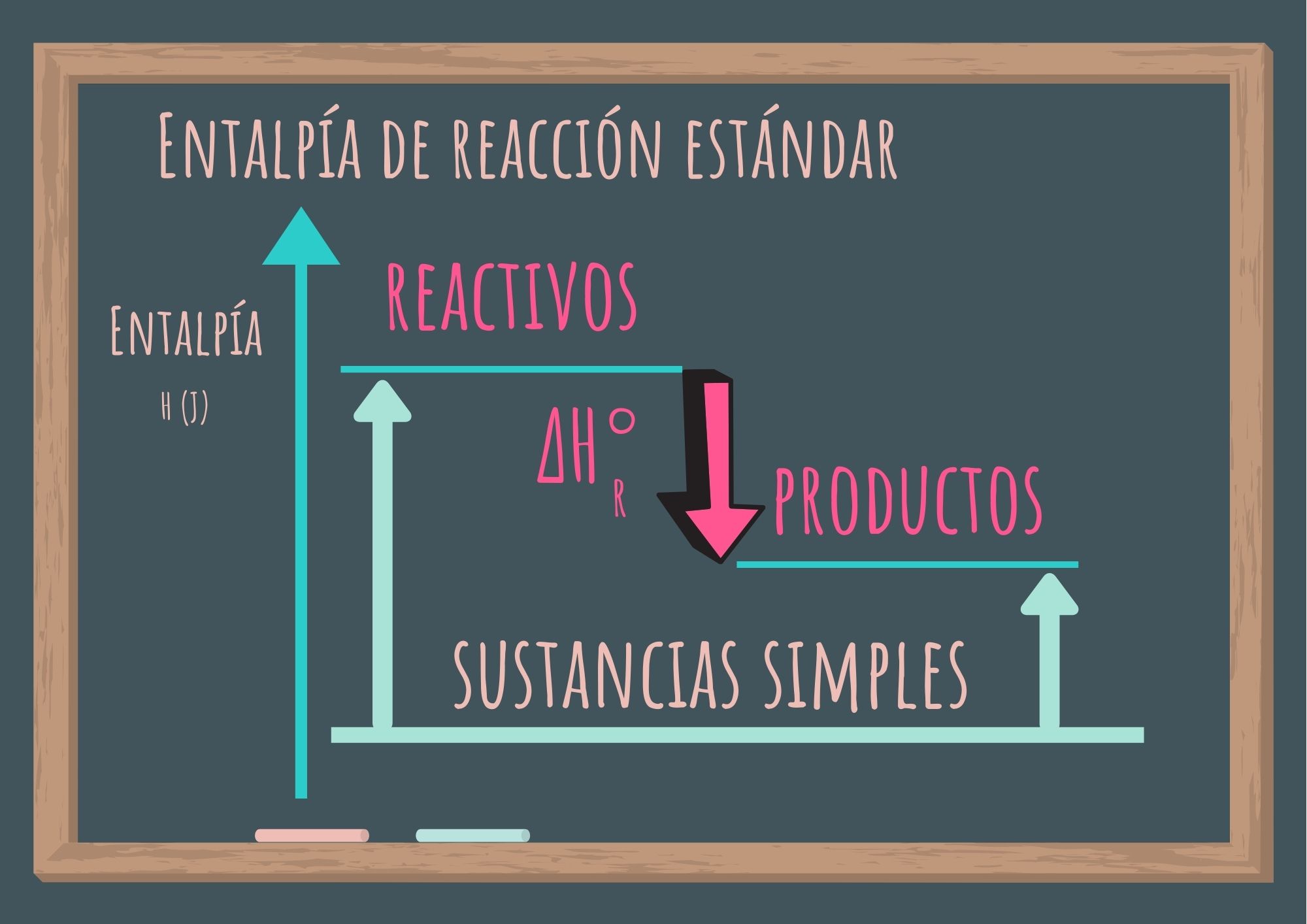
Como puedes observar en la gráfica anterior si conocemos la entalpía de formación estándar de las sustancias que participan como reactivos y de las sustancias que forman los productos (datos tabulados), haciendo la diferencia podemos encontrar la entalpía de reacción estándar.
![]()
Se simboliza ΔH°r : donde el exponente "°" representa las condiciones del estado estándar (1 atm), y el subíndice "r", significa reacción.
A pesar de que el estado estándar no especifica una temperatura, se suelen utilizar valores de ΔH°f medidos a 25,0 °C.
![]()
Por ejemplo, consideremos la reacción hipotética:
a A + b B → c C + d D
Siendo A y B: reactivos, C y D: productos.
Siendo a, b, c y d los coeficientes estequiométricos que se obtienen al igualar o balancear dicha expresión.
Para calcular ΔH°r podemos utilizar la siguiente expresión matemática:
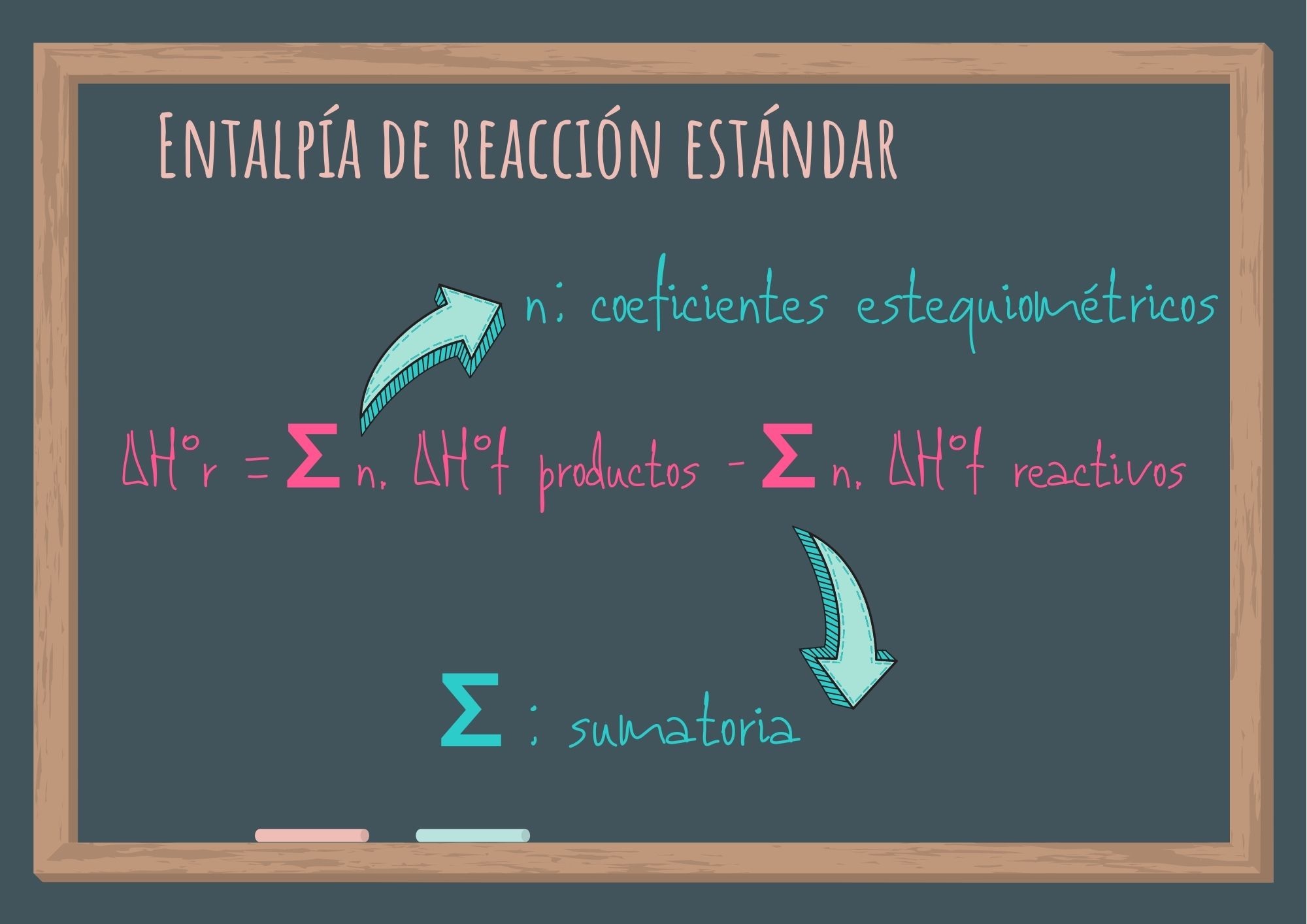
ΔH°r = [c. ΔH°f (C) + d. ΔH°f (D)] - [a. ΔH°f (A) + b. ΔH°f (B)]
Se multiplica el coeficiente estequiométrico del producto 1 por la entalpía de formación estándar de ese producto (valor que aparecen en tablas), lo mismo se realiza para el producto 2, y el 3 si lo hubiere. Se suman los valores entre sí. Se lleva a cabo el mismo procedimiento para los reactivos y se suman los valores obtenidos entre sí. Finalmente, sabiendo que la variación es la diferencia entre el estado final y el inicial, se resta el valor obtenido para los productos y el valor obtenido para los reactivos. De esta forma se obtiene la entalpía estándar para la reacción química analizada.
En general podemos utilizar la siguiente expresión matemática:
ΔH°r = ∑ n. ΔH°f productos - ∑ n. ΔH°f reactivos
Donde n representa los coeficientes estequiométricos y ∑ la suma de.
Para calcular ΔH°r se deben conocer los ΔH°f de las sustancias que intervienen en la reacción.
![]()
1. Calcular la entalpía de reacción estándar para el siguiente cambio:
2 NH3 (g) +
 O2 (g) → 2 NO (g) + 3 H2O (g)
O2 (g) → 2 NO (g) + 3 H2O (g)
Primeramente consultamos la siguiente tabla (la tabla se encuentra al final de la página) para obtener las entalpías estándar de formación de cada una de las sustancias que intervienen. Recuerda revisar bien en la tabla tomando en cuenta el estado de agregación de cada una de las sustancias ya que varía la entalpía de formación estándar según el estado de agregación.
Productos:
- ΔH°f (NO, g) = 90,3 kJ/mol
- ΔH°f (H2O, g) = - 241,8 kJ/mol
Reactivos:
- ΔH°f (NH3, g) = - 45,9 kJ/mol
- ΔH°f (O2, g) = 0 kJ/mol
∑ n. ΔH°f productos = (2 mol. 90,3 kJ/mol) + (3 mol. - 241,8 kJ/mol)
∑ n. ΔH°f productos = 180,6 kJ - 725,4 kJ
∑ n. ΔH°f productos = - 544,8 kJ
Repetimos los pasos anteriores para los reactivos, tomando en cuenta nuevamente los coeficientes estequiométricos.
∑ n. ΔH°f reactivos = (2 mol. - 45,9 kJ/mol) + (2,5 mol. 0 kJ/mol)
∑ n. ΔH°f reactivos = - 91,8 kJ
Para finalizar utilizamos la siguiente expresión sustituyendo los resultados obtenidos en los pasos anteriores.
ΔH°r = ∑ n. ΔH°f productos - ∑ n. ΔH°f reactivos
ΔH°r = - 544,8 kJ - (- 91,8 kJ) = - 453,0 kJ
2. Calcular la entalpía de reacción estándar para el siguiente cambio:
NH3 (g) + HCl (g) → NH4Cl (s)
Primeramente consultamos la siguiente tabla (la tabla se encuentra al final de la página) para obtener las entalpías estándar de formación de cada una de las sustancias que intervienen. Recuerda revisar bien en la tabla tomando en cuenta el estado de agregación de cada una de las sustancias ya que varía la entalpía de formación estándar según el estado de agregación.
Producto:
- ΔH°f (NH4Cl, g) = - 314,5 kJ/mol
Reactivos:
- ΔH°f (NH3, g) = - 45,9 kJ/mol
- ΔH°f (HCl, g) = - 92,3 kJ/mol
∑ n. ΔH°f producto = 1 mol. -314,5 kJ/mol
∑ n. ΔH°f producto = - 314,5 kJ
Repetimos el paso anterior para los reactivos, tomando en cuenta nuevamente los coeficientes estequiométricos.
∑ n. ΔH°f reactivos = (1 mol. - 45,9 kJ/mol) + (1 mol. - 92,3 kJ/mol)
∑ n. ΔH°f reactivos = - 138,2 kJ
Para finalizar utilizamos la siguiente expresión sustituyendo los resultados obtenidos en los pasos anteriores.
ΔH°r = ∑ n. ΔH°f producto - ∑ n. ΔH°f reactivos
ΔH°r = - 314,5 kJ - (- 138,2 kJ) = - 176,3 kJ
![]()
3. Introducción: tetraedro de fuego
Los procesos de combustión consisten en reacciones químicas en las cuales una o más sustancias, que constituyen el combustible, se combinan con otra que actúa como comburente liberando energía en forma de luz y calor.
En el triángulo del fuego se indican las condiciones necesarias para que se produzca la combustión.
Los lados que componen el triángulo del fuego son:
- El combustible: se trata de la sustancia que experimenta la combustión, puede encontrarse en estado sólido, líquido o gaseoso.
- El comburente: se combina con el combustible. En la mayoría de los casos es el dioxígeno.
- La fuente de ignición: suministra la energía necesaria para iniciar la combustión; puede ser una chispa, una fuente de calor, una corriente eléctrica, etc.
Si eliminamos de la combustión cualquiera de los componentes de los lados del triángulo el fuego se apagará. Por lo tanto esta representación es muy útil para explicar cómo podemos extinguir un fuego.
Para que se mantenga la combustión es necesaria una cuarta condición, la reacción en cadena.
Al incluir la reacción en cadena en el esquema del triángulo del fuego obtenemos el tetraedro del fuego. El principio básico es el mismo, todos los elementos indicados en las caras del tetraedro son necesarios para que la combustión se mantenga, si eliminamos cualquiera de ellas el fuego se extinguirá.

El calor que se libera al comenzar la combustión se trasmite al combustible realimentándolo y permitiendo que la reacción continúe.
Observa el siguiente video:
Para extinguir una combustión se puede actuar de diferentes maneras, según las características del combustible y el origen del fuego. Una posibilidad es impedir el contacto entre el combustible y el comburente. La disminución de la temperatura también incide en la reacción en cadena. Para ello se puede emplear agua, arena, una frazada o dióxido de carbono proveniente de un extintor. El agua y el dióxido de carbono tienen la ventaja de impedir el contacto combustible-comburente y de provocar un descenso de la temperatura a la vez. El agua no debe emplearse para extinguir fuegos de origen eléctrico.
3.1. Combustión
![]()
Es una reacción química de oxidación (pérdida de electrones) relativamente rápida que consiste en la reacción de un material combustible con el dioxígeno (comburente), con desprendimiento de energía, que se desarrolla en fase gaseosa o heterogénea.
La rapidez de la combustión depende:
- de la afinidad del combustible con el dioxígeno.
- y de las condiciones en las que se realice la combustión (tiempo, temperatura, entre otras).
Es esencial que los elementos que forman el combustible tengan gran afinidad con el elemento oxígeno. Los elementos carbono e hidrógeno, que forman parte de muchos combustibles, cumplen con este requisito.
![]()
Se puede hablar de dos tipos de combustión: completa e incompleta. A continuación se analizan las características de cada uno de estos procesos.
Una combustión es completa cuando se logra oxidar todo el combustible y se libera toda la energía. En una combustión completa todo el carbono y el hidrógeno, contenidos originalmente en el combustible, se convierten en dióxido de carbono (CO2) y en agua (H2O).
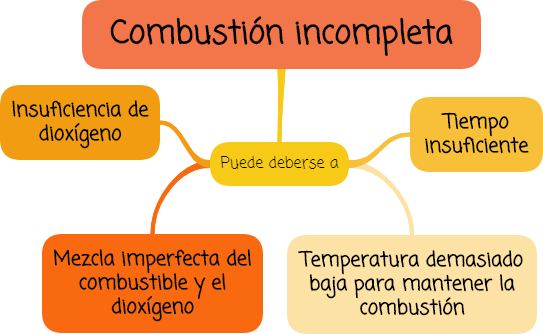
Mientras que en una combustión incompleta pueden emitirse moléculas del combustible sin reaccionar, partículas de carbono que no alcanzan a oxidarse, vapor de agua y, predominantemente, monóxido de carbono (CO).
Una combustión incompleta puede deberse a:
- la insuficiencia de dioxígeno,
- mezcla imperfecta del combustible y el dioxígeno,
- tiempo insuficiente, y
- temperatura demasiado baja para mantener la combustión.
3.2. Las proporciones son importantes
Cuando se quema cualquier combustible que contiene carbono se producen particularmente dos gases considerados contaminantes atmosféricos, el monóxido de carbono (CO) y el dióxido de carbono (CO2) dependiendo de la cantidad de dioxígeno presente durante la combustión.
C (s) + ½ O2 (g) → CO (g) combustión incompleta
C (s) + O2 (g) → CO2 (g) combustión completa
La cantidad de O2 por mol de C que se requiere en la segunda reacción es mayor que en la primera. Por eso, si en el ambiente donde tiene lugar la combustión no hay suficiente O2 para formar CO2, que no es tóxico, se forma CO que sí lo es.

El CO es menos denso que el aire por lo que se acumula en las zonas altas del ambiente. Una vez inhalado se combina con la hemoglobina de la sangre con una facilidad 240 veces mayor que el dioxígeno. Así llega un momento en que no hay suficiente hemoglobina disponible en la sangre para transportar O2 a los tejidos pudiendo ocasionar la muerte.
Los niños son más vulnerables a intoxicarse con CO por tener mayor frecuencia respiratoria y cardíaca, mayor ritmo metabólico y mayor demanda de oxígeno, principalmente en los primeros tres meses de vida.
Según el Ministerio de Salud Pública, nuestro país registra más de 200 intoxicaciones y 20 muertes anuales por esta causa (dato brindado el 14 de julio de 2020).
La Organización Mundial de la Salud (OMS) promueve la detección y medida de los niveles de monóxido de carbono en el aire de las ciudades estableciendo el nivel máximo de CO tolerable en 9 ppm (partes por millón).
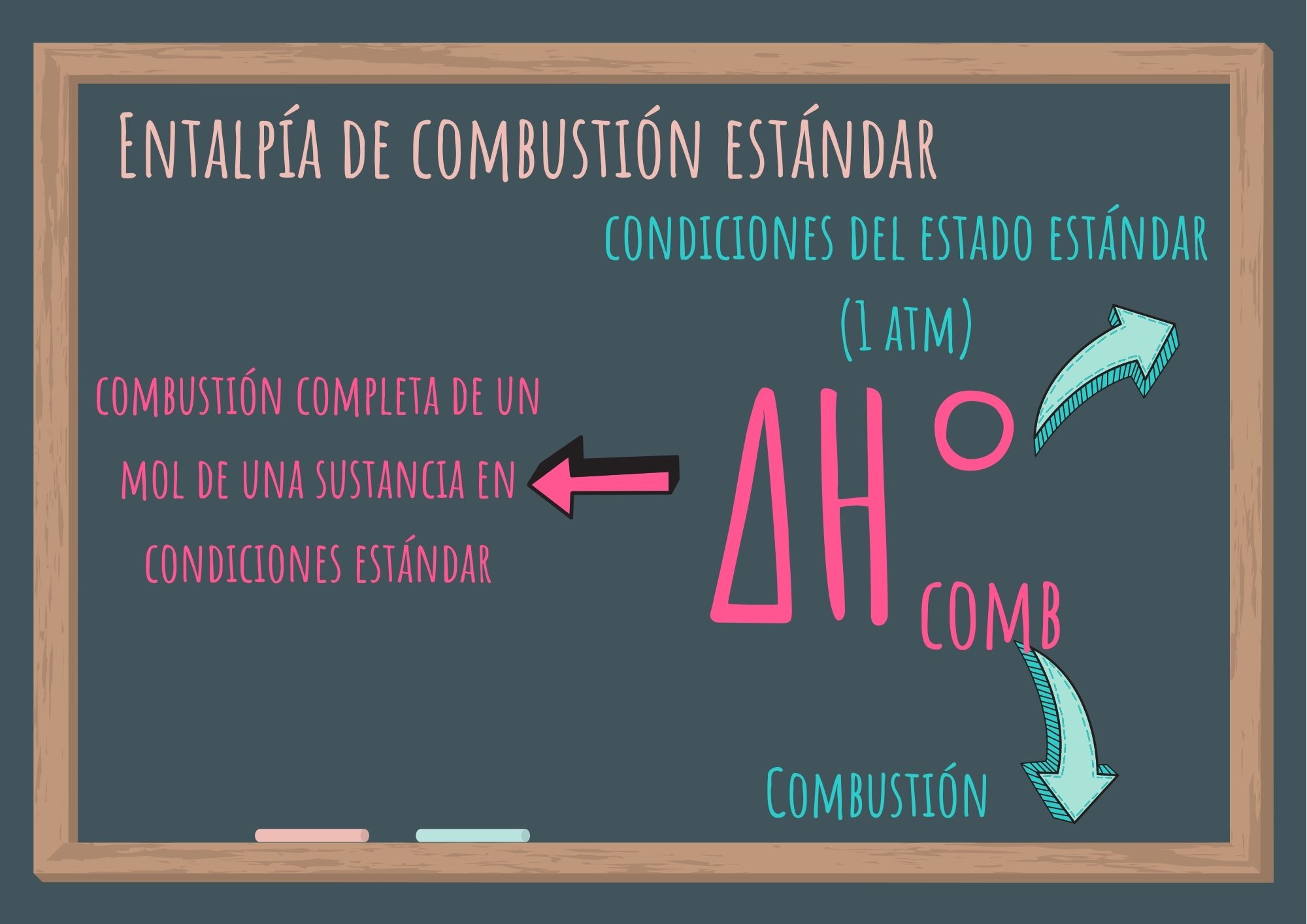
3.3. Entalpía de combustión estándar
![]()
Se denomina entalpía de combustión estándar a la variación de entalpía correspondiente a la combustión completa de un mol de una sustancia en condiciones estándar (presión de 1 atmósfera).
La combustión es un
proceso exotérmico donde se libera energía.
![]()
Se simboliza ΔH°comb: donde el exponente "°" representa las condiciones del estado estándar (1 atm), y el subíndice "comb", significa combustión.
A pesar de que el estado estándar no especifica una temperatura, se suelen utilizar valores de ΔH°comb medidos a 25,0 °C.
![]()
La entalpía de combustión estándar del metano gaseoso (componente del gas natural) es - 890,2 kJ/mol, lo que se representa:
CH4 (g) + 2 O2 (g) → 2 H2O (l) + CO2 (g)
ΔH°comb (CH4) = - 890,2 kJ/mol
La entalpía de combustión estándar del butano gaseoso es - 2657,3 kJ/mol, lo que se representa:
C4H10 (g) + 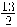 O2 (g) → 5 H2O (l) + 4 CO2 (g)
O2 (g) → 5 H2O (l) + 4 CO2 (g)
ΔH°comb (C4H10) = - 2657,3 kJ/mol
La entalpía de combustión estándar del octano líquido (componente de la gasolina) es - 5107,5 kJ/mol, lo que se representa:
C8H18 (l) + 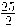 O2 (g) → 9 H2O (l) + 8 CO2 (g)
O2 (g) → 9 H2O (l) + 8 CO2 (g)
ΔH°comb (C8H18) = - 5107,5 kJ/mol
La entalpía de combustión estándar del dodecano líquido (componente del diésel) es - 7514,5 kJ/mol, lo que se representa:
C12H26 (l) + 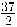 O2 (g) → 13 H2O (l) + 12 CO2 (g)
O2 (g) → 13 H2O (l) + 12 CO2 (g)
ΔH°comb (C12H26) = - 7514,5 kJ/mol
La entalpía de combustión estándar del oleato de metilo líquido (componente del biodiesel) es - 11094,4 kJ/mol, lo que se representa:
C19H36O2 (l) + 27 O2 (g) → 18 H2O (l) + 19 CO2 (g)
ΔH°comb (C19H36O2) = - 11094,4 kJ/mol
La entalpía de combustión estándar del etanol líquido es - 1234,8 kJ/mol, lo que se representa:
C2H6O (l) + 3 O2 (g) → 3 H2O (l) + 2 CO2 (g)
ΔH°comb (C2H6O) = - 1234,8 kJ/mol
![]()
4. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Avella-Moreno, E. (2012). BIOCOMBUSTIBLES, PROMISIÓN O FALACIA. Momento, 44 (35). Recuperado de: https://www.researchgate.net/publication/302891431_BIOCOMBUSTIBLES_PROMISION_O_FALACIA
- Capítulo 3. Química de la combustión. Recuperado de: http://tesis.uson.mx/digital/tesis/docs/4324/Capitulo3.pdf
- Castellan, G. (1998). Físicoquímica. (2da edición). México: Pearson.
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill.
- Masterton, W. y Hurley, C. (2004). Principios y reacciones. (4ta edición). Madrid, España: Thomson.
- MSP. (14 de julio de 2020). Comunicado Monóxido de Carbono. Recuperado de: https://www.gub.uy/ministerio-salud-publica/comunicacion/comunicados/comunicado-monoxido-carbono
- Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012). Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2010). Todo se transforma. Química- 3er Año C.B. Montevideo, Uruguay: Contexto.
- Standard enthalpy of formation. (s.f.). En Wikipedia. Recuperado el 21 de noviembre de 2020 de: https://en.wikipedia.org/wiki/Standard_enthalpy_of_formation#:~:text=The%20standard%20enthalpy%20of%20formation,substances%20in%20their%20standard%20states.
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (Quinta edición). Madrid, España: Mc Graw Hill.
Vídeos, páginas y/o simuladores utilizados:
EVyTIC (Facultad de Derecho) . (2017, junio 1). Tetraedro del Fuego [Archivo de Video]. Youtube. https://streaming.udem.edu.co/media/tetraedro-del-fuego
Las imágenes utilizadas fueron tomadas de:
- Tetraedro. Autor: Kuartas. Licencia: CC BY-SA 3.0.
- Representación molécula de monóxido de carbono. Autor: Benjah-bmm27. Licencia: Dominio Público.
- Representación molécula de dióxido de carbono. Autor: Jacek FH. Licencia: Dominio Público.
- Fuego. Autor: pxhere. Licencia: CC0 Dominio público. Gratis para uso personal y comercial.