¿Qué son la entropía y la energía libre?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué son la entropía y la energía libre? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:52 |
1. Introducción
¿Por qué algunas reacciones tienen tendencia a producirse, mientras que otras no?
Algunas cosas suceden
en forma natural, otras no. El deterioro es natural; la construcción requiere
trabajo. El agua fluye pendiente abajo naturalmente; se la debe bombear
pendiente arriba. Una chispa es suficiente para iniciar un incendio forestal;
se requiere el incesante aporte de energía solar para reconstruir el bosque a
partir de dióxido de carbono y agua. ¿Qué determina la dirección natural del
cambio? ¿Qué impulsa la gran e intrincada red de reacciones en los sistemas
biológicos y da lugar al fenómeno extraordinario llamado vida? La ENTROPÍA nos da una respuesta elegante a estas
preguntas.

1.1. ¿Qué es la entropía?
Observa el siguiente video:
¿Cómo ha evolucionado la definición de la entropía y de la segunda ley de la termodinámica a lo largo de la historia?
1.2. La entropía a lo largo de la historia
Observa el siguiente recurso interactivo (haz clic en los objetos en movimiento):
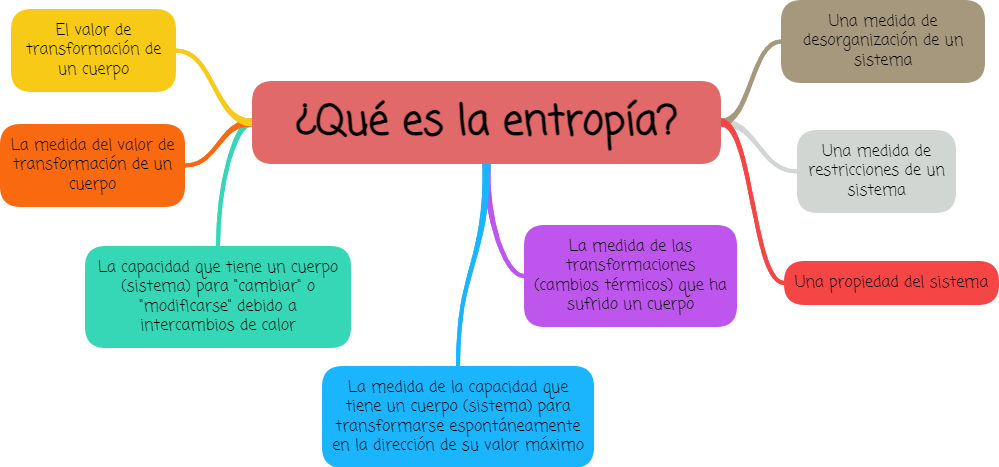
1.3. Definiendo la entropía (S)
![]()
La entropía es una propiedad del sistema, se representa con la letra S.
Si se mantiene la analogía con la energía que siguió el propio Clausius, la entropía puede entenderse como la capacidad que tiene un cuerpo para seguir sufriendo transformaciones.
Las diferentes definiciones de entropía, que se encuentran en el siguiente mapa mental, buscan contemplar los avances de dicho concepto a lo largo de la historia:
2. ¿Qué es una reacción espontánea?
![]()
Una reacción espontánea es aquella que ocurre en determinadas condiciones sin necesidad de ser impulsada por una influencia externa.
![]()
Por ejemplo, el hierro metálico expuesto al agua y dioxígeno se herrumbra, pero este nunca vuelve espontáneamente a convertirse en hierro metálico.

![]()
Una reacción espontánea no significa que sea rápida (la termodinámica no nos informa sobre el tiempo que debe transcurrir para que una transformación se realice). Por ejemplo, la termodinámica predice que la reacción entre el dioxígeno y el dihidrógeno (a 25,0 °C y 1,0 atm de presión) para producir agua es espontánea. Sin embargo, en ausencia de un catalizador o acontecimiento iniciador, como una chispa, la reacción para producir agua no tiene lugar en una cantidad de tiempo medible.
![]()
Los procesos espontáneos a temperatura y presión constantes están acompañados por una disminución de la energía libre de reacción, pero ¿qué es la energía libre?
3. ¿Qué es la energía libre?
![]()
J. Willard Gibbs demostró que, para una reacción que tiene lugar a presión (P) y temperatura (T) constantes, ΔG representa la fracción del cambio de energía total que está disponible (es decir “libre”) para desarrollar trabajo útil.
Si ΔG de una reacción es de - 270 kJ es posible obtener 270 kJ de trabajo útil a partir de la reacción. Si ΔG = + 270 kJ habrá que suministrar al menos esta energía en forma de trabajo.
Depende de reactivos, productos, T, P y concentración, pero no depende del camino por el que ha transcurrido la reacción, por lo que es una función de estado.
![]()

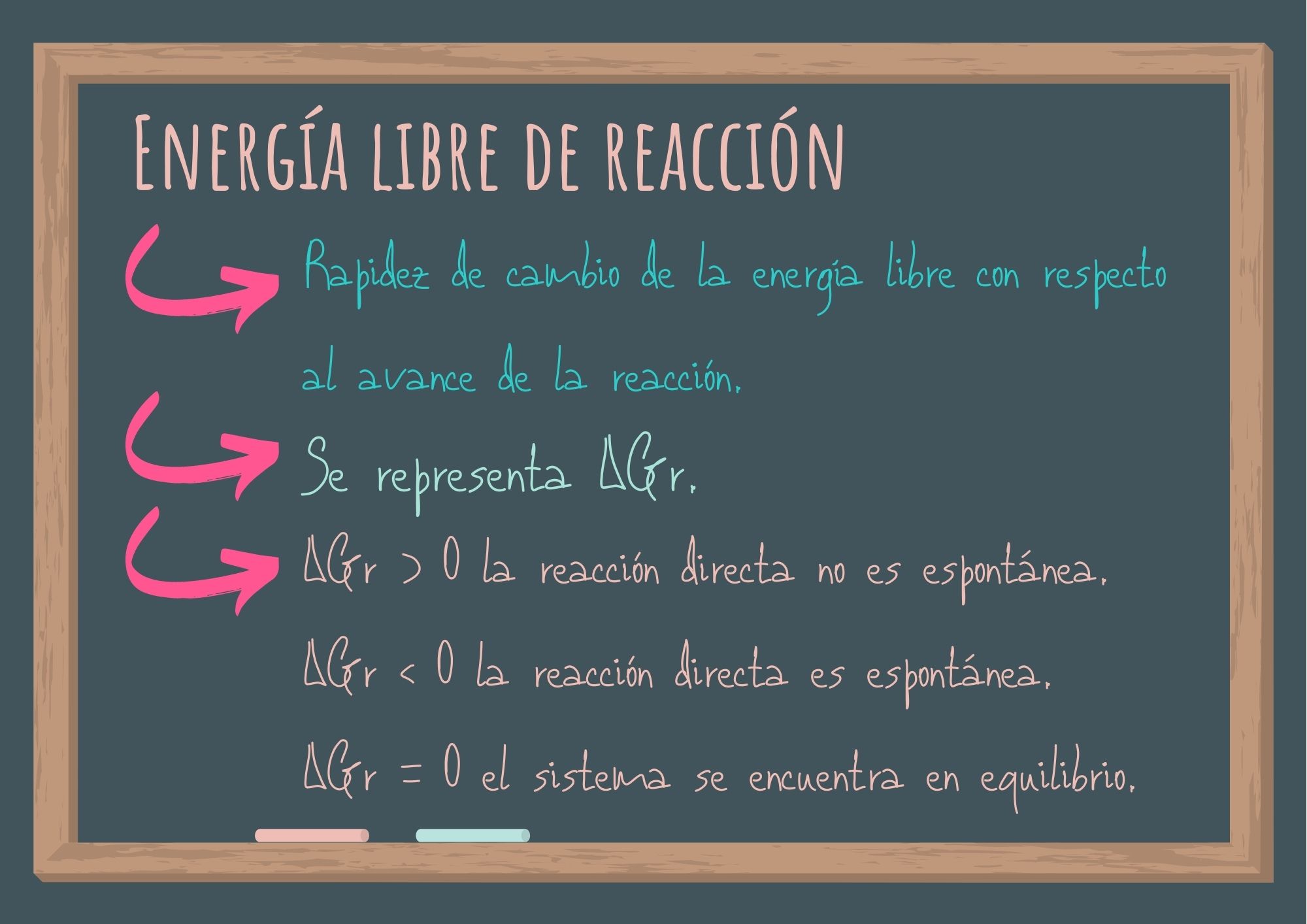
3.1. ¿Qué es la energía libre de reacción?
![]()
Es la rapidez de cambio de la energía libre con respecto al avance de la reacción.
Se representa: ΔGr. Se expresa en kJ/mol. Es una propiedad extensiva (propiedad que depende de la masa).
Si las condiciones son estándar (presión de 1 atmósfera), se habla de ΔG°r o rapidez de cambio de la energía libre estándar,
![]()
A temperatura y presión constantes una reacción es espontánea si ΔGr < 0 y se encuentra en equilibrio si ΔGr = 0.
Si ΔGr > 0 la reacción directa no es espontánea y la reacción inversa a la planteada será permitida.
El signo nos permite predecir el sentido de la reacción química permitida desde el punto de vista termodinámico (reacción espontánea).
![]()
- En condiciones estándar la combustión completa de la glucosa se representa a continuación:
C6H12O6 (s) + 6 O2 (g) → 6 H2O (l) + 6 CO2 (g) ΔG°r = - 2880 kJ/mol
El valor de la energía libre de reacción directa es MENOR a cero por lo que dicha reacción es espontánea.
- La formación del dipéptido alanilglicina se representa a continuación:
Alanina + Glicina → Alanilglicina ΔG°r = + 29 kJ/mol
El valor de la energía libre de reacción directa es MAYOR a cero por lo que dicha reacción NO es espontánea.
![]()
3.2. Para profundizar
![]()
| Representación | ¿Qué representa? | ¿Cómo se calcula? | ¿Qué tipo de magnitud es? | ¿Cuál es su unidad? |
|---|---|---|---|---|
| Energía libre ΔG |
Variación finita de la energía libre entre el estado final (mezcla de equilibrio) y el estado inicial (los reactivos mezclados). |
ΔG = Geq - Greactivos | Extensiva | kJ |
| Energía libre estándar ΔG° |
Variación finita de las energías libres de los productos y de los reactivos cuando no se encuentran mezclados y cada uno está en su estado estándar. | ΔG° = G°productos - G°reactivos | Extensiva | kJ |
| Energía libre de reacción ΔGr |
Rapidez de cambio de la energía libre con respecto al avance de la reacción. El signo nos permite predecir el sentido de la reacción química permitida desde el punto de vista termodinámico (reacción espontánea). Además, si ΔGr = 0, se ha alcanzado la situación de equilibrio químico. |
ΔGr = ΔHr - T. ΔSr | Intensiva | kJ/mol |
| Energía libre de reacción estándar ΔG°r |
Rapidez de cambio de la energía libre estándar. | ΔG°r = ΔH°r - T. ΔS°r | Intensiva | kJ/mol |
4. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Castellan, G. (1998). Físicoquímica. (2da edición). México: Pearson.
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill.
- Flores-Camacho, F. y Ulloa-Lugo, N. (2014). ¿Cómo enseñan la entropía los profesores universitarios? Revista Electrónica de Enseñanza de las Ciencias. 13 (2), 201-221. Recuperado de: http://reec.uvigo.es/volumenes/volumen13/REEC_13_2_5_ex827.pdf
- Masterton, W. y Hurley, C. (2004). Principios y reacciones. (4ta edición). Madrid, España: Thomson.
- Quílez, J. (2009). Análisis de los errores que presentan los libros de texto universitarios de química general al tratar la energía libre de Gibbs. Enseñanza de las ciencias. 27(3), 317–330. Recuperado de: https://www.researchgate.net/publication/39034145_Analisis_de_los_errores_que_presentan_los_libros_de_texto_universitarios_de_quimica_general_al_tratar_la_energia_libre_de_Gibbs
- Ulloa-Lugo, N. (2006). Origen y evolución del concepto de entropía. Representaciones e implicaciones para la enseñanza (Tesis doctoral). Universidad Pedagógica Nacional. México. Recuperado de: http://xplora.ajusco.upn.mx:8080/xplora-pdf/23524.pdf
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (Quinta edición). Madrid, España: Mc Graw Hil.
Vídeos, páginas y/o simuladores utilizados:
Date un Vlog . (2020, febrero 23). HOY SÍ que vas a entender la ENTROPÍA [Archivo de video]. Recuperado de: https://youtu.be/ttjM-dMPddY
Las imágenes utilizadas fueron tomadas de:
- Cascada. Autor: Pxhere. Licencia: Gratis para uso personal y comercial
- Bomba de agua. Autor: Rodolfo Lino. Licencia: CC BY-SA 4.0.
- Incendio forestal. Autor: Contando Estrelas. Licencia: CC BY-SA 2.0.
- Bosque. Autor: Pxhere. Licencia: Gratis para uso personal y comercial
- Hierro herrumbrado. Autor: Waugsberg. Licencia: CC BY-SA 3.0.