¿Qué estudia la cinética química? ¿Qué es la rapidez de una reacción?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué estudia la cinética química? ¿Qué es la rapidez de una reacción? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:57 |
1. Introducción
![]()
El objetivo de la Cinética Química consiste en explorar las leyes que
rigen el cambio de la composición de un sistema en el tiempo y su
relación con las variables que definen su estado, en particular, con la
presión, la temperatura y la composición.
La Cinética es el estudio de la rapidez de las reacciones químicas y los mecanismos (serie de pasos) mediante las cuales tienen lugar.

1.1. ¿Qué es la rapidez de una reacción?
![]()
La rapidez de una reacción describe la rapidez en que se consumen los reactivos y se forman los productos. Es el cambio en la concentración de un reactivo o producto con respecto al tiempo. Una unidad en la que se puede expresar es mol/L.s (mol por litros segundo).
Algunos procesos, como las etapas iniciales de la visión, la fotosíntesis y las reacciones nucleares en cadena, ocurren a una rapidez tan corta como de 10-12s o 10-6s. Otros, como la polimerización del cemento y la conversión del grafito en diamante, necesitan millones de años para completarse.
En un nivel práctico, el conocimiento de la rapidez de las reacciones es de gran utilidad para el diseño de fármacos, en el control de la contaminación y en el procesamiento de alimentos. Con frecuencia los químicos industriales ponen más énfasis en el aceleramiento de la rapidez de una reacción que en mejorar su rendimiento.
Existen parámetros que influyen en la rapidez que permiten ajustar los valores de las variables de modo de obtener – en el laboratorio o en un proceso industrial – los productos que interesan en tiempos razonables. No basta con conocer si un proceso químico es espontáneo o no pues puede ocurrir en un segundo o en cientos de años. Por eso es imprescindible saber a qué rapidez sucede.

1.2. ¿Velocidad o rapidez de una reacción?
![]()
Velocidad y rapidez son dos magnitudes que con frecuencia se confunden.
Aclaremos algunos términos desde la Física:
La velocidad es una magnitud vectorial, tiene módulo, dirección y sentido. El módulo de la velocidad se puede determinar como el desplazamiento del cuerpo, magnitud vectorial, dividido un intervalo de tiempo. Si el intervalo de tiempo es muy pequeño se denomina velocidad instantánea.
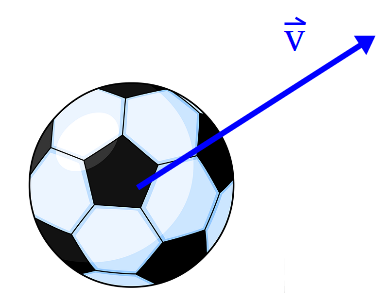
La rapidez, es una magnitud escalar, por lo tanto no tiene en cuenta la dirección ni el sentido del movimiento. Es la distancia recorrida por un cuerpo, magnitud escalar, dividido por el intervalo de tiempo. Si el intervalo de tiempo es muy pequeño se denomina rapidez instantánea. El velocímetro de un vehículo (automóvil, moto, camión, etc.) nos informa la rapidez instantánea del mismo, no nos dice nada sobre la dirección y el sentido del movimiento.
Desde el punto de vista de la Química:
En una reacción química, interesa saber la relación del cambio de la concentración de un reactivo o producto con respecto al tiempo, no es necesario una magnitud vectorial. Por esta razón en Química se habla de rapidez de reacción. De todas formas es común que muchos libros, sitios, revistas, no hagan esta diferencia y hablen de velocidad de reacción.
1.3. Cinética y termoquímica
En el estudio de la termoquímica aprendiste a valorar si una reacción en particular es favorable. La cuestión de si una reacción ocurre en cierto período de tiempo viene determinada por la cinética. Si una reacción no es favorable termodinámicamente, no se producirá de manera apreciable en una determinadas condiciones. Aunque una reacción sea termodinámicamente favorable, puede producirse, pero no necesariamente a una rapidez medible.
![]()
Las reacciones de ácidos fuertes con bases fuertes son termodinámicamente favorables y se producen a una rapidez muy grande. Considera, por ejemplo, la reacción de una solución de ácido clorhídrico con hidróxido de magnesio sólido. Es termodinámicamente espontánea en condiciones normales como lo indica el valor de la energía libre de reacción (ΔG°r). También se produce rápidamente.
2 HCl (ac) + Mg(OH)2 (s) → MgCl2 (ac) + 2 H2O (l) ΔG°r = - 97 kJ/mol
Esta es una de las reacciones que se producen en el sistema digestivo humano cuando un antiácido que contiene hidróxido de magnesio relativamente insoluble neutraliza exceso de ácido estomacal.

![]()
La reacción del diamante con dioxígeno también es espontánea:
C (diam) + O2 (g) → CO2 (g) ΔG°r = - 397 kJ/mol
Sin embargo, sabemos por experiencia que los diamantes expuestos al aire, aun en períodos prolongados, no reaccionan para formar dióxido de carbono. La reacción no tiene lugar a una rapidez observable próxima a la temperatura ambiente. Esta observación se explica mediante la cinética, pero no mediante la termodinámica.

2. ¿Cómo se calcula la rapidez de una reacción?
![]()
Se puede representar una reacción con la siguiente ecuación general:
Reactivos → Productos
Durante el transcurso de una reacción, los reactivos se transforman en productos. Es posible seguir el progreso de una reacción al medir, ya que la disminución en la concentración de los reactivos o el aumento en la concentración de productos.
Analicemos una reacción sencilla en donde las moléculas de A se convierten en moléculas de B.
A → B
La siguiente figura muestra lo que ocurre al transcurrir el tiempo.
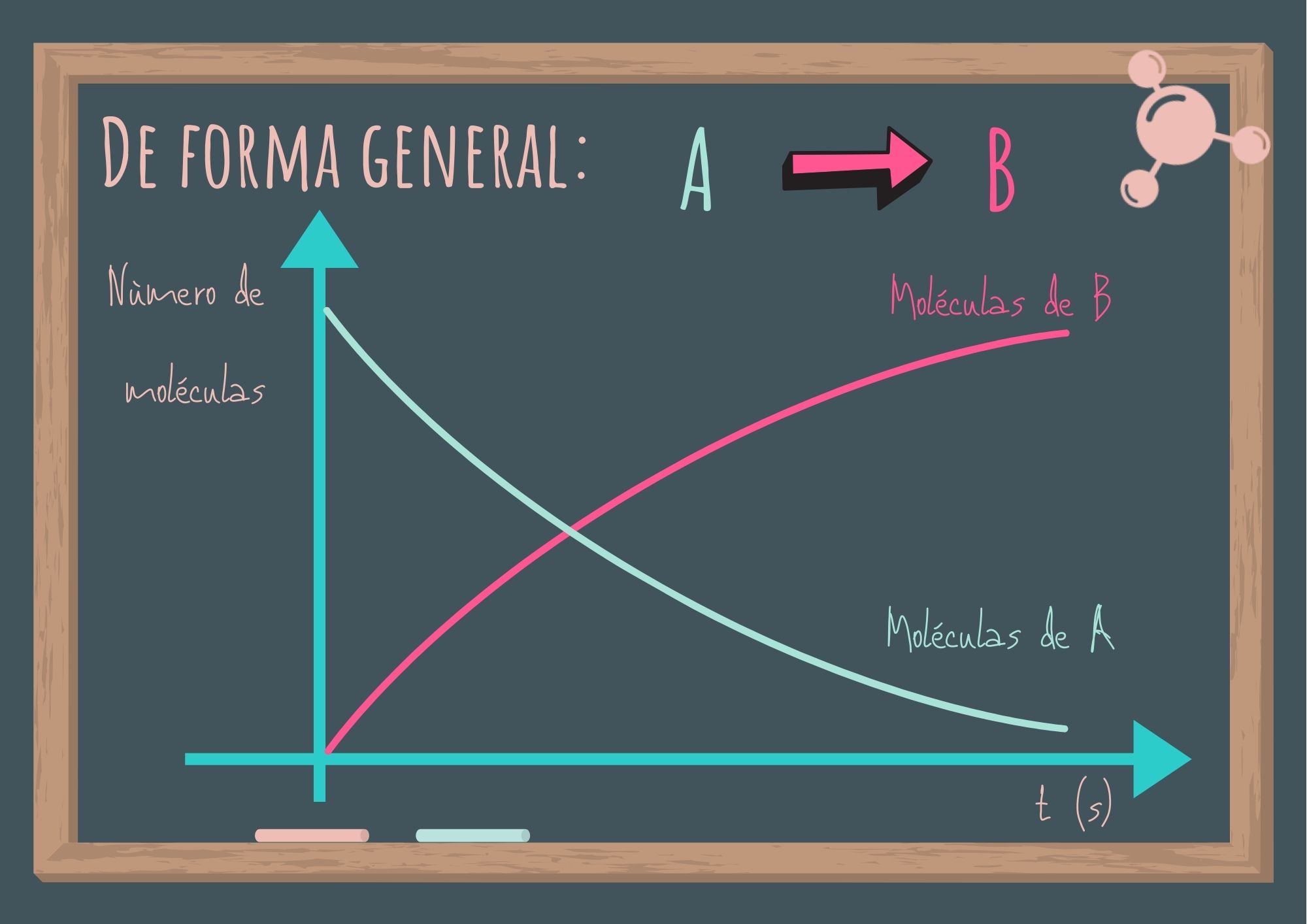
Se observa que el número de moléculas de A va disminuyendo mientras que el número de moléculas de B va aumentando. En general es más conveniente expresar la rapidez de reacción en términos del cambio en la concentración con respecto al tiempo. Para la reacción A → B, la rapidez se expresa:
r = - Δ[A] r = Δ[B]
Δt Δt
Donde Δ[A] y Δ[B] son los cambios en la concentración de A y de B respectivamente en un determinado período de tiempo (Δt).Debido a que la concentración de A disminuye durante el intervalo de tiempo, Δ[A] es una cantidad negativa. Como la rapidez de una reacción es un valor positivo (ya que describe la reacción en sentido directo, de izquierda a derecha) se utiliza el opuesto de la variación en la concentración de A, o sea - Δ[A], obteniéndose así un valor de rapidez positivo.
Esta rapidez corresponde a la rapidez promedio porque representa el promedio en un cierto intervalo de tiempo (Δt).
3. Determinación de la variación de la concentración
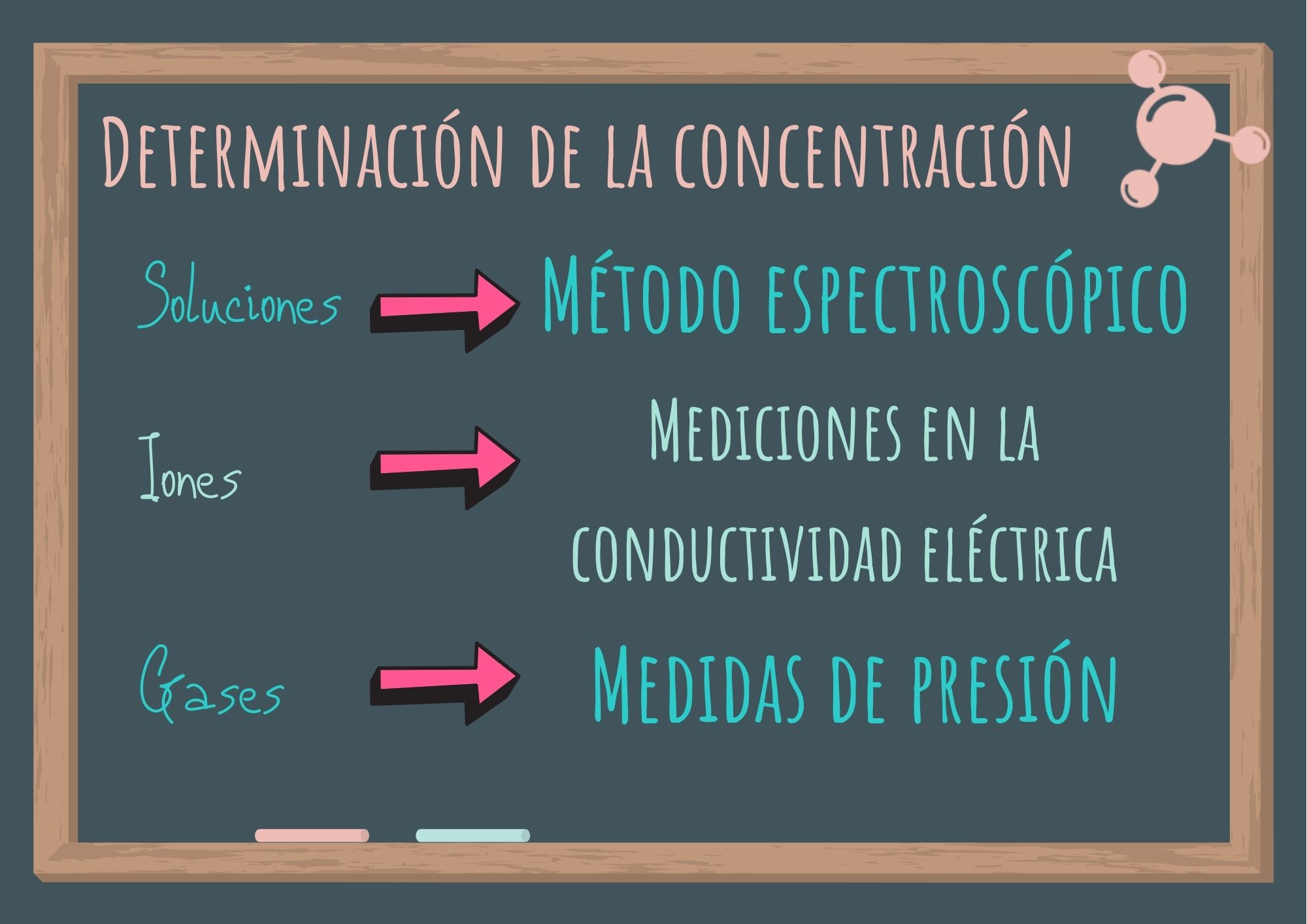
Para determinar la variación de la concentración:
- si es una solución se utilizan métodos espectrosópicos,
- si hay iones se realizan mediciones de la conductividad eléctrica y
- si hay sustancias gaseosas se llevan a cabo medidas de presión.
3.1. Ejemplo 1
![]()
Un ejemplo, el dibromo acuoso (de color anaranjado) reacciona con el ácido metanoico (conocido comúnmente como ácido fórmico ya que se encuentra presente en las hormigas) formándose aniones bromuro (incoloros), cationes hidrógeno y dióxido de carbono gaseoso. La siguiente ecuación representa dicho proceso:
Br2 (ac) + HCOOH (ac) → 2 Br-
(ac) + 2 H+
(ac) + CO2 (g)
En la imagen anterior puedes observar cómo varía la coloración de la muestra al transcurrir el tiempo.
En colorimetría se mide la intensidad del color de una solución como el dibromo acuoso de color anaranjado. Para ello se coloca en un tubo una solución de dibromo de concentración conocida con ácido metanoico en exceso y se coloca en un espectrofotómetro (imagen superior que se encuentra a continuación) o en un fotocolorímetro (imagen inferior).

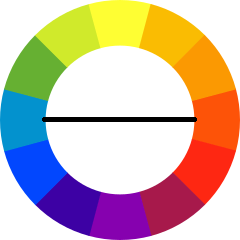
En el caso del fotocolorímetro está formado por una lámpara que emite luz blanca, en todas las longitudes de onda, dicha luz pasa por una rendija que produce un haz estrecho que pasa por un filtro para permitir que solamente la luz de una longitud de onda específica pase. ¿Cómo seleccionar el color del filtro? Se selecciona el color complementario al color de la solución (recuerda que el color que observamos es el color que no absorbió el sistema y es reflejado por el mismo), en este caso el color complementario al anaranjado es el azul. En la siguiente figura puedes ver cuáles son los colores complementarios.
Inicialmente debido a la alta concentración de dibromo una gran cantidad de luz azul es absorbida por la muestra y la cantidad de luz que atraviesa la muestra es baja por lo que la señal detectada por el fotocolorímetro es baja. Al avanzar la reacción disminuye la concentración de dibromo [Br2] y su color se desvanece. Cuanto mayor sea la cantidad de luz absorbida por la muestra es directamente proporcional a la concentración del dibromo acuoso. Con estos datos se puede calcular la rpromedio (r: rapidez):
rpromedio = - [Br2]final - [Br2]inicial / tfinal - tinicial
Al calcular la rpromedio a intervalos cada vez más cortos se obtiene la rinstantánea (ri).
La rapidez también depende de la concentración de ácido metanoico o
fórmico (HCOOOH). Sin embargo, al agregarlo en exceso a la mezcla se puede asegurar que la concentración de ácido metanoico permanece prácticamente constante durante el transcurso de la reacción. El cambio en la cantidad de
ácido no tiene efecto en la rapidez medida.
Cuadro de datos obtenidos de realizar la actividad experimental:
| t (s) | [Br2] (mol/L) | r (mol/L.s) | k = r /[Br2] (1/s) |
|---|---|---|---|
| 0,0 | 0,01200 | 4,20 . 10-5 | |
| 50,0 | 0,01010 | 3,52 . 10-5 | |
| 100,0 | 0,00846 | 2,96 . 10-5 | |
| 150,0 | 0,00710 | 2,49 . 10-5 | |
| 200,0 | 0,00596 | 2,09 . 10-5 | |
| 250,0 | 0,00500 | 1,75 . 10-5 | |
| 300,0 | 0,00420 | 1,48 . 10-5 | |
| 350,0 | 0,00353 | 1,23 . 10-5 | |
| 400,0 | 0,00296 | 1,04 . 10-5 |
- Calcula el valor de la última columna (k). ¿Qué puedes decir al respecto?
- Construye una gráfica de la concentración de dibromo acuoso en función del tiempo.
- Busca información sobre cómo se puede calcular la rapidez a partir de la gráfica anterior.
- Construye también una gráfica de la rapidez en función de la concentración de dibromo acuoso.
- ¿Qué puedes concluir al respecto de la segunda gráfica?
3.2. Ejemplo 2
![]()
Analicemos la reacción de saponificación del acetato de etilo (éster) con una solución de hidróxido de sodio.
A continuación se representa dicho cambio con una ecuación química:
| CH3COOCH2CH3 (ac) | + | NaOH (ac) | → | CH3COONa (ac) | + | CH3CH2OH (ac) |
| acetato de etilo | hidróxido de sodio | acetato o etanoato de sodio |
etanol |
Conforme transcurre la reacción se produce una variación de la conductividad de la solución debido al cambio de los iones presentes en la mezcla reactante.
La conductividad de una solución de acetato de etilo es casi mil veces inferior a la de una solución de hidróxido de sodio de la misma concentración y a la misma temperatura. Es decir, podemos asociar la variación de la conductividad de la mezcla reactante a la disminución de la cantidad de hidróxido de sodio, al disminuir su concentración disminuye la conductividad de la solución.
De esta forma, podemos determinar la concentración de hidróxido de sodio en cada momento a partir de la medida de la conductividad y de la ecuación de calibrado del conductímetro a la temperatura de operación.
Por otra parte, la conductividad eléctrica es una propiedad física muy dependiente de la temperatura. Por ello debemos evitar gradientes de temperatura y procurar que la temperatura de reacción permanezca constante.
Observa estos aspectos en el siguiente video:
4. Finalizando...
![]()
Observa el siguiente video (en inglés) que aborda varios de los conceptos trabajados en este módulo:
Recuerda activar los subtítulos y traducirlos al español, puedes repasar cómo hacerlo en el siguiente enlace.
5. Créditos
Autoría de los materiales utilizados: Profesoras Silvia Pedreira y Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- UAM (2011). Cinética. Fundamentos de Química, Grado en Física. Recuperado de: http://www.qfa.uam.es/labqui/presentaciones/Tema4.pdf
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (Quinta edición). Madrid, España: Mc Graw Hill.
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill
- Masterton, W. y Hurley, C. (2004). Principios y reacciones. (4ta edición). Madrid, España: Thomson.
- Castellan, G. (1998). Físicoquímica. (2da edición). México: Pearson.
- Laboratorio de Ingeniería Química. (s.f.). Hidrólisis del Acetato de Etilo. Estudio de la cinética del proceso en un RDTA. Departamento de Ingeniería Química. Recuperado de: https://www.uv.es/idiqlab/labquimicos/documentos/RDTA.pdf
- Boomerchemistry. (2015, 6 de abril). Experimentally determining rates of reaction. [Archivo de video]. Recuperado de: https://youtu.be/2z2Zkf5Vfgo
- University of Birmingham. (2016, 7 de octubre). Rates of reaction. [Archivo de video]. Recuperado de: https://youtu.be/tV81SwRpMj8
- Valentín Alba Aparicio. (2018, 19 de junio). Q.F. - Experimento 2. Cinética por Conductividad. Obtención de la constante de velocidad de la saponificación del acetato de etilo. Serie: Introducción a la experimentación en química-física y química analítica. [Archivo de video]. Recuperado de: https://canal.uned.es/video/5b30a715b1111f5c678b4567
- Diamante 1. Autor: Mario Sarto. Licencia: CC BY-SA 3.0,
- Diamante 2. Autor: antonio_rh. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Ojo humano. Autor: ROTFLOLEB. Licencia: CC BY-SA 3.0.
- Hoja verde. Autor: Pixnio. Licencia: Uso personal y comercial (CC0).
- Bomba atómica. Autor: WikiImages. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Cemento. Autor: Pxhere. Licencia: CC0 Dominio público. Gratis para uso personal y comercial.
- Remedios. Autor: Val-gb. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Reflugel. Autora: Anarella Gatto. Licencia: CC BY-SA 4.0.
- Vector velocidad. Autor: Dnu72. Licencia: CC BY-SA 3.0.
- Dibromo acuoso y ácido metanoico. https://docplayer.es/42139640-Cinetica-de-oxidacion-de-etanol-por-cr-vi.html
- Colores complementarios. Autor: Sakurambo. Licencia: CC BY-SA 3.0.
- Icono molécula. Autor: Freepik. Licencia: Gratis para uso personal o comercial con atribución.
- Espectrofotómetro y fotocolorímetro. Autora: Anarella Gatto. Licencia: CC BY-SA 4.0.
- Pelota de fútbol. Autor: Félix Mendoza. Licencia de Pixabay.