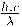Introducción: interacción materia y energía, concentración y absorbancia
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Creación de recursos en Ciencias |
| Libro: | Introducción: interacción materia y energía, concentración y absorbancia |
| Imprimido por: | Invitado |
| Día: | miércoles, 2 de abril de 2025, 20:12 |
Tabla de contenidos
1. Espectro electromagnético
Los métodos fotométricos, que vamos a analizar, son aquellos que implican la interacción entre la materia y la radiación electromagnética.
![]()
La luz tiene un carácter dual, es decir, se comporta como onda y como partícula.
Observa el siguiente video:
Las ondas luminosas son una especie de radiación electromagnética y están formadas por campos magnéticos y eléctricos oscilantes perpendiculares entre sí. Como toda onda está caracterizada por una longitud de onda (λ), una frecuencia (ν) y una velocidad de propagación (c), la velocidad de la luz (3,0 x108 m/s).
Estas tres variables se relacionan: c = λ . ν
Desde el punto de vista energético, es más conveniente considerar la luz como formada por partículas llamadas fotones. Cada fotón tiene una energía determinada que está dada por:
Siendo h la constante de Planck (6,62 x 10-34 J/s). Esta ecuación muestra la relación directamente proporcional que existe entre la energía y la frecuencia de una radiación electromagnética.
![]()
Se denomina espectro electromagnético a la distribución energética del conjunto de las ondas electromagnéticas. El espectro electromagnético se extiende desde la radiación de menor longitud de onda, como los rayos gamma y los rayos X, pasando por la radiación ultravioleta, la luz visible y la radiación infrarroja, hasta las ondas electromagnéticas de mayor longitud de onda, como son las ondas de radio.
Representación del espectro electromagnético:

Espectro visible:
Cuando la luz blanca se hace pasar a través de un prisma, se produce un espectro continuo, o arcoíris de colores. Lo mismo sucede cuando la luz del sol atraviesa una gota de lluvia. Los diferentes colores de la luz representan longitudes de onda distintas. La longitud de onda de la luz azul es menor que la de la luz roja, pero no hay una transición abrupta al pasar de un color al siguiente. En un espectro continuo están presentes todas las longitudes de onda. La luz blanca no es otra cosa que la combinación de todos los colores.
En esta figura se destaca la zona visible del espectro electromagnético.

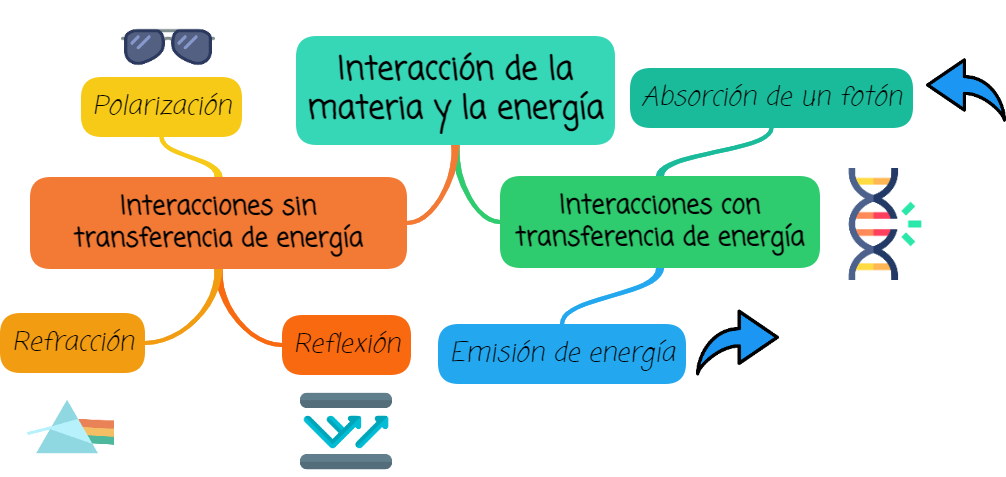
2. Interacción de la materia y la energía
Todos los métodos ópticos se pueden clasificar en función de la interacción de materia y radiación en:
- Interacciones sin transferencia de energía, como por ejemplo polarización, refracción, reflexión, entre otros.
- Interacciones con transferencia de energía dentro de las cuales podemos encontrar:
a) absorción: la absorción de un fotón lleva a un átomo o molécula a un nivel de energía superior (excitado), y cuando vuelve al estado fundamental se produce una emisión de energía, ya sea en forma de calor, luz, etc.
b) emisión: la absorción de energía por parte de un átomo, lo lleva a un nivel energético superior y, volviendo a su estado de menor energía o fundamental, emite un fotón cuya energía y longitud de onda dependen de las transiciones energéticas en cuestión.
Conviene aclarar que el contenido energético de un átomo o molécula no está dado sólo por interacciones energéticas de los electrones, sino también por su movimiento (vibraciones o rotaciones, por ejemplo).
![]()
2.1. Interacción moléculas y luz
![]()
Parte 1 - Predicciones
- ¿Qué piensas que ocurrirá cuando una molécula es incidida por un fotón?
- ¿Existen diferencias según la energía del fotón? ¿Cómo lo explicas?
Parte 2 - Experimentando
Visita el siguiente enlace para acceder al simulador.
- Selecciona una de las moléculas que aparecen en el menú que se encuentra a la derecha.
- Selecciona una linterna que emita microonda.

- Enciende la linterna y observa que ocurre con dicha molécula.
- Registra tus observaciones en la siguiente tabla.
- Cambia por la linterna infrarrojo y repite los pasos anteriores.
- Luego haz lo mismo con las linternas visible y ultravioleta.
- Al finalizar con esa molécula, selecciona otro tipo de molécula en el menú.
- Repite todos los pasos anteriores.
Tabla de observaciones:
| Molécula | Fórmula química | Microonda | Infrarrojo | Visible | Ultravioleta |
|---|---|---|---|---|---|
| Monóxido de carbono | |||||
| Dinitrógeno | |||||
| Dioxígeno | |||||
| Dióxido de carbono | |||||
| Metano | |||||
| Agua | |||||
| Dióxido de nitrógeno | |||||
| Ozono |
Parte 3 - Analizando los datos
- Plantea una ecuación que represento lo ocurrido en el caso del ozono con la radiación ultravioleta.
- ¿Existen similitudes y diferencias entre lo observado? ¿Cómo lo explicas?
- ¿A qué conclusiones llegas?
- Selecciona una de las siguientes temáticas e indica la relación con el tema del experimento: funcionamiento de un microondas, calentamiento global o disminución de la concentración de ozono.
Parte 4 - Revisando las predicciones
- Luego de realizar el experimento, ¿cambias alguna de tus respuestas en la parte 1? Si así es, ¿cómo lo explicas?
Sube tus respuestas en el siguiente enlace.
3. Transmitancia versus absorbancia
![]()
Cuando una muestra absorbe luz, la potencia radiante (energía por segundo por unidad de área del haz) disminuye. Es decir, cuando la luz monocromática de potencia P0 incide sobre una muestra de espesor l, la potencia del haz emergente es P, siendo P0 ≥ P.
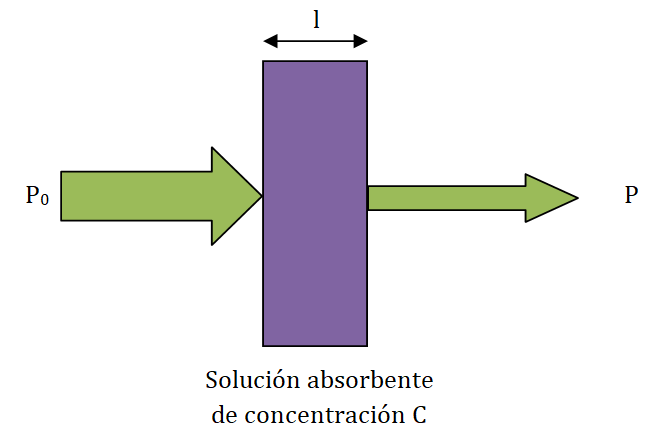
De esta forma se define una nueva magnitud, la transmitancia (T), que es la fracción de luz incidente que sale de la muestra:
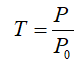
Por lo tanto, la transmitancia varía de cero a uno.
El porcentaje de transmitancia (% T) varía de cero a cien por ciento y se define:
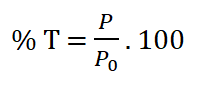
![]()
Una magnitud física más útil de trabajar es la Absorbancia (A), magnitud adimensional (que no tiene unidades),
Se define como el opuesto al logaritmo de la transmitancia: A = - log T.
Como la transmitancia se calcula con la expresión T = P/P0, entonces se puede decir que la absorbancia es: A = - log P/P0.
Aplicando propiedades de logaritmos es posible simplificar la expresión de la siguiente manera:
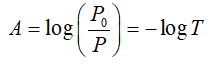
Entonces, A = 0 cuando no se produce absorción de luz.
3.1. ¿Qué factores afectan la absorbancia de una muestra?
![]()
Objetivo: Estas actividades buscan analizar los diferentes factores que afectan la absorbancia y su relación.
Contenidos: Soluciones, luz, muestra, concentración, absorbancia, Ley de Lambert-Beer.
Parte 1 - Predicciones
- ¿Qué piensas que ocurrirá al hacer llegar un haz de luz a una muestra incolora? ¿Y si la muestra es coloreada?
- ¿Qué relación hay entre el color de una muestra y su concentración?
- ¿Qué imaginas que ocurrirá con la cantidad de luz absorbida al variarse la concentración de la muestra coloreada?
Contesta las preguntas de forma individual y luego comparte tus predicciones con otro compañero del grupo.
Parte 2 - Experimentando
Visita el siguiente enlace para acceder al simulador.
Actividad 1: Relación entre concentración y absorbancia- Entra a la ventana ley de Beer.
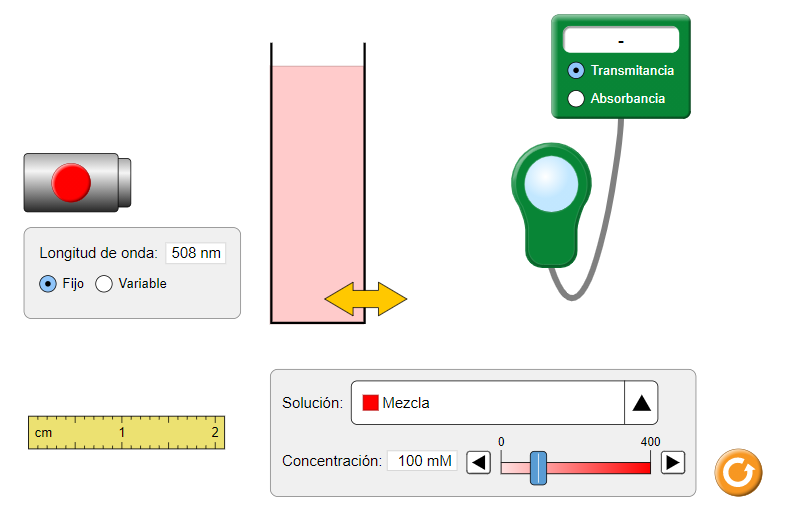
- Selecciona la opción absorbancia.
- En el menú desplegable, busca una solución de sulfato de cobre (II).
- Verifica que la longitud de onda es de 780 nm para el caso de la solución de sulfato de cobre (II). De lo contrario, para seleccionar la longitud de onda de trabajo haz clic en variable y con el cursor elige el valor deseado.
- Enciende el haz luminoso.
- Deja fijo el espesor o camino óptico de la celda. Registra su valor.
- Ajusta a 0 mM (mili molar) la concentración y mide la absorbancia.
- Repite los pasos anteriores eligiendo las siguientes concentraciones: 20, 40, 80 y 100 mM.
- Registra tus datos en la siguiente tabla.
| Concentración C (mM) |
Absorbancia A |
|---|---|
| 0 | |
| 20 | |
| 40 | |
| 80 | |
| 100 |
- Construye la gráfica de absorbancia en función de la concentración.
- Determina la curva de mejor ajuste.
- ¿Cuál es la concentración de una solución problema de sulfato de cobre (II) si su absorbancia es 0,025?
- Expresa la concentración anterior en ppm (partes por millón) y g/L.
- ¿Cuáles son las variables independiente, dependiente y de control en la actividad?
- ¿Cuál es la pregunta investigable que se quiere contestar?
- En conclusión, ¿cuál es la relación matemática entre la absorbancia y la concentración de una solución?
Actividad 2: Relación entre camino óptico de la celda y absorbancia
- Entra a la ventana ley de Beer nuevamente.
- Selecciona la opción absorbancia.
- En el menú desplegable, busca una solución de sulfato de cobre (II).
- Para seleccionar la longitud de onda de trabajo haz clic en variable y con el cursor elige 620 nm.
- Enciende el haz luminoso.
- Deja fija la concentración de la solución en 100 mM.
- Lleva al mínimo el espesor o camino óptico de la celda moviendo la flecha amarilla.
- Mide el camino óptico con la ayuda de la regla y registra su valor.
- Mide la absorbancia.
- Ajusta el camino óptico a 0,8 cm y registra nuevamente la absorbancia.
- Repite los pasos anteriores eligiendo los siguientes caminos ópticos: 1,0, 1,5 y 2,0 cm.
- Registra tus datos en la siguiente tabla.
| Camino óptico l (cm) | Absorbancia A |
|---|---|
| Inicial: | |
| 0,8 | |
| 1,0 | |
| 1,5 | |
| 2,5 |
- Construye la gráfica de absorbancia en función del camino óptico.
- Determina la curva de mejor ajuste.
- ¿Cuáles son las variables independiente, dependiente y de control en la actividad?
- ¿Cuál es la pregunta investigable que se quiere contestar?
- En conclusión, ¿cuál es la relación matemática entre la absorbancia y el camino óptico de la celda?
Parte 3 - Revisando las predicciones
- Luego de realizar el experimento, ¿cambias alguna de tus respuestas en la parte 1? Si así es, ¿cómo lo explicas?
Sube tus respuestas en el siguiente enlace.
3.2. Ley de Bouguer-Lambert-Beer
![]()
El aspecto fundamental de la absorbancia está relacionado a su proporcionalidad directa con la concentración de la especie absorbente en la muestra. Esto está planteado en la ley de Bouguer-Lambert-Beer. También se conoce como la ley de Lambert-Beer. Fue propuesta de formas diferentes e independientes en primer lugar por el matemático y astrónomo francés Pierre Bouguer en 1729. Luego por el filósofo y matemático alemán, Johann Heinrich Lambert en 1760, y por último el físico y matemático también alemán, August Beer en el año 1852. Se puede decir que esta ley se trata de un método matemático, que es utilizado para expresar de qué modo la materia absorbe la luz.

Retratos de Bouger, Lambert y Beer.
La ley afirma que la totalidad de luz que emana de una muestra puede disminuir debido a tres fenómenos:
1. El número de materiales de absorción en su trayectoria, lo cual se denomina concentración.
2. Las distancias que la luz debe atravesar a través de la muestra. Denominamos a este fenómeno, distancia del camino óptico.
3. Las probabilidades que hay de que el fotón de esa longitud particular de onda pueda absorberse por el material. Esto es la constante de proporcionalidad.
A = ε . l . C
Donde:
- A: absorbancia.
- ε: constante de proporcionalidad, denominada absortividad molar, cuyas unidades son L/mol.cm (M-1.cm-1). Es característica de cada sustancia e indica cuánta luz se absorbe a una longitud dada.
- l: camino óptico o espesor de la celda expresada en cm.
- C: concentración de la solución expresada en mol/L.
![]()
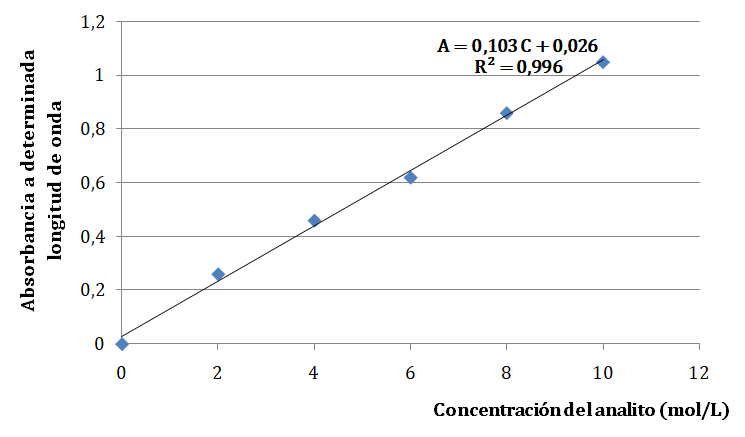
Si se sigue la ley de Bouguer-Lambert-Beer y l se mantiene constante, la gráfica de A = f (C) da una recta que pasa por el origen como puedes observar en la siguiente imagen.
La absorbancia es la variable medida o dependiente y la concentración (expresada en mol/L) la variable independiente o modificada. De la gráfica se obtiene la ecuación de la recta de mejor ajuste por el método de mínimos cuadrados, en este caso y = 0,103 x + 0,026. Luego se cambia la notación de y por la absorbancia, y la notación de x por la concentración.
En el siguiente ejemplo la ecuación es A = 0,103 C + 0,026. Si se desea conocer la concentración de la muestra problema se puede medir su absorbancia y luego sustituir ese valor en la ecuación anterior despejando la concentración.
![]()

3.3. Limitaciones de la aplicabilidad de la Ley de Bouguer-Lambert-Beer
Existen diversas razones por la cual la ley de Bouguer-Lambert-Beer no se cumple, por lo tanto afectan a los resultados y la gráfica deja de ser una recta.
Algunos de estos factores pueden ser:
![]()
- Que
la luz no sea monocromática.
- Originados por radiación parásita (ejemplo luz ambiente, etc.).
- Efectos de la reflexión de la cubeta.
![]()
- Efecto de la temperatura.
- Evaporación del solvente.
- Presencia de radiación emitida por fluorescencia.
- Descomposición fotoquímica del analito.
- Falta de limpieza en las cubetas.
- Presencia de materiales en suspensión (efecto Tyndall).
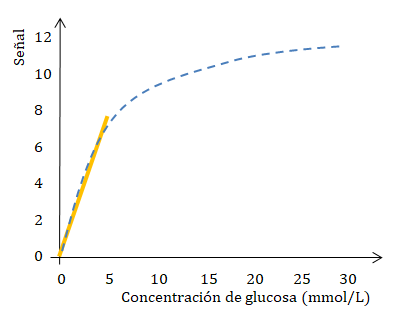
- Que las soluciones sean muy concentradas, por lo que las partículas de soluto empiezan a interactuar entre sí, cambiando las propiedades eléctricas. Estas interacciones pueden alterar la capacidad absorbente de las partículas respecto a una radiación de determinada longitud de onda. Dado que el grado de interacción depende de la concentración, la existencia de este fenómeno causa desviaciones de la relación lineal entre la absorbancia y la concentración.
Como se puede observar en la siguiente gráfica la linealidad (representada con la línea de color amarillo) se mantiene a concentraciones menores a 0,01 mol/L (o 10 mmol/L) aproximadamente. Al ir aumentando la concentración de la solución, la gráfica deja de ser una recta (representada con la línea punteada de color azul).
- Que hayan cambios en la naturaleza de las especies absorbentes o en las propiedades de la solución; por ejemplo ionización, disociación, etc.
Ejemplo: debidas a reacciones del absorbente con el solvente, como en el caso del dicromato en soluciones no amortiguadas.
Cr2O72- + H2O ⇄ 2 H+ + 2 CrO42-
Para cualquier longitud de onda la absortividad molar del ion dicromato y del cromato son diferentes.
![]()
En la práctica se considerará que aquellos factores no específicos como la reflexión en la superficie del recipiente o dispersión en el medio, permanecen constantes de tal forma que la disminución de la intensidad o potencia de haz de luz es debido a las partículas absorbentes localizadas en el camino óptico. Esta disminución de la intensidad de la luz depende del número y del tamaño de dichas partículas.
3.4. Barrido espectral o de longitudes de onda
Cuando se pretende determinar espectrofotométricamente la concentración de una sustancia problema en un medio líquido, es imprescindible conocer las longitudes de onda a las que esta sustancia es capaz de absorber energía de una forma considerable.
Esto se debe a que si se hace incidir, sobre la solución de la sustancia problema, un haz luminoso de una longitud de onda a la que esta sustancia casi no absorbe energía, los resultados de absorbancia medidos por el espectrofotómetro serán siempre muy bajos. Por tanto serán inútiles para el cálculo de la concentración de la sustancia.
Para descubrir la capacidad de absorción de energía de una sustancia a distintas longitudes de onda es preciso hacer un barrido de longitudes de onda. Esto consiste en elegir una única solución de la sustancia problema a una determinada concentración. Después se mide su absorbancia en el espectrofotómetro a distintas longitudes de onda.
Cada sustancia tiene una capacidad diferente de absorción de energía a las distintas longitudes de onda que constituyen el espectro lumínico.
Por lo tanto, si se hace una representación gráfica de los resultados obtenidos en el barrido de longitudes de onda, se obtiene una imagen característica que hará posible distinguir la sustancia problema de otras sustancias. También permitirá descubrir la sustancia problema en una solución que contenga, en principio, la sustancia problema desconocida.
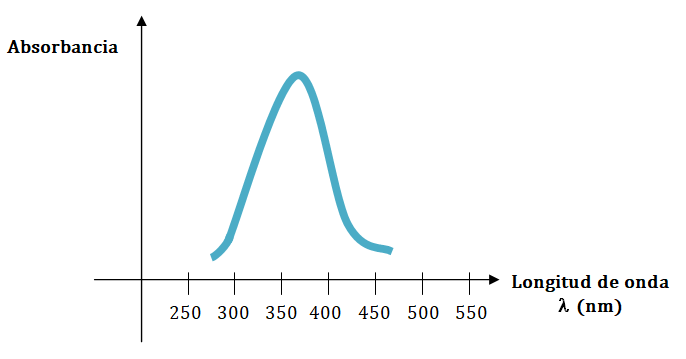
En la imagen anterior se puede ver que la sustancia tiene un máximo de absorción a unos 370 nm aproximadamente.
El barrido de longitudes de onda puede hacerse de forma manual o de forma automática.
El método manual suele utilizarse haciendo uso de un espectrofotómetro de haz simple. Se lleva a cabo situando la solución de la sustancia investigada, previamente vertida en el interior de una cubeta de espectrofotómetro, en la celda de medida del aparato. A continuación se seleccionan las longitudes de onda que se van a utilizar y finalmente se realizan las medidas.
Observa el siguiente video que muestra cómo realizar el barrido de forma automática:
No todos los modelos de espectrofotómetros permiten realizar el barrido de forma automática.
4. Créditos
Recurso elaborado por los docentes Raúl Britos, Anarella Gatto (Contenidista de Química del Portal Uruguay Educa) y Marcelo Gurin.
Abril 2021.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Referencias bibliográficas:
- Brown , T., LeMay, E., Bursten, B. y Burdge, J. (1998). Química:
la ciencia central. (7ma edición). México: Prentice
Hall.
- Chang, R. (1998). Química. (6ta edición). Mc Graw Hill.
- Curso de Análisis Químico - Facultad de Ciencias Agrarias y Forestales -UNLP. (s.f.). INTRODUCCIÓN A LOS MÉTODOS ESPECTROSCÓPICOS DE ANALISIS [Archivo PDF]. https://aulavirtual.agro.unlp.edu.ar/pluginfile.php/35287/mod_resource/content/2/1%20espectroscop%C3%ADa%202017%20%281%29.pdf
- Dickerson, R., Gray, H. y Haight, G. (1976). Principios de química. Barcelona, España: Reverté,
- Espectro electromagnético. (22 de mayo de 2021). En Wikipedia. https://es.wikipedia.org/w/index.php?title=Espectro_electromagn%C3%A9tico&oldid=135740397
- Ficha Permanganato de potasio. (s.f.). http://documentacion.ideam.gov.co/openbiblio/bvirtual/018903/Links/Guia21.pdf
- Hill, J. y Kolb, D. (1999). Química para el nuevo milenio. (8va edición). México: Pearson, Prentice Hall.
- Kolthoff, I., Sandell, E., Meehan, E. y Bruckenstein, S. (1976). ANÁLISIS QUÍMICO CUANTITATIVO. (4ta edición). Buenos Aires, Argentina: Nigar.
- Lazzerini, S. y Sulé, P. (2001). Guía básica. Laboratorio de Química de Educación Media. Montevideo, Uruguay: ANEP.
- LEY DE BOUGUER-LAMBERT-BEER [Archivo PDF]. https://www.uv.mx/personal/aherrera/files/2014/05/L.-Ley-de-Bouguer-Lambert-Beer-0.pdf
- Medialdea, J., Arnáiz, C. y Díaz, E. (2005). Permanganato potásico: un potente y versátil oxidante. Tratamiento de Aguas. Ingeniería Química. http://www.elaguapotable.com/Permanganato%20un%20potente%20y%20versatil%20oxidante.pdf
- Rodríguez, F. (2017). Barrido de longitudes de onda. https://www.franrzmn.com/barrido-de-longitudes-de-onda/
Videos:
Anteldetodos . (2014, 8 de julio). Micro Antel Ciencias: La Luz [Archivo de Video]. Youtube. https://youtu.be/cHhDks4cbyACole-Parmer Europe . (2017, 4 de mayo). Jenway 72 Series Spectrophotometers - Performing a spectrum scan [Archivo de Video]. Youtube. https://youtu.be/XjsRoqrUeEM
Sitios:
- Simulador Moléculas y luz. PhET. https://phet.colorado.edu/sims/html/molecules-and-light/latest/molecules-and-light_es_PE.html
- Lab de la ley de Beer. PhET. https://phet.colorado.edu/sims/html/beers-law-lab/latest/beers-law-lab_es.html
Imágenes:
- Pierre Bouguer. https://es.wikipedia.org/wiki/Pierre_Bouguer#/media/Archivo:Pierre_Bouguer_-_Jean-Baptiste_Perronneau.jpg
- Johann Heinrich Lambert. https://es.wikipedia.org/wiki/Johann_Heinrich_Lambert#/media/Archivo:Johann_Heinrich_Lambert_1829_Engelmann.png
- August Beer. https://www.ecured.cu/Archivo:August_Beer.jpg
- Espectro electromagnético. (22 de mayo de 2021). En Wikipedia. https://es.wikipedia.org/w/index.php?title=Espectro_electromagn%C3%A9tico&oldid=135740397
- Permanganato de potasio. https://es.wikipedia.org/wiki/Permanganato_de_potasio#/media/Archivo:Potassium-permanganate-photo.jpg
- Iconos de Flaticon:
- ADN. https://www.flaticon.com/svg/vstatic/svg/4260/4260220.svg?token=exp=1618596735~hmac=fc91b45c81e5db8a9096aa8b7a5827d4
- Lentes de sol. https://www.flaticon.com/svg/vstatic/svg/139/139929.svg?token=exp=1618596781~hmac=5a47950a323e8b953dcd85f1c49038f8
- Refracción de la luz. https://www.flaticon.com/svg/vstatic/svg/308/308730.svg?token=exp=1618596844~hmac=586a1af1eb940455aee3d28dde174989
- Reflexión de la luz. https://www.flaticon.com/svg/vstatic/svg/3335/3335066.svg?token=exp=1618596903~hmac=b3007add86f0cd1d14d51b9b5d0dc8bf
- Flecha 1. https://www.flaticon.com/svg/vstatic/svg/889/889590.svg?token=exp=1618596955~hmac=c51f082f9f9c159ab2e48f2a27f0c4b4
- Flecha 2. https://www.flaticon.com/svg/vstatic/svg/889/889578.svg?token=exp=1618596950~hmac=c560461ef4c10a28381d411a5096af78
- Tubo de ensayo. https://www.flaticon.com/svg/vstatic/svg/647/647370.svg?token=exp=1618591420~hmac=ad8707b842816a5e802b59328a82a48f