¿Qué relación hay entre la concentración de los reactivos y la rapidez de una reacción?
2. ¿Cómo se puede determinar experimentalmente la ley de rapidez?
2.1. Resolución de ejercicios: Ejemplo 1
![]()
Se obtuvieron los siguientes datos en el laboratorio para la reacción entre el diflúor gaseoso y el dióxido de cloro gaseoso:
F2 (g) + 2 ClO2 (g) → 2 FClO2 (g)
Experimento | [F2] (mol/L) | [ClO2] (mol/L) | rinicial (mol/L.s) |
1 | 0,10 | 0,010 | 1,2.10-3 |
2 | 0,10 | 0,040 | 4,8.10-3 |
3 | 0,20 | 0,010 | 2,4.10-3 |
![]()
1. Comenzamos escribiendo la ley de la rapidez de forma general: r = k [F2]x. [ClO2]y
![]()
2. Selecciono los dos experimentos en donde la concentración del reactivo A, en ese caso el diflúor no cambia, en este caso el experimento 1 y el 2.
![]()
3. Sustituyo los valores para cada caso:
- r1 = k [0,10 mol/L]x. [0,010 mol/L]y = 1,2 . 10-3 mol/L.s
- r2 = k [0,10 mol/L]x. [0,040 mol/L]y = 4,8 . 10-3 mol/L.s
![]()
4. Divido ambas expresiones, colocando como numerador la expresión en la que el reactivo B, en este caso el dióxido de cloro, tiene una mayor concentración.
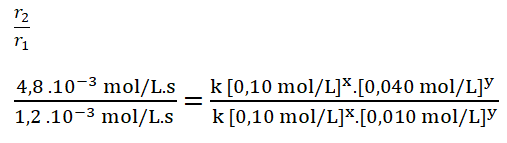
![]()
5. Simplifico aquellos términos iguales aplicando una cancelación:
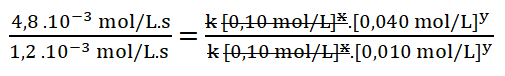
Divido los valores numéricos de la rapidez 2 sobre la 1.
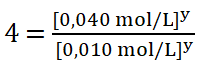
Divido entre sí los valores de la concentración del reactivo B aplicando la división de dos potencias de igual exponente: 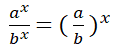
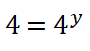
Como tengo dos potencias iguales de igual base (4), sus exponentes deben ser iguales: ![]()
![]()
6. Despejo el valor del orden parcial o potencia y, obtengo que: ![]()
![]()
7. Repito los pasos anteriores seleccionando un experimento en donde la concentración del reactivo B se mantenga constante.
Selecciono los experimentos 1 y 3 en donde la concentración del reactivo B no cambia, en este caso el dióxido de cloro.
Sustituyo lo valores para cada experimento:
- r1 = k [0,10 mol/L]x. [0,010 mol/L]y = 1,2 . 10-3 mol/L.s
- r3 = k [0,20 mol/L]x. [0,010 mol/L]y = 2,4 . 10-3 mol/L.s
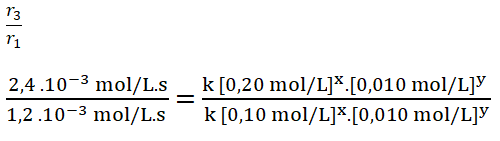
Simplifico los términos iguales.
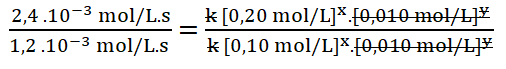
Divido los valores numéricos de la rapidez 3 sobre la 1.
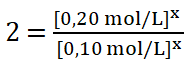
Divido entre sí los valores de la concentración del reactivo A.
![]()
![]()
8. Despejo el valor del orden parcial o potencia x, obtengo que: ![]()
![]()
9. Selecciono uno de los experimentos, sustituyo los datos y despejo k (constante específica).
1,2 .10-3 mol/L.s = k. 0,10 mol/L. 0,010 mol/L
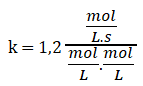
Simplificando las unidades:
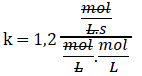
Finalmente:
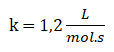
![]()
10. Escribo la ley de rapidez: r = 1,2 L/mol.s [F2]1. [ClO2]1 o r = 1,2 L/mol.s [F2]. [ClO2]
Orden global = 1+1 = 2