¿Qué relación hay entre la concentración de los reactivos y la rapidez de una reacción?
2. ¿Cómo se puede determinar experimentalmente la ley de rapidez?
2.2. Ejemplo 2
![]()
Determina con los siguientes datos:
a) la ley de rapidez incluyendo el orden global.
b) el valor de k.
c) la rapidez cuando [NO] = 12,0.10-3 mol/L y [H2] = 6,06.10-3 mol/L.
|
2 H2 (g) + 2 NO (g) → N2 (g) + 2 H2O (g) |
|||
|
Experimento |
[H2] (mol/L) |
[NO] (mol/L) |
rinicial (mol/L.s) |
|
1 |
2,0.10-3 |
5,0.10-3 |
1,3.10-5 |
|
2 |
2,0.10-3 |
10,0.10-3 |
5,0.10-5 |
|
3 |
4,0.10-3 |
10,0.10-3 |
10,0.10-5 |

1. Comenzamos escribiendo la ley de la rapidez de forma general: r = k [H2]x. [NO]y

2. Selecciono los dos experimentos en donde la concentración del reactivo A, en ese caso el dihidrógeno no cambia, en este caso el experimento 1 y el 2.

3. Sustituyo los valores para cada caso:
- r1 = k [2,0.10-3 mol/L]x. [5,0.10-3mol/L]y = 1,3.10-5 mol/L.s
- r2 = k [2,0.10-3 mol/L]x. [10,0.10-3 mol/L]y = 5,0.10-5 mol/L.s

4. Divido ambas expresiones, colocando como numerador la expresión en la que el reactivo B, en este caso el monóxido de nitrógeno, tiene una mayor concentración.
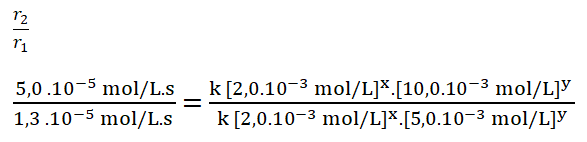

5. Simplifico aquellos términos iguales aplicando una cancelación:
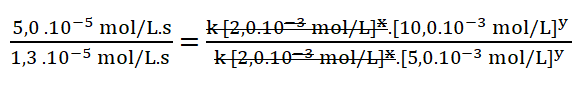
Divido los valores numéricos de la rapidez 2 sobre la 1. Redondeo el resultado a un número entero (4) ya que el resultado es un número decimal (3,8).
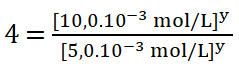
Divido entre sí los valores de la concentración del reactivo B aplicando la división de dos potencias de igual exponente.
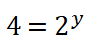

6. Dos al cuadrado es igual a 4 por lo que despejo el valor del orden parcial o potencia y, obtengo que: 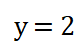

7. Repito los pasos anteriores seleccionando un experimento en donde la concentración del reactivo B se mantenga constante.
Selecciono los experimentos 2 y 3 en donde la concentración del reactivo B no cambia, en este caso el monóxido de nitrógeno.
Sustituyo lo valores para cada experimento:
- r2 = k [2,0.10-3 mol/L]x. [10,0.10-3 mol/L]y = 5,0.10-5 mol/L.s
- r3 = k [4,0.10-3 mol/L]x. [10,0.10-3 mol/L]y = 10,0.10-5 mol/L.s
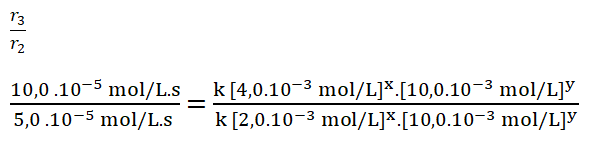
Simplifico los términos iguales.
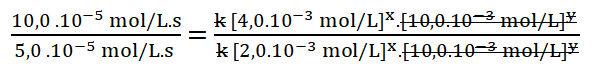
Divido los valores numéricos de la rapidez 3 sobre la 2.
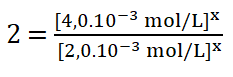
Divido entre sí los valores de la concentración del reactivo A.
![]()

8. Despejo el valor del orden parcial o potencia x, obtengo que: ![]()

9. Selecciono uno de los experimentos, sustituyo los datos y despejo k (constante específica).
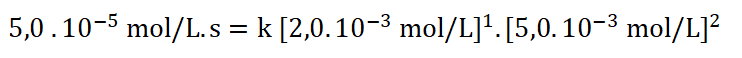
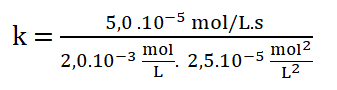
Simplificando las unidades:
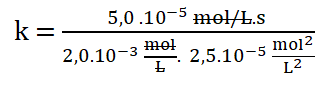
Finalmente:
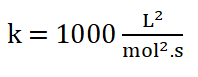

10. Escribo la ley de rapidez: r = 1000 L2/mol2.s [H2]1. [NO]2 o r = 1000 L2/mol2.s [H2]. [NO]2
Orden global = 1+2 = 3
____________________________
Para resolver la parte C debo sustituir los datos brindados en la expresión de la ley de rapidez determinada:
r = 1000 L2/mol2.s [6,06.10-3 mol/L]. [12,0.10-3 mol/L]2
r = 8,73 .10-4 mol/L.s