¿Qué es y cómo funciona el fotocolorímetro y el espectrofotómetro?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Creación de recursos en Ciencias |
| Libro: | ¿Qué es y cómo funciona el fotocolorímetro y el espectrofotómetro? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:57 |
1. Métodos de análisis espectroscópicos
![]()
Las técnicas fotocolorimétricas se utilizan generalmente para la determinación de concentraciones de diferentes sustancias aprovechando su coloración característica o la que resulta del tratamiento con algún reactivo apropiado.
La importancia de estos métodos radica en que se pueden hacer mediciones en un rango muy grande del espectro electromagnético. A su vez, pueden hacerse usando bandas muy angostas (espectrofotometría) o utilizando bandas anchas (fotocolorimetría), considerando a las bandas como conjuntos de longitudes de onda.

Imagen de un espectrofotómetro y un fotocolorímetro usados en un centro escolar.
![]()
Estos métodos tienen las siguientes ventajas:
- son no destructivos, el analito se puede recuperar luego del ensayo.
- utilizan poca cantidad de reactivos, por lo que son métodos económicos.
- son relativamente rápidos.
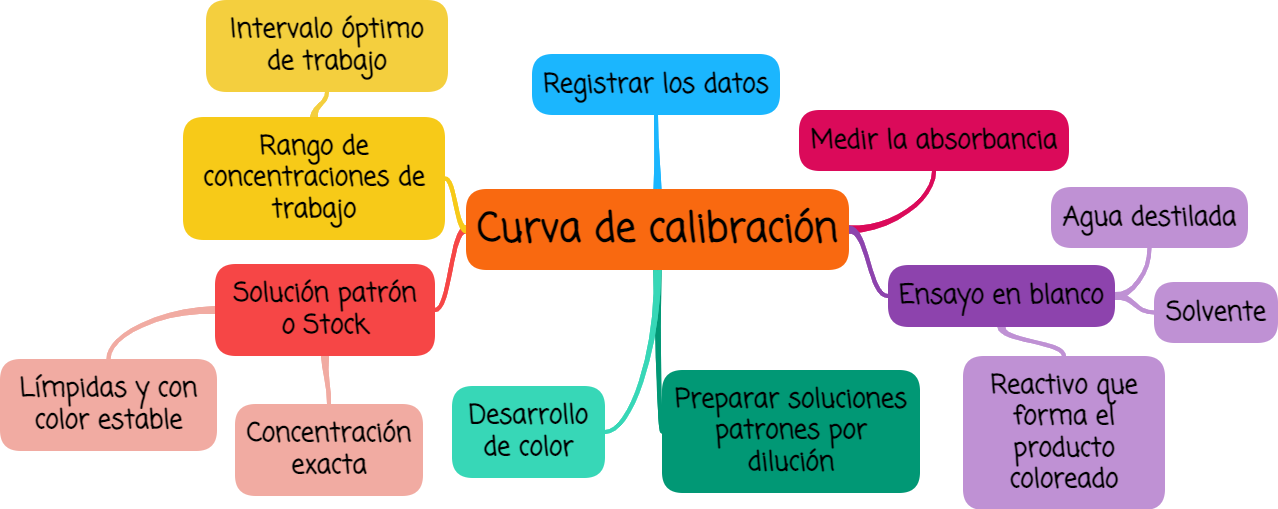
2. Curva de calibración
![]()
Es un método utilizado para determinar la concentración de una muestra problema. Para llevarlo a cabo es necesario preparar varias soluciones patrón de concentración conocida y medir su absorbancia.
![]()
- Primeramente se debe seleccionar el rango de las concentraciones de trabajo (intervalo óptimo de trabajo) tomando en cuenta la probable concentración de la muestra problema. Es conveniente que la concentración de la solución de la muestra problema se encuentre centrada en el rango de la curva de calibración y además trabajar con soluciones cuyas concentraciones se encuentren dentro del rango de linealidad de la curva.
- Preparar una solución patrón (stock) de concentración conocida que contenga la misma especie absorbente que el analito.
- En algunas
ocasiones la muestra que se desea determinar no posee color por
sí misma, en tal caso, es preciso
llevar a cabo un desarrollo de color empleado reactivos que den lugar a sustancias
coloreadas con la muestra que interesa estudiar, como se observa en las siguientes imágenes.

- Preparar por dilución de la solución stock al menos cinco soluciones patrón en el intervalo óptimo de trabajo.
- Usar para el ensayo en blanco agua destilada, el solvente empleado o el reactivo que provocará la formación de un producto coloreado al reaccionar con la solución.
- Medir la absorbancia de cada una de las soluciones patrón a la longitud de onda de máxima absorción o con el filtro adecuado. Recordar hacer la corrección con el blanco.
- Registrar los datos obtenidos.
![]()
Construir la curva de calibración A = f [C(mol/L)] empleando un programa para construir gráficas como por ejemplo Excel, Hojas de cálculo de Open Office, Hojas de cálculo de Google Drive, u otro similar. Hallar la ecuación de la recta y el coeficiente de correlación R2.
El coeficiente de regresión lineal (R2) debe ser lo más próximo a uno.
La recta obtenida de la gráfica anterior, representa la relación matemática entre el valor de la señal espectrofotométrica y la concentración, cuánto mayor es la concentración del analito mayor será su absorbancia.
A través de la curva de calibración, conociendo el valor de absorbancia de la muestra problema, se puede calcular el valor de concentración del analito (véase el procedimiento explicado en siguiente enlace).
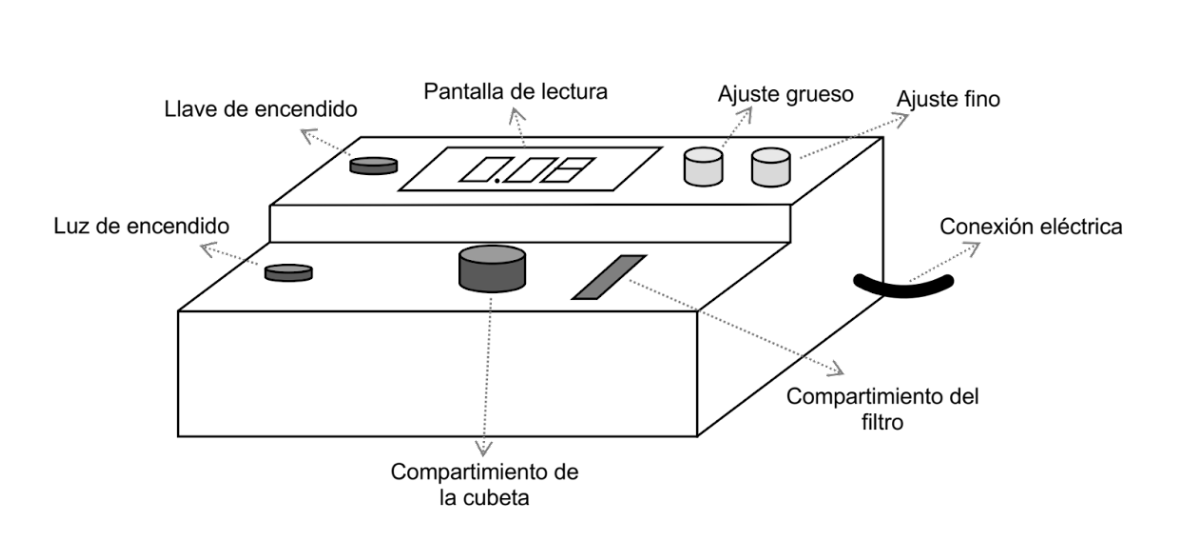
3. Fotocolorímetro
![]()
El instrumento con el cual se realizan mediciones de absorbancia es el fotómetro o fotocolorímetro.
La variación del color de un sistema homogéneo con la concentración de algún componente es la base del análisis fotométrico. El análisis fotométrico se usa en química analítica cuantitativa y se basa en la medición de la potencia de radiación absorbida por un medio absorbente.
![]()
El fundamento de esta técnica consiste en el pasaje de una radiación de una determinada longitud de onda (λ) del espectro visible a través de una solución coloreada, y en la medición de la potencia de la radiación absorbida por dicha solución. También puede aplicarse a especies químicas que no son coloreadas, pero que al reaccionar con ciertos reactivos generan especies coloreadas que absorben en la región visible del espectro.

![]()
![]()
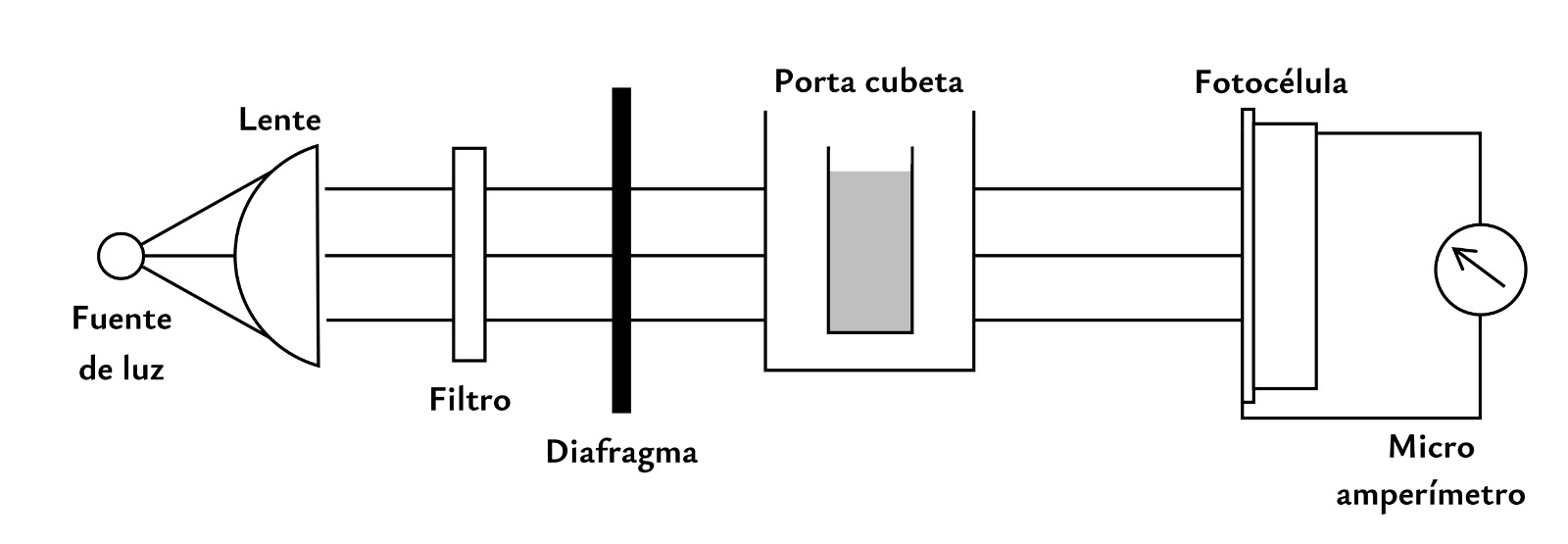
Las partes más importantes del colorímetro son las siguientes:
- una lámpara de filamento de tungsteno como fuente de luz,
- una lente para obtener un haz de radiación paralela,
- un filtro de absorción,
- un diafragma variable,
- un porta cubeta para la solución y
- una fotocélula. Esta última se usa para detectar la radiación y su resultado es una corriente eléctrica que se dirige a un instrumento de medida que está en contacto con un dispositivo de lectura de tipo digital.
3.1. Selección de filtros
![]()
Los filtros utilizados en los fotocolorímetros consisten en vidrios de color o gelatina impregnada y tienen la propiedad de transmitir la luz de cierta zona del espectro electromagnético absorbiendo el resto.

![]()
La selección del filtro puede realizarse por alguna de las siguientes formas:
a. Efectuar medidas de absorbancia empleando distintos filtros y elegir el filtro con el que se registre una absorbancia máxima.
b. Otra forma de seleccionarlo es eligiendo aquel color complementario al de la solución. El siguiente cuadro es muy útil.
|
Color de la solución |
Color del filtro |
|
Púrpura Violeta Azul Azul verdoso Verde azulado Verde Verde amarillo Amarillo Anaranjado Rojo |
Verde Verde amarillo Amarillo Anaranjado Rojo Púrpura Violeta Azul Azul verdoso Verde azulado |
En la siguiente figura se puede ver cuáles son los colores complementarios, se debe trazar una línea recta hacia el color diametralmente opuesto.

c. Seleccionar el filtro cuya longitud de onda coincida o esté próxima con la del pico del espectro de absorción de la especie coloreada estudiada.
3.2. Cubetas y su manipulación
![]()
El instrumento posee un compartimento para una cubeta transparente que, según el modelo, puede ser una cubeta cuadrada de 1 cm de camino óptico o una cubeta esférica.

![]()
Las cubetas cuadradas pueden estar construidas de material plástico, vidrio o cuarzo. En el caso de las cubetas de plástico y de vidrio son útiles para emplear en la región del espectro visible (400 a 800 nm) y las cubetas de cuarzo se deben emplear para cuando se trabaja con la región UV (ultravioleta, menor a 400 nm) del espectro.
![]()
Es importante recordar las siguientes recomendaciones en su manejo:
- No tocar con los dedos las superficies ópticas o caras transparentes de las cubetas. Deben tomarse por las caras rayadas o esmeriladas utilizando el pulgar y el índice.
- Se deben llenar hasta las tres cuartas partes por medio de un gotero de punta fina.
- Si es necesario, se debe secar la superficie externa con una tela suave y absorbente que no se desfibre fácilmente o con papel absorbente.
- Observar si existen burbujas de aire o gases adheridos a las caras internas, en cuyo caso se forzará su desprendimiento con pequeños golpecitos con el dedo sobre las paredes rayadas de la cubeta.
- Ubicar la cubeta con una orientación prefijada de modo que la cara transparente quede orientada hacia la fuente luminosa.
- No pueden utilizarse cubetas de plástico para contener soluciones de iodo ya que se produce la adsorción molecular del iodo sobre el plástico.
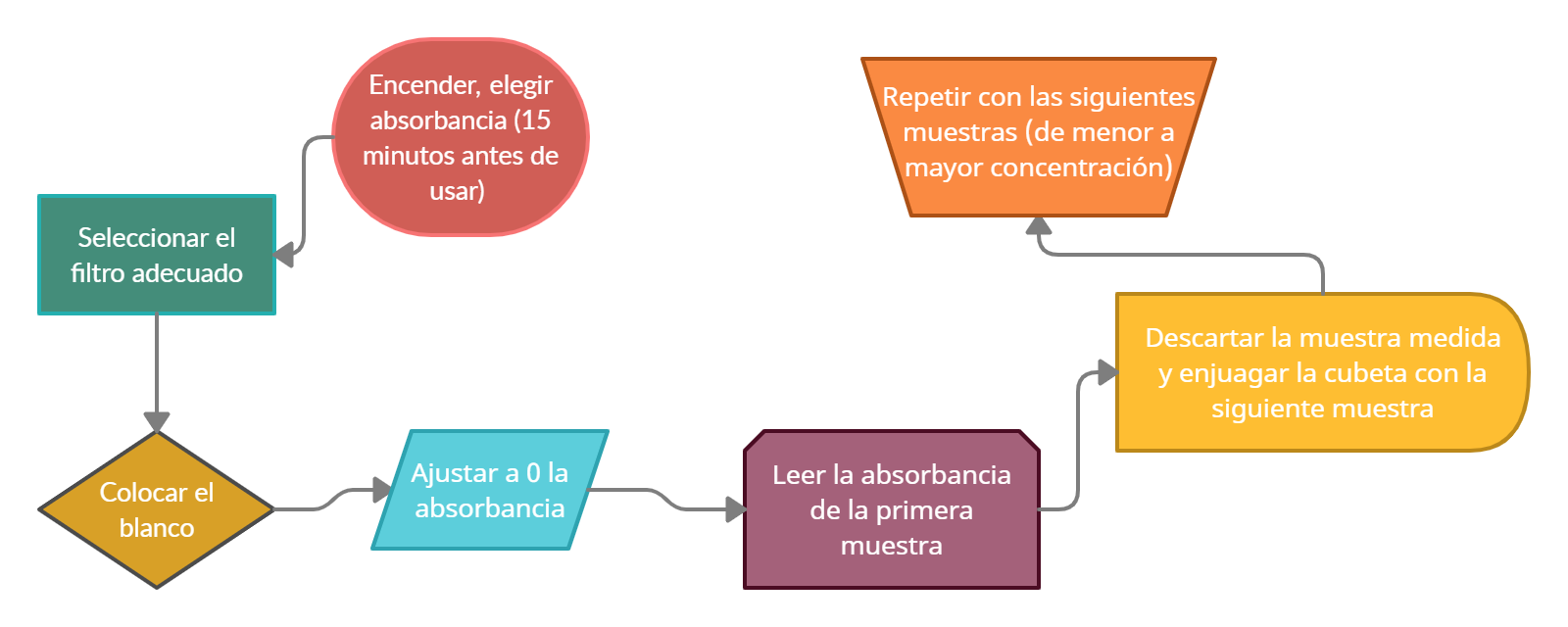
3.3. Procedimiento de uso
![]()
1. Conectar el fotómetro a la corriente*. Encenderlo, eligiendo A (absorbancia) o % T (porcentaje de transmitancia) y dejar estabilizar por lo menos 15 minutos antes de usarlo.
* Se sugiere consultar el manual del instrumento antes de comenzar a utilizarlo.
2. Seleccionar el filtro adecuado y colocarlo en el compartimiento correspondiente.
3. Colocar la muestra "blanco" en la cubeta hasta sus tres cuartas partes e introducir la misma en el compartimiento correspondiente.
4. Ajustar a 0 la absorbancia (o 100 % de transmitancia) empleando los controles. Primero se realiza un ajuste grueso con COARSE y luego un ajuste fino con FINE.
5. Sustituir la cubeta con el "blanco" por la cubeta con la muestra a medir.
6. Leer el valor de la absorbancia de la primera muestra (solución de menor concentración).
7. Descartar la muestra ya medida.
8. Enjuagar la cubeta con un pequeño volumen de la siguiente muestra a medir con el objetivo de arrastrar todo resto de la muestra anterior que pueda quedar en la cubeta.
9. Repetir los pasos anteriores con las siguientes muestras. Tener en consideración de realizar las mediciones de las soluciones de menor a las de mayor concentración.
Nota: Al usar el fotocolorímetro siempre conviene, por razones analíticas, realizar duplicados de las medidas. Al llevar a cabo este procedimiento se desea confirmar que las medidas se han realizado correctamente. Lo que se busca es que entre los duplicados haya una similitud en los valores. Si se observa algún duplicado que da valores muy diferentes en una repetición y en otra, lo que se puede hacer es repetir la determinación para ver cuál de las medidas se considera como correcta.
4. Espectrofotómetro
![]()
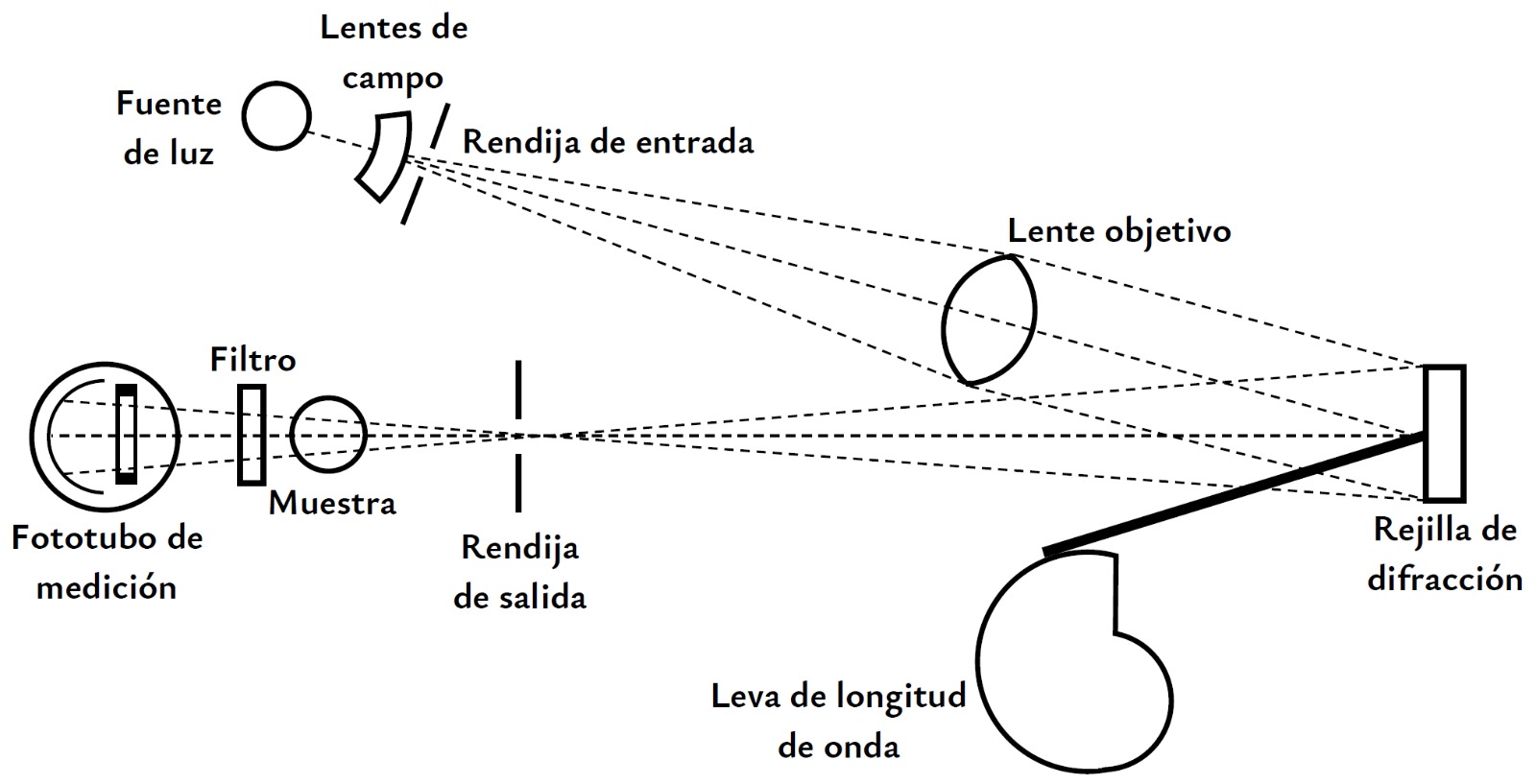
Un espectrofotómetro es un instrumento analítico que basa su funcionamiento en la descomposición de la luz policromática en distintas longitudes de onda y la posterior selección de una banda angosta de estas para poder realizar mediciones de absorción de la luz por una muestra determinada.

![]()
Los fundamentos de su uso son similares a los de los fotocolorímetros, con la diferencia de que no es necesario utilizar un filtro de color para poder seleccionar la longitud de onda de trabajo, sino que el propio instrumento permite una selección directa de ella.
![]()
Todo espectrofotómetro debe contar con cinco elementos básicos:
1) Una fuente de radiación continua en las longitudes de onda de interés.
2) Un monocromador que permite la selección de una banda angosta del espectro de la fuente.
3) Una cubeta que contiene a la muestra.
4) Un detector que convierte la energía radiante en energía eléctrica.
5) Un dispositivo de lectura que permite interpretar la respuesta del detector.
![]()
Existen espectrofotómetros que permiten hacer mediciones en diferentes intervalos de longitudes de onda en el espectro electromagnético. Los más comunes (y simples) trabajan en las regiones ultravioleta/visible. Dependiendo de la región del espectro que se trate, las características de los diferentes elementos varían.
En el caso de la fuente de radiación, es común utilizar una lámpara incandescente de filamento de tungsteno para la región visible, que también puede utilizarse para las regiones del ultravioleta cercano e infrarrojo cercano. Para la región ultravioleta, en general se usa un tubo de descarga de hidrógeno o de deuterio.
Los monocromadores más comunes son los prismas y las rejillas de difracción. Cuando la luz policromática atraviesa un prisma se refracta y, como el grado de refracción depende de la longitud de onda, la radiación se "dispersa" en sus diferentes longitudes de onda; si se gira el prisma es posible hacer que una longitud de onda específica pase por una rendija y llegue hasta la muestra. Las rejillas de difracción se componen de una gran cantidad de ranuras paralelas trazadas sobre una superficie pulida (entre 6000 y 12000 líneas por centímetro para la región UV/visible), que funcionan como centros de dispersión para la luz que llega a la rejilla, lo que permite una separación en sus diferentes longitudes de onda con una resolución que depende de la cantidad de ranuras trazadas; al igual que en el caso del prisma si se gira la rejilla es posible hacer que una longitud de onda específica pase por una rendija y llegue hasta la muestra. En los espectrofotómetros modernos el uso de prismas ya no es tan común, sino que predomina la utilización de rejillas de difracción.
Las cubetas para muestras deben ser transparentes en la región de longitudes de onda de interés. Suelen ser de forma prismática y su ancho interno entre las caras paralelas debe estar calibrado a una determinada longitud (usualmente 1 cm). Las celdas usadas en la región visible suelen ser de vidrio o de plástico, mientras que en el UV están construidas de cuarzo, ya que el vidrio no es transparente para estas longitudes de onda.
Los diferentes detectores posibles también varían dependiendo de la región del espectro. Para la región UV/visible es usual la utilización de una fotocelda, que consiste en un cátodo fotoemisor y un ánodo. Se aplica un alto voltaje entre el ánodo y el cátodo y cuando un fotón entra por la ventana del tubo y llega al cátodo se emite un electrón, que es atraído hacia el ánodo, haciendo que pase una corriente que se puede amplificar y medir. Esta corriente es interpretada por un dispositivo de lectura que devuelve una medida numérica.
4.1. Procedimiento de uso
![]()
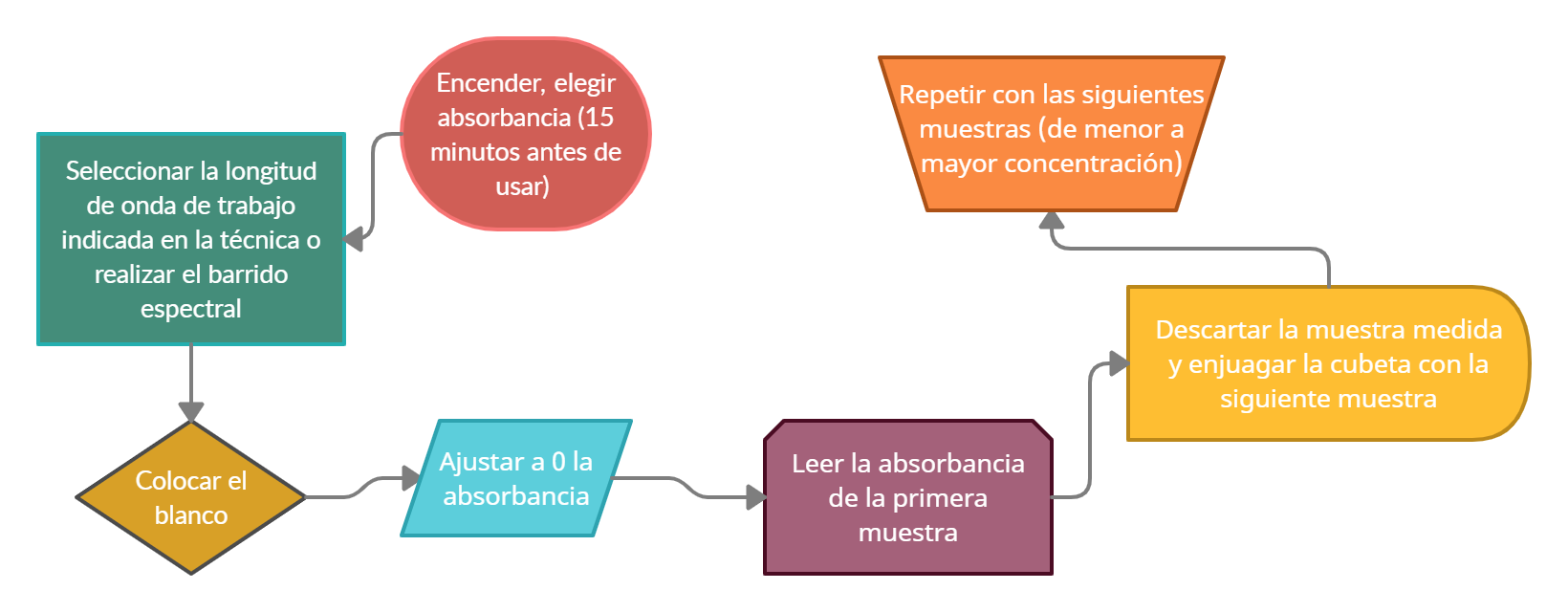
1. Conectar el espectrofotómetro a la corriente*. Encenderlo, eligiendo A (absorbancia) o % T (porcentaje de transmitancia) y dejar estabilizar por lo menos 15 minutos antes de usarlo.
* Se sugiere consultar el manual del instrumento antes de comenzar a utilizarlo.
2. Seleccionar la longitud de onda de trabajo indicada en la técnica o realizar el barrido espectral correspondiente.
3. Colocar la muestra "blanco" en la cubeta hasta sus tres cuartas partes e introducir la misma en el compartimiento correspondiente.
4. Ajustar a 0 la absorbancia (o 100 % de transmitancia) empleando el botón correspondiente.
5. Sustituir la cubeta con el "blanco" por la cubeta con la muestra a medir.
6. Leer el valor de la absorbancia de la primera muestra (solución de menor concentración).
7. Descartar la muestra ya medida.
8. Enjuagar la cubeta con un pequeño volumen de la siguiente muestra a medir con el objetivo de arrastrar todo resto de la muestra anterior que pueda quedar en la cubeta.
9. Repetir los pasos anteriores con las siguientes muestras. Tener en consideración de realizar las mediciones de las soluciones de menor a las de mayor concentración.
________________________
Se sugiere observar el procedimiento seguido en el siguiente video;
5. Créditos
Recurso elaborado por los docentes Raúl Britos, Anarella Gatto (Contenidista de Química del Portal Uruguay Educa) y Marcelo Gurin.
Mayo 2021.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Referencias bibliográficas:
- Aparicio, E. (2017). Técnicas colorimétricas. Visión Criminológica - Criminalística [Archivo PDF]. http://revista.cleu.edu.mx/new/descargas/1703/articulos/Articulo08_Tecnicas_colorimetricas.pdf
- Christian, G., Ortega, S. y Pozo, V. (2009). Química analítica. México: McGraw-Hill/Interamericana.
- Kolthoff, I., Sandell, E., Meehan, E. y Bruckenstein, S. (1976). ANÁLISIS QUÍMICO CUANTITATIVO. (4ta edición). Buenos Aires, Argentina: Nigar.
- Lazzerini, S. y Sulé, P. (2001). Guía básica. Laboratorio de Química de Educación Media. Montevideo, Uruguay: ANEP.
- Skoog, D., Holler, F. y Crouch, S. (2008). Principios de análisis instrumental. (6ta edición). México: Cengage Learning Editores S.A. de C.V.
Videos:
Daura Vega-Moreno ULPGC. (2019, 29 de octubre). Espectrofotometría Curva de Calibrado [Archivo de Video]. Youtube. https://youtu.be/7PZJGGfbU7U - LABORATORIO QUÍMICA Y BIOLOGÍA. (2020, 27 de agosto). QUÍMICA ANALÍTICA - PREPARACIÓN DE CURVA DE CALIBRACIÓN Y MEDICIÓN DE ABS MÁXIMA [Archivo de Video]. Youtube. https://youtu.be/oIk--8rnlpA
Imágenes:
- Colores complementarios. Autor: Sakurambo. Licencia: CC BY-SA 3.0.
- Cubetas espectrofotómetro y fotocolorímetro 2020. Autor: Gurin, Marcelo. Licencia: CC BY-SA 4.0.
- Soluciones para realizar la curva de calibración 2020. Autor: Gurin, Marcelo. Licencia: CC BY-SA 4.0.
- Espectrofotómetro y fotocolorímetro. Autora: Gatto, Anarella. Licencia: CC BY-SA 4.0.
- Filtros fotocolorímetro. Autora: Giacusa, Natali. Licencia: CC BY-SA 4.0.