¿Qué son las enzimas?
Este libro resume los principales conceptos a trabajar
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué son las enzimas? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 16:47 |
Tabla de contenidos
1. Introducción
![]()
Algunos procesos químicos, como las etapas iniciales de la visión, la fotosíntesis y las reacciones nucleares en cadena, ocurren muy rápidamente. Otros, como la polimerización del cemento y la conversión del grafito en diamante, necesitan millones de años para completarse. Una manera de cuantificar esto es a partir de la rapidez de reacción, que se define como el cambio en la concentración de un reactivo o de un producto con respecto del tiempo (mol/L.s).
En un nivel práctico, el conocimiento de la rapidez de las reacciones es de gran utilidad para el diseño de fármacos, el control de la contaminación y el procesamiento de alimentos.
La rapidez de una reacción química depende de la barrera de energía que debe salvarse en el proceso de convertir reactivos en productos. En una reacción química, las moléculas necesitan cierta energía mínima para romper enlaces existentes y formar los nuevos. Esta energía se denomina energía de activación (Ea) y se define como la mínima cantidad de energía que se requiere para iniciar una reacción química.
Consideremos por ejemplo la reacción de conversión de metil-isonitrilo a acetonitrilo:
![]()
Como puede verse, lo que debe ocurrir durante la reacción es el cambio de posición del carbono y el nitrógeno en el grupo nitrilo (C≡N), y lo podemos imaginar en forma de un "giro" de esta parte de la molécula. Luego de haberse estudiado a detalle se encontró que esta reacción transcurre en etapas:
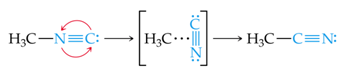
Observamos que, en la conversión, existe un momento en el que la parte N≡C de la molécula se encuentra "de costado". Es correcto suponer que es necesario suministrar energía a la molécula para que se alargue el enlace entre el grupo H3C y el grupo N≡C para que este grupo pueda girar. Una vez que este ha girado lo suficiente se comienza a formar el enlace C-C y la energía de la molécula desciende. Estas variaciones de energía pueden observarse en el siguiente diagrama:
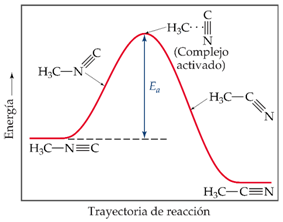
La barrera que existe para que se dé esta reacción es la energía que se necesita para forzar a la molécula a que pase por el estado intermedio, que es relativamente inestable, y así llegar al producto final. La diferencia entre la energía de la molécula inicial y la máxima energía a lo largo de la trayectoria de reacción es la energía de activación. La disposición particular de los átomos en la cima de la barrera se conoce como el complejo activado o estado de transición.
1.1. ¿Qué es un catalizador?
![]()
Un catalizador es una sustancia que aumenta (o disminuye) la rapidez de una reacción química sin consumirse ni modificarse en la reacción. Los catalizadores aumentan la rapidez de una reacción química al proporcionar una ruta con menor Ea.
![]()
Un catalizador puede disminuir la Ea en tres formas:
- 1) Las reacción catalizada y no catalizada pueden tener mecanismos diferentes pero similares, y el catalizador proporciona una forma de convertir el reactivo en una especie menos estable.
- 2) Las reacciones catalizada y no catalizada pueden tener mecanismos diferentes pero similares, y el catalizador proporciona una forma de hacer más estable el estado de transición.
- 3) El catalizador puede cambiar por completo el mecanismo de la reacción y proporcionar una ruta alterna, con menor Ea que la de la reacción no catalizada.
Cuando se afirma que un catalizador no se consume ni cambia en una reacción no se está diciendo que no participe en la reacción. Un catalizador debe participar en la reacción para hacerla más rápida. Lo que se quiere decir es que un catalizador exhibe la misma forma después de la reacción que la que tenía antes de la misma (si un catalizador se "consume" en un paso de la reacción, debe regenerarse en un paso posterior). Como el catalizador no se "consume" durante la reacción, solo se necesita una pequeña cantidad de este.
1.2. ¿Qué son las enzimas?
![]()
Las enzimas son los catalizadores de las reacciones de los sistemas biológicos, catalizan casi todas las reacciones químicas que tienen lugar en los organismos vivos. Tienen un alto grado de especificidad, aceleran reacciones químicas específicas y funcionan en soluciones acuosas en condiciones muy suaves de temperatura y pH. Actuando en secuencias organizadas catalizan cientos de reacciones consecutivas en las rutas metabólicas mediante las que se degradan nutrientes, se conserva y transforma energía y se fabrican macromoléculas a partir de precursores sencillos. Son importantes en la medicina, industria química, en el tratamiento y preparación de alimentos, la agricultura y en la limpieza.
![]()
Una reacción no catalizada en una célula tiene lugar con el tiempo, pero no a una rapidez suficiente para la supervivencia. Por ejemplo, la hidrólisis de proteínas en los alimentos ocurriría con el tiempo sin un catalizador, pero las reacciones no ocurrirían con suficiente rapidez para satisfacer los requisitos corporales de aminoácidos. Las reacciones químicas en las células ocurren increíblemente rápido bajo condiciones leves, cerca de un pH de 7,4 y una temperatura corporal de 37 °C. Las enzimas permiten que las células utilicen energía y materiales de manera eficiente mientras responden a las necesidades celulares.
Como catalizadores, las enzimas reducen la energía de activación de una reacción química. Se necesita menos energía para convertir moléculas reactantes en productos, lo que aumenta la rapidez de una reacción bioquímica comparada con la rapidez de las reacciones no catalizadas. Algunas enzimas pueden aumentar la rapidez de una reacción biológica por un factor de mil millones, un billón o incluso miles de millones de billones en comparación con la rapidez de la reacción no catalizada. Por ejemplo, una enzima en la sangre llamada anhidrasa carbónica cataliza la interconversión rápida de dióxido de carbono (CO2) y agua (H2O) en anión hidrógenocarbonato (HCO3-) y catión hidrógeno (H+). En un segundo, una molécula de anhidrasa carbónica puede catalizar la reacción de aproximadamente un millón de moléculas de dióxido de carbono. La anhidrasa carbónica también cataliza la reacción inversa y convierte hidrógenocarbonato y H+ en dióxido de carbono y agua.
![]()
Con la excepción de un pequeño grupo de moléculas de ARN catalítico, todas las enzimas son proteínas. Las estructuras primaria, secundaria, terciaria y cuaternaria de las proteínas enzimáticas son esenciales para su actividad catalítica. Casi todas las enzimas son proteínas globulares. Cada una tiene una forma tridimensional única que reconoce y une un pequeño grupo de moléculas reactantes que se llaman sustratos. La estructura terciaria de una enzima tiene una importante función en la manera como dicha enzima cataliza reacciones.
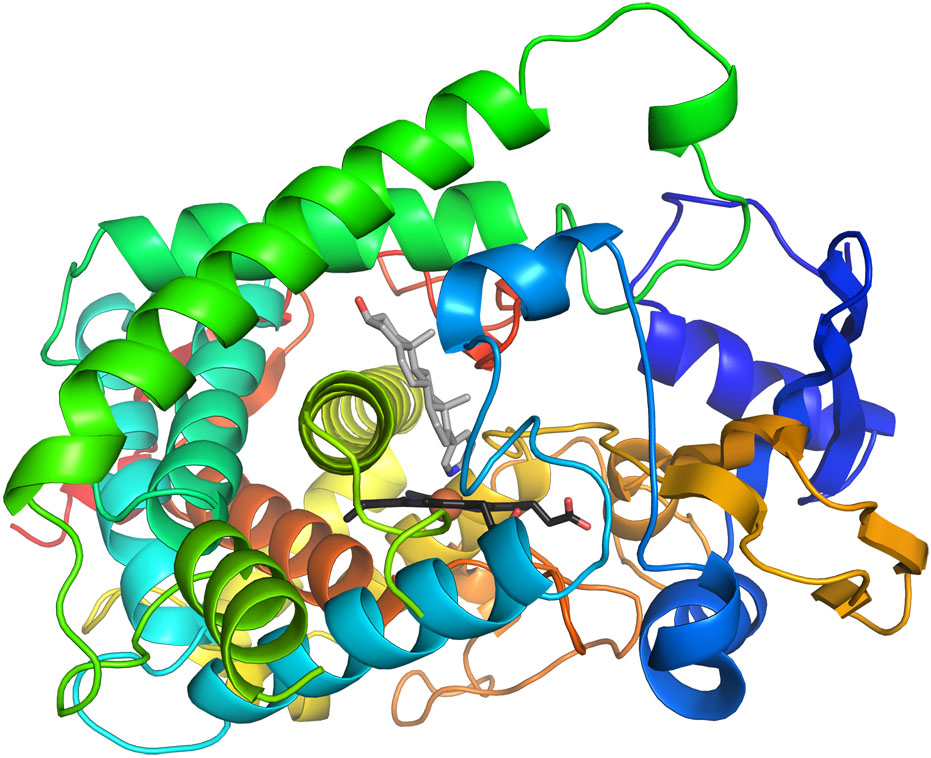
En una reacción catalizada, una enzima tiene que unirse a un sustrato en una forma que favorezca la catálisis.
![]()
Una enzima característica es mucho más grande que su sustrato. Sin embargo, dentro de la estructura terciaria de la enzima hay una región llamada sitio activo, donde se mantienen el o los sustratos mientras se realiza la reacción. Con frecuencia el sitio activo es una pequeña "bolsa" dentro de la estructura terciaria más grande. En el interior del sitio activo de una enzima, grupos R de aminoácidos específicos interaccionan con grupos funcionales del sustrato para formar enlaces de hidrógeno, puentes salinos e interacciones hidrofóbicas.
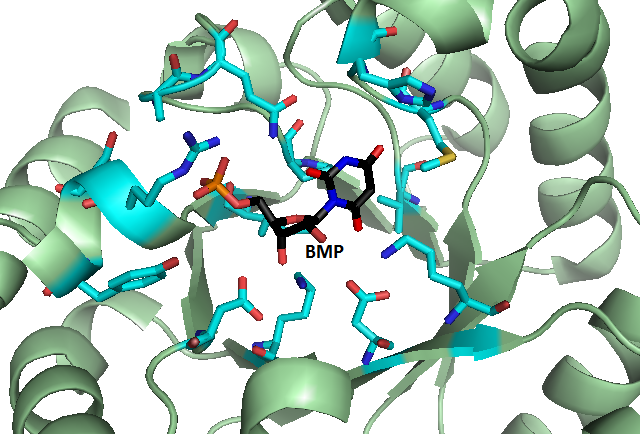
Puesto que el sitio activo de una enzima se acomoda a un tipo particular de sustrato, las enzimas generalmente catalizan sólo tipos específicos de reacciones. Algunas enzimas muestran especificidad absoluta al catalizar sólo una reacción para un sustrato específico. Otras enzimas catalizan una reacción para dos o más sustratos similares. Incluso hay otras enzimas que catalizan una reacción para un tipo de enlace específico.
1.3. Cofactor y coenzima
![]()
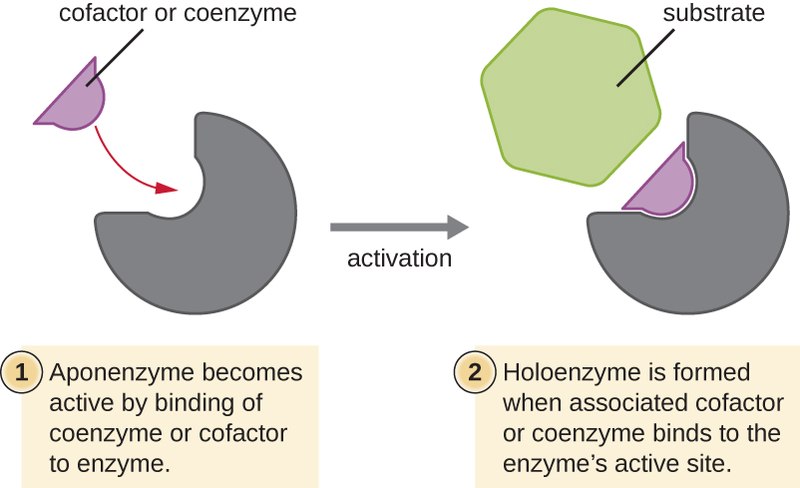
La actividad de algunas enzimas depende solamente de su estructura como proteínas, mientras que otras necesitan además, uno o más componentes no proteicos llamado cofactor. El cofactor puede ser un ion metálico o bien una molécula orgánica llamada coenzima. Algunas enzimas necesitan de ambos.
|
Componentes químicos adicionales |
formados por… |
Ejemplos |
|
Cofactor |
Uno o varios iones tales como Fe2+, Mg2+, Zn2+, Ni2+. |
peroxidasa, alcohol deshidrogenasa, ureasa, piruvato quinasa. |
|
Coenzima |
Complejo orgánico que actúa como transportador transitorio de grupos funcionales específicos. |
tiamina pirofosfato (precursor en la dieta vitamina B1), flavina adenina dinucleótido (precursor en la dieta vitamina B2), coenzima A (precursor en la dieta ácido pantoténico). |
1.4. Nomenclatura y clasificación de enzimas
![]()
Las enzimas se nombran comúnmente en relación con la reacción que catalizan y/o al compuesto o tipo de compuesto sobre el que actúan. Por ejemplo, la enzima lactato deshidrogenasa acelera la remoción de hidrógeno del lactato (una reacción de oxidación). La fosfatasa ácida cataliza la hidrólisis de enlaces fosfoéster en condiciones ácidas.
Como puede verse en estos ejemplos, los nombres de la mayoría de las enzimas terminan en asa. Sin embargo, algunas enzimas tienen nombres más antiguos, que se les asignaron antes de que sus acciones fueran entendidas claramente. Entre ellas se encuentran la pepsina, la tripsina y la quimotripsina, que son enzimas del tracto digestivo.![]()
Las enzimas se clasifican en 6 grupos según la reacción que catalizan:

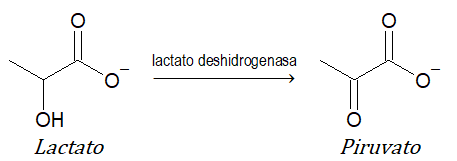
- 1 oxidorreductasas (transfieren e-): catalizan oxidaciones y reducciones. Ejemplo: lactato deshidrogenasa.
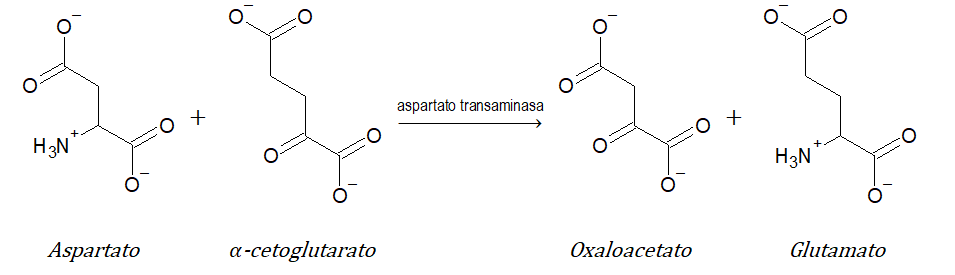
- 2 transferasas (transfieren grupos): catalizan la transferencia de un grupo de átomos de una molécula a otra. Ejemplo: aspartato transaminasa.
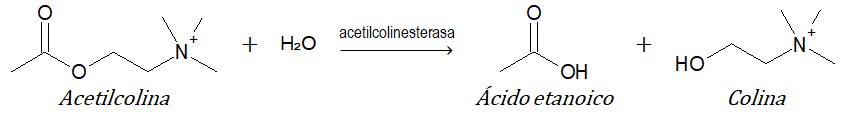
- 3 hidrolasas (reacciones de hidrólisis): catalizan reacciones de hidrólisis. Ejemplo: acetilcolinesterasa.
- 4 liasas (adición de grupos a dobles enlaces o formación de dobles enlaces): catalizan la adición de dos grupos a un doble enlace o la remoción de dos grupos de átomos adyacentes para crear un doble enlace. Ejemplo: aconitasa.
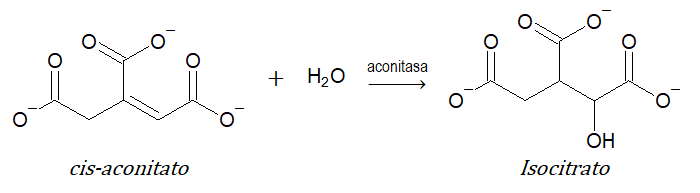
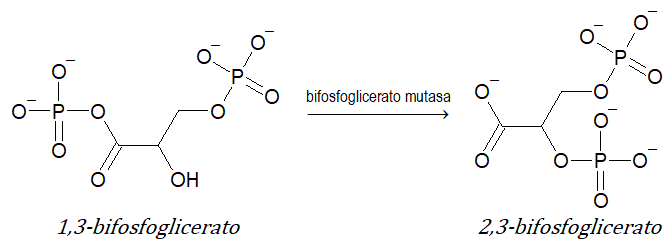
- 5 isomerasas (transferencia de grupos dentro de la molécula dando formas isoméricas): catalizan reacciones de isomerización. Ejemplo: bifosfoglicerato mutasa.
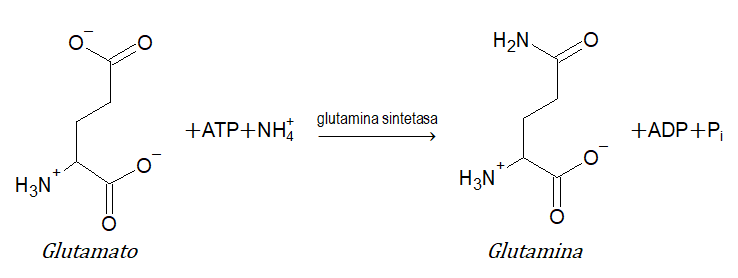
- 6 ligasas o sintetasas (formación de enlaces C-C, C-S, C-O y C-N mediante reacciones de condensación acoplada a la rotura de ATP- Adenosín trifosfato): catalizan la unión de dos moléculas. Ejemplo: glutamina sintetasa.
2. Modelos de acción enzimática
![]()
Los estudios muestran que solo una pequeña porción de una molécula enzimática, llamada sitio activo, participa en la interacción con un sustrato o sustratos durante una reacción. El sitio activo es la parte relativamente pequeña de la estructura de una enzima que realmente participa en la catálisis.
El sitio activo en una enzima es una entidad tridimensional formada por grupos que provienen de diferentes partes de la cadena de proteínas. Estos grupos se unen mediante el plegado y la flexión de la proteína.
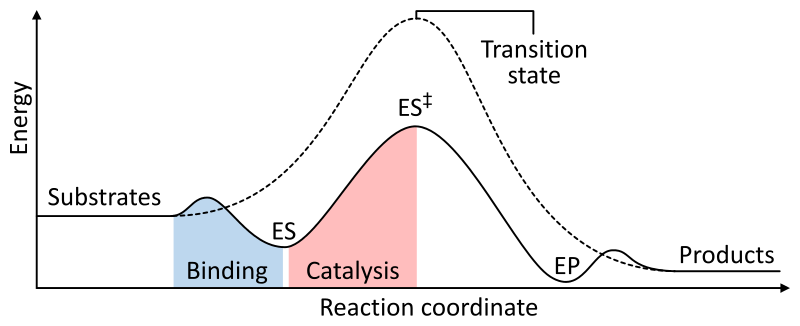
La combinación de una enzima y un sustrato forma un complejo enzima-sustrato (ES), que proporciona una ruta alternativa para la reacción con una menor energía de activación. Dentro del complejo enzima-sustrato, el sustrato encuentra condiciones de reacción más favorables que si estuviera libre, el resultado es una formación más rápida del producto. En el interior del sitio activo las cadenas laterales de aminoácidos catalizan la reacción para producir un complejo enzima-producto (EP), luego se liberan los productos y la enzima está disponible para unirse a otra molécula de sustrato.
E + S ⇄ Complejo ES → Complejo EP → E + P
![]()
Para tener en cuenta la forma altamente específica en que una enzima reconoce un sustrato y lo une al sitio activo, los investigadores han propuesto varios modelos.
![]()
El más simple de estos modelos es el modelo de cerradura y llave.
En el modelo de cerradura y llave, el sitio activo en la enzima tiene una conformación geométrica fija y rígida. Solo los sustratos con una geometría complementaria pueden acomodarse en dicho sitio, de la misma manera que una cerradura acepta solo ciertas llaves. La siguiente figura ilustra el concepto:
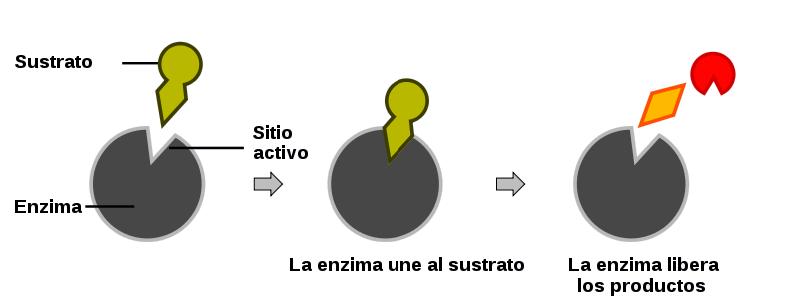
El modelo de cerradura y llave explica la acción de numerosas enzimas. Sin embargo, es demasiado restrictivo para la acción de muchas otras enzimas. La evidencia experimental indica que muchas enzimas tienen flexibilidad en sus formas, no son rígidas y estáticas, sino que hay un cambio constante en su forma. El modelo de ajuste inducido se utiliza para este tipo de situación.
![]()
El modelo de ajuste inducido permite pequeños cambios en la forma o geometría del sitio activo de una enzima para acomodar un sustrato. Una buena analogía son los cambios que ocurren en la forma de un guante cuando se inserta una mano en él. El ajuste inducido es el resultado de la flexibilidad de la enzima, ya que se adapta para aceptar el sustrato entrante. Este modelo es una explicación más exhaustiva de las propiedades del sitio activo de una enzima porque incluye la especificidad del modelo de cerradura y llave junto con la flexibilidad del carácter proteico de la enzima. La siguiente figura ilustra el concepto:
Las fuerzas que atraen el sustrato al sitio activo son muchas de las mismas fuerzas que mantienen la estructura terciaria en el plegamiento de las cadenas peptídicas. Las interacciones electrostáticas, los enlaces de hidrógeno y las interacciones hidrofóbicas ayudan a atraer y unir moléculas de sustrato. Por ejemplo, un grupo amino cargado positivamente (NH3+) en un sustrato podría ser atraído y retenido en el sitio activo por un residuo de aspartato o glutamato cargado negativamente. Además, algunos iones metálicos con carga positiva a menudo ayudan a unir las moléculas del sustrato.
2.1. Energía de fijación y energía de activación
![]()
La energía requerida para disminuir la energía de activación proviene generalmente de interacciones débiles no covalentes entre el sustrato y la enzima, las mismas interacciones que estabilizan la estructura de la proteína (enlaces de hidrógeno, interacciones iónicas, hidrofóbicas y de van der Waals).
La formación de cada interacción débil en el complejo ES (enzima-sustrato) viene acompañada de una pequeña liberación de energía libre que proporciona estabilidad a la interacción.
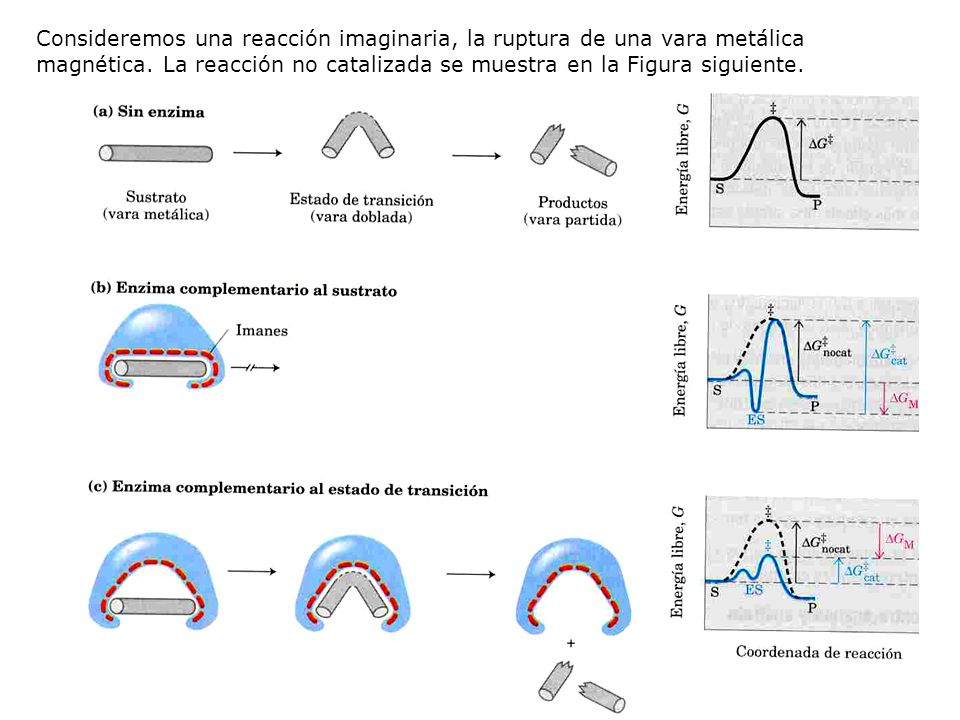
La energía proveniente de la interacción enzima-sustrato se llama energía de fijación y es la fuente usada para disminuir la energía de activación.
![]()
Si la enzima fuera perfectamente complementaria al sustrato, se impediría la reacción ya que el sustrato se estabilizaría tanto que sería muy difícil salir de allí. Tal enzima no tendría ninguna utilidad.
Una enzima ha de ser complementaria al estado de transición de la reacción. Esto significa que las interacciones óptimas (mediante enlaces débiles o también llamados enlaces de baja energía) entre enzima y sustrato solo pueden tener lugar en el estado de transición.
3. Factores que afectan la actividad enzimática
![]()
La actividad de una enzima describe qué tan rápido esta cataliza la reacción que convierte un sustrato en producto. Esta actividad depende en gran medida de las condiciones de la reacción, que incluyen temperatura, pH, concentración de la enzima y concentración del sustrato.
![]()
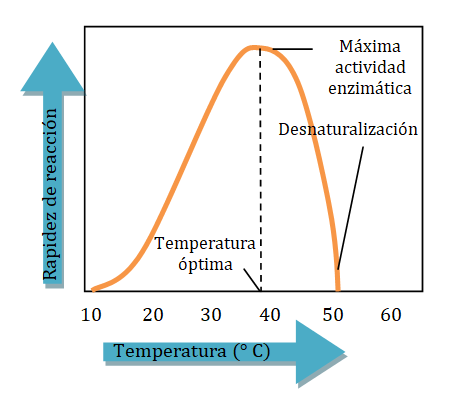
Las enzimas son muy sensibles a los cambios de temperatura. A bajas temperaturas, la mayor parte de las enzimas muestra poca actividad porque no hay suficiente cantidad de energía para que tenga lugar la reacción catalizada. A temperaturas más altas, la actividad enzimática aumenta a medida que las moléculas reactantes se mueven más rápido para generar más colisiones con las enzimas. La mayoría de las enzimas humanas son más activas a temperatura óptima, que es de 37 °C, o temperatura corporal. A temperaturas superiores a 50 °C, la estructura terciaria, y por ende la forma de la mayor parte de las proteínas, se destruye, lo que causa una pérdida de actividad enzimática. Por esta razón, el equipo en los hospitales y laboratorios se esteriliza en autoclaves donde las temperaturas altas desnaturalizan las enzimas que existen en las bacterias dañinas. Una fiebre corporal alta puede ayudar a desnaturalizar las enzimas existentes en las bacterias que causan la infección.
Ciertos microorganismos, conocidos como termófilos, viven en ambientes donde las temperaturas varían de 50 °C a 120 °C. Para poder sobrevivir en estas condiciones extremas, los termófilos deben tener enzimas con estructuras terciarias que no se destruyen por dichas temperaturas. Algunas investigaciones demuestran que sus enzimas son muy similares a las enzimas ordinarias, excepto que contienen más arginina y tirosina. Estos leves cambios permiten a las enzimas de los termófilos formar más enlaces de hidrógeno y puentes salinos que estabilizan sus estructuras terciarias a altas temperaturas, y resisten el desdoblamiento y la pérdida de actividad enzimática.
![]()
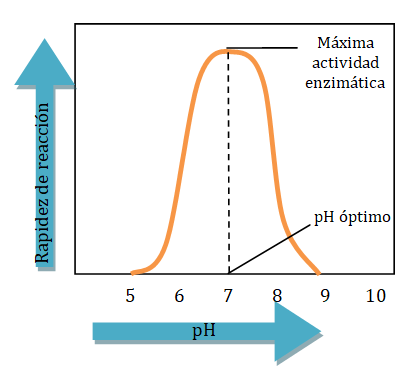
Las enzimas son más activas a su pH óptimo, el pH que mantiene la estructura terciaria adecuada de la proteína. Si un valor de pH está arriba o abajo del pH óptimo, se alteran las interacciones de los grupos R, lo que destruye la estructura terciaria y el sitio activo. Como resultado, la enzima ya no puede unirse a un sustrato de manera adecuada y no ocurren reacciones. Si se revierte un pequeño cambio en el pH, una enzima puede recuperar su estructura y actividad. Sin embargo, grandes variaciones respecto del pH óptimo destruyen de manera permanente la estructura de la enzima.
Las enzimas en la mayor parte de las células humanas tienen valores de pH óptimos a un pH fisiológico de más o menos 7,4. Sin embargo, las enzimas en el estómago tienen un pH óptimo bajo porque hidrolizan las proteínas en el medio ácido del estómago. Por ejemplo, la pepsina, una enzima digestiva que se encuentra en el estómago, tiene un pH óptimo de 1,5 - 2,0. Entre comidas, el pH en el estómago es de 4 o 5, y la pepsina muestra poca o ninguna actividad digestiva. Cuando el alimento entra al estómago, la secreción de ácido clorhídrico (HCl) baja el pH a aproximadamente 2, lo que activa la pepsina.
![]()
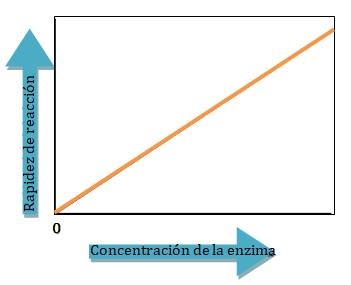
En cualquier reacción catalizada, el sustrato debe unirse primero con la enzima para formar el complejo enzima-sustrato. Para una concentración de sustrato particular, un aumento en la concentración enzimática aumenta la rapidez de la reacción catalizada. A concentraciones enzimáticas más altas, más moléculas están disponibles para unirse al sustrato y catalizar la reacción. Mientras la concentración de sustrato sea mayor que la concentración de la enzima, hay una relación directa entre la concentración de la enzima y la actividad enzimática. En muchas reacciones catalizadas por enzimas, la concentración del sustrato es mucho mayor que la concentración de la enzima.
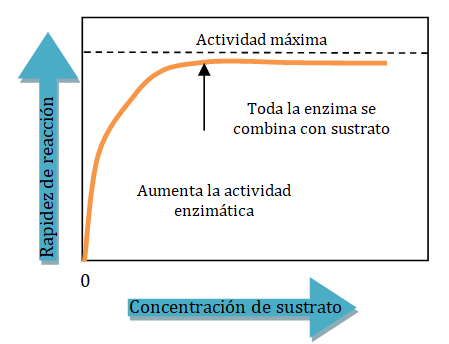
Cuando la concentración de enzima se mantiene constante, la adición de más sustrato aumentará la rapidez de la reacción. Si la concentración del sustrato es alta, puede saturar todas las moléculas de la enzima. Entonces la rapidez de la reacción alcanza su máximo y la adición de más sustrato no aumenta más la rapidez de la reacción.
3.1. Orden de reacción
![]()

![]()
Las reacciones químicas pueden clasificarse según el orden global de reacción.
Tenemos de este modo, reacciones de orden global cero, de primer orden, de segundo orden, de tercer orden, según como resulte influida la rapidez de reacción por la concentración de los reactivos bajo un conjunto de condiciones determinada.
La siguiente tabla resume información al respecto de cada orden global:
Orden global de reacción | Descripción | Ejemplo | Ecuación | Unidad de k |
| La rapidez no depende de la concentración del reactivo. | A → P | r = k | mol/L.s |
| La rapidez es directamente proporcional a la concentración de uno de los reactivos. | A → P | r = k . [A] | 1/s o s-1 |
| La rapidez es proporcional al producto de la concentración de dos reactivos o a la segunda potencia de uno de los reactivos. | A + B → P o A → P | r = k . [A] . [B] r = k . [A]2 | L/mol.s |
| La rapidez es proporcional al producto de la concentración de tres términos de concentración. | A + B + C → P | r = k . [A] . [B] . [C] | L2/mol2.s |
Repasa estos conceptos en el siguiente enlace.
3.2. Cinética de las reacciones catalizadas por enzimas
![]()
Las reacciones sin catalizar tienden a ser lentas. Y muchas reacciones comunes suponen situaciones químicas que son desfavorables o poco probables en el ambiente celular. Una enzima soluciona estos problemas al proporcionar un ambiente dentro del cual una reacción determinada es, energéticamente, más favorable.
El sitio activo es un lugar donde la molécula (sustrato) se fija formándose el complejo enzima-sustrato.
![]()
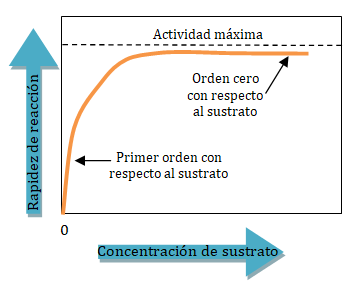
A una concentración de sustrato baja, la rapidez inicial de la reacción es casi proporcional a la concentración del sustrato y la reacción, por tanto, es aproximadamente de primer orden con respecto al mismo. Sin embargo, a medida que la concentración de sustrato aumenta, la rapidez inicial de la reacción disminuye y deja de ser aproximadamente proporcional a la concentración de sustrato; en esta zona el orden de la reacción es mixto. Con un aumento posterior de la concentración del sustrato, la rapidez de la reacción llega a ser esencialmente independiente de la concentración de sustrato, en este intervalo de concentraciones de sustrato la reacción es de orden cero con respecto al sustrato, y se dice que la enzima se halla saturada con su sustrato.
4. Ejemplos de procesos que utilizan enzimas
Elaboración de queso:
El cuajo, que dese 1879 se obtiene como preparación enzimática relativamente pura, del cuajar de las terneras jóvenes, está formado por la mezcla de 2 enzimas digestivas (quimiosina y pepsina). Estas enzimas rompen la caseína de la leche y producen su coagulación.

Elaboración de pan:
Los aditivos naturales que se le agregan al pan le confieren mayor elasticidad y mejor aspecto. En particular se utiliza la lipoxidasas, simultáneamente como blanqueador de harina y para mejorar el amasado. A veces, se emplean también proteasas para romper la estructura del gluten y para mejorar la plasticidad de la masa.

Cerveza y malta
A principios del siglo XX, en 1911, se patentó el uso de la papaína proveniente de la papaya, un fruto tropical, para fragmentar las proteínas presentes en la cerveza y evitar que esta se enturbie durante el almacenamiento o refrigeración, y este método todavía se sigue utilizando. Además, la rotura del almidón para formar glúcidos sencillos en la fabricación de la cerveza la realizan las amilasas presentes en la malta.

5. Créditos
Autoría de los materiales utilizados: Profesores Anarella Gatto y Marcelo Gurin.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Atkins. P. y Jones, L. (2005). Principios de Química. (Tercera edición). Editorial Panamericana.
- Bettelheim, F. (2010). Introduction to organic and biochemistry. Belmont, CA: Brooks/Cole, Cengage Learning.
- Brown, T., LeMay, H., Bursten, B. y Burdge, J. (2004). Química: la ciencia central. México: Pearson Educación.
- Chang, R. (2007). Química. (Novena edición). Mc Graw Hill.
- Koppmann, M. (2011). Manual de Gastronomía Molecular. (Segunda Edición). Buenos Aires, Argentina: Siglo Veintiuno.
- Masterton, W. y Hurley, C. (2004). Principios y reacciones. (Cuarta edición). Madrid, España: Thomson.
- Nelson, D. y Cox, M. (2005). Lehninger Principios de Bioquímica. (Cuarta edición). Omega.
- Stoker, H. (2010). General, organic, and biological chemistry. Belmont, USA: Brooks/Cole Cengage Learning.
- Timberlake, K. (2013). Química general, orgánica y biológica: estructuras de la vida. México: Pearson Educación.
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (Quinta edición). Madrid, España: Mc Graw Hill.
- Yurkanis Bruice, P. (2008). Química orgánica. México: Pearson Educación.
RCSBProteinDataBank . (2017, 20 de abril). Cómo actúan las enzimas. [Video]. Youtube. https://www.youtube.com/watch?v=yk14dOOvwMk
- Enzima. https://images.nigms.nih.gov/PublicAssets/3326/EScott_CYP17A1_abiraterone.jpg
- Cofactor. https://commons.wikimedia.org/wiki/File:OSC_Microbio_08_01_ApoHolo.jpg
- Sitio activo. https://commons.wikimedia.org/wiki/File:BMP_Bound_to_the_Active_Site_of_OMP_Carboxylase_from_M_thermoautotrophicum.png
- Gráfica niveles de energía en una catálisis enzimática. https://commons.wikimedia.org/wiki/File:Enzyme_catalysis_energy_levels_2.svg
- Modelo del encaje inducido. https://es.wikipedia.org/wiki/Enzima#/media/Archivo:Induced_fit_diagram_es.svg
- Modelo llave cerradura. https://es.wikipedia.org/wiki/Archivo:Complejo_enzima-sustrato_(llave-cerradura).jpg
- Enzima complementaria al estado de transición: http://images.slideplayer.es/13/3992772/slides/slide_35.jpg
- Queso. https://pixabay.com/es/photos/queso-leche-alimentos-los-l%C3%A1cteos-5179968/
- Pan. https://pixabay.com/es/photos/pan-rohlik-pasteler%C3%ADa-merienda-4695110/
- Cerveza. https://pixabay.com/es/illustrations/cerveza-beber-taza-6081223/
- Número 0. Autor: Freepik. Licencia: Gratis para uso personal o comercial con atribución.
- Número 1. Autor: Freepik. Licencia: Gratis para uso personal o comercial con atribución.
- Número 2. Autor: Freepik. Licencia: Gratis para uso personal o comercial con atribución.
- Número 3. Autor: Freepik. Licencia: Gratis para uso personal o comercial con atribución.



