¿Qué características presentan los sólidos, líquidos y gases?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 2º B.D. |
| Libro: | ¿Qué características presentan los sólidos, líquidos y gases? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:52 |
Tabla de contenidos
1. ¿Qué sabemos sobre los estados de agregación de la materia?
Observa la siguiente imagen y realiza una lista de las características macroscópicas (que se ven a simple vista) de cada uno de los sistemas estudiados.

1.1. Estados de agregación de la materia
![]()
Podemos definir a la materia como el constituyente de todos los cuerpos del Universo.
Todos los objetos que nos rodean se presentan en distintos estados de agregación, siendo los tres fundamentales:
- sólido.
- líquido.
- gaseoso.
![]()
Podemos mencionar al plasma como un cuarto estado de agregación de la materia, o considerarlo como una forma especial del estado gaseoso que en determinadas condiciones adquiere propiedades electromagnéticas. Este estado está presente en el sol y demás estrellas, en las lámparas de bajo consumo, en el aire cercano a los rayos en una tormenta eléctrica, en las auroras polares, en los televisores o monitores con pantalla de plasma o en una bola de plasma (como se puede ver en la siguiente imagen).

![]()
El Condensado Bose-Einstein (BEC) puede ser considerado como el quinto estado de la materia. Se logra este “condensado” enfriando ciertos materiales a temperaturas muy próximas al cero absoluto (- 273 ºC). El siguiente video te puede ayudar a conocer más sobre este quinto estado de la materia:
Además, existen mezclas de los estados de agregación fundamentales (gelatinas, cremas, merengues, pastas, etc.). El merengue, por ejemplo, se obtiene batiendo clara de huevo; mediante agitación se incorporan burbujas de aire quedando con la consistencia "espumosa" característica.
1.2. Características macroscópicas de los estados de agregación más comunes
![]()
Las características macroscópicas son aquellas que se pueden ver a simple vista, en contraposición a las microscópicas que requieren instrumentos para verlas o detectarlas.
Para ordenar lo que sabemos sobre la materia podemos identificar propiedades comunes a cada estado de agregación.
Completa la siguiente tabla con las características macroscópicas de cada uno de los principales estados de agregación de la materia:
| Características macroscópicas | Sólido | Líquido | Gaseoso |
|---|---|---|---|
| Forma | |||
| Volumen | |||
| Compresibilidad* | |||
| Dilatación térmica** |
* Compresibilidad: es una propiedad de la materia que compara la disminución del volumen al someter a un sistema a una presión o compresión determinada, manteniendo constantes otros parámetros.
** Dilatación térmica: la dilatación es el aumento de volumen que experimenta un material. Cuando está asociada a un cambio de temperatura se denomina dilatación térmica.
1.3. En resumen
![]()
Compara la tabla que completaste en el apartado anterior con la siguiente tabla:
| Características macroscópicas | Sólido | Líquido | Gaseoso |
|---|---|---|---|
| Forma | Tiene forma propia. | No tiene forma propia, adopta la forma del recipiente que lo contiene. | No tiene forma definida. Toma la forma del recipiente en el que se encuentra. |
| Volumen | Tiene volumen propio. | Tiene volumen definido. | No tiene volumen definido. Ocupa todo el volumen disponible del recipiente donde está contenido. |
| Compresibilidad | Prácticamente no se puede comprimir. | Se comprime más que un sólido. | Es muy compresible. |
| Dilatación térmica | Se dilatan muy poco. | Tienen mayor dilatación que un sólido. | Se dilata mucho más que un sólido y que un líquido. |
2. Interpretación de los estados de agregación utilizando el modelo cinético-corpuscular
![]()
Los estados de la materia se pueden caracterizar según el grado de agrupación de las partículas. Por esta razón, se les suele denominar estados de agregación de la materia, haciendo referencia a cuán "disgregadas" o "agregadas" se piensa que se encuentran las partículas en cada uno de ellos.
El término agregación significa "agrupación de partes formando un todo".
![]()
1. ¿Cómo imaginas cada estado de agregación a nivel corpuscular (de partículas)?
|
SÓLIDOS |
LÍQUIDOS |
GASES |
|
|
2. Luego de discutir tus representaciones con un compañero observa las siguientes animaciones:
En todos los casos debes darle play y luego zoom in.
3. ¿Cambia lo que contestaste en la pregunta 1?
En el siguiente recurso puedes comparar los tres estados de agregación.
2.1. Modelo cinético-corpuscular
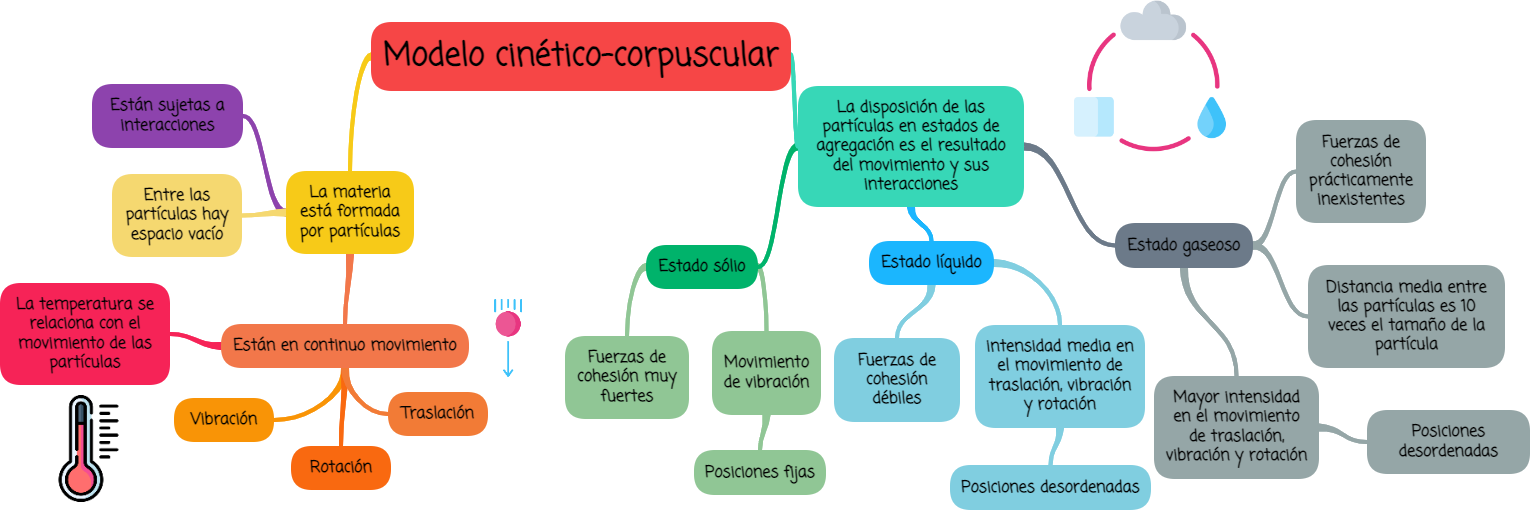
- Toda la materia está formada por partículas y entre ellas el espacio está vacío, es decir, entre ellas no hay nada. Son tan pequeñas que no pueden verse con el microscopio más potente. Son distintas para cada sustancia, diferenciándose en masa y volumen.
- Las partículas están en continuo movimiento intrínseco, llamado agitación térmica. Puede ser de traslación, rotación y vibración. El movimiento tiende a desordenar las partículas y es responsable de la disgregación de la materia. Es decir, cuanto mayor es el movimiento de las partículas su desorden es mayor.
- La temperatura está relacionada con el movimiento intrínseco de las partículas. Cuanto mayor es la temperatura mayor es el movimiento de las partículas.
- Las partículas están sujetas a interacciones o fuerzas de cohesión con otras. Pueden ser fuertes, débiles y extremadamente débiles, prácticamente inexistentes. Las fuerzas de cohesión tienden a ordenar las partículas en determinadas posiciones. Es decir, cuanto mayor son las fuerzas entre las partículas el orden de estas es mayor.
- La disposición de las partículas en sólidos, líquidos y gases es el resultado de su movimiento y de las interacciones.
- El movimiento de las partículas en los gases (movimiento de traslación, rotación y vibración) es de mayor intensidad que en los líquidos (traslación, rotación y vibración) y mucho menor en los sólidos (sólo vibración).
- Las fuerzas de cohesión en los sólidos son fuertes, mucho mayores que en los líquidos, que son débiles, y prácticamente inexistentes en los gases.
- En el caso de los gases las partículas están bastante alejadas en comparación con su tamaño. La distancia media aproximada entre partículas, en condiciones normales, es diez veces el tamaño de la partícula. En el caso de líquidos y sólidos la distancia entre partículas es similar y mucho menor que en los gases, aproximadamente igual de grande que el tamaño de una partícula.
- En los gases las partículas no ocupan posiciones fijas, están desordenadas y se mueven al azar vibrando, rotando y trasladándose en todas direcciones. En los líquidos las partículas tampoco ocupan posiciones fijas, están desordenadas, aunque menos que los gases, y se mueven al azar, igual que en los gases, pero con menor intensidad. En los sólidos las partículas ocupan posiciones fijas, están ordenadas y no tienen movimiento de traslación ni rotación, sólo vibración.
2.2. Estado sólido
![]()
Para poder explicar que los sólidos tienen una forma determinada y un volumen propio aplicando el modelo cinético-corpuscular, es posible pensar que sus partículas están muy juntas y por lo tanto el espacio vacío entre ellas debe ser mínimo.
Considerando entonces que no existe prácticamente espacio entre las partículas, estas deben estar ubicadas en posiciones fijas y el único movimiento posible sería el de vibración en el lugar. Si las partículas que constituyen los sólidos se mantienen muy juntas y sin posibilidad de movimiento de traslación, debe ser por la existencia de fuerzas de atracción intensas entre ellas.
Todo lo anteriormente afirmado permite explicar por qué los sólidos prácticamente no pueden comprimirse.
![]()
![]()
¿Qué ocurre a nivel macroscópico al aumentar la temperatura de un sistema sólido?
Observa el video 1:
Observa el video 2. Selecciona el recurso Heating and cooling a metal ball (aumentando y disminuyendo la temperatura de una bola metálica).
![]()
¿Qué ocurre con las partículas que forman a un sólido al aumentar la temperatura del sistema?
Observa la siguiente animación. Haz clic en play y luego mueve el cursor aumentando la temperatura (cold - baja la temperatura y heat - aumenta la temperatura).
Si el sólido aumenta su temperatura, aumentará la energía de sus partículas y por lo tanto vibrarán más en su lugar, lo que nos permite explicar por qué al aumentar la temperatura se da la dilatación en los sólidos.
2.3. Estado líquido
![]()
Aplicando el modelo cinético-corpuscular, se puede explicar que los líquidos adoptan la forma del recipiente que los contiene si se piensa que las partículas no ocupan posiciones fijas sino que se mueven, acomodándose de distintas maneras.
Este desplazamiento de las partículas es posible si consideramos que las fuerzas de atracción entre ellas son de intensidad menor a las que existen entre las partículas en el estado sólido.
Las partículas se encuentran ordenadas en pequeños grupos o clústers, los cuales son diferentes y cambiantes.
![]()
![]()
Observa el siguiente video a partir del minuto 2:45.
![]()
Si el líquido aumenta su temperatura aumenta la energía de sus partículas, y en consecuencia la agitación de las mismas, aumentando los movimientos de traslación.
El modelo permite explicar que la dilatación en los líquidos es mayor que en el estado sólido frente a la misma variación de temperatura. Esta es la propiedad termométrica que se utiliza para la construcción de termómetros de líquido.
Observa la siguiente animación. Haz clic en play y luego en cold (baja temperatura), room temperature (temperatura ambiente) y hot (alta temperatura).
2.4. Estado gaseoso
![]()
Los cuerpos gaseosos ocupan todo el espacio disponible, por lo tanto es posible pensar que sus partículas deben estar muy separadas, por lo que el espacio vacío será enorme.
Fácilmente se puede deducir que las atracciones entre las partículas deben ser mínimas y que estas estarán en continuo movimiento, al azar y de manera desordenada.
![]()
![]()
Observa el siguiente video en el que se compara la compresibilidad de los sólidos, líquidos y gases:
![]()
Si se aplica presión a un cuerpo gaseoso su volumen disminuye considerablemente. Usando el modelo es posible explicar este hecho suponiendo que las distancias entre las partículas se reducen.
![]()
¿Qué ocurre con una pompa de jabón en la parte superior de una botella vacía (que contiene únicamente aire) si la colocamos en un baño de hielo o en un baño María?
Observa la siguiente animación. Haz clic en play.
Por otra parte, los cuerpos en estado gaseoso tienen a expandirse al aumentar la temperatura. Se puede decir que aumenta la energía cinética de las partículas, que tienden a alejarse aún más.
Observa la siguiente animación. Haz clic en play y luego mueve el cursor aumentando la temperatura (cold - baja la temperatura y heat - aumenta la temperatura).
3. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Portal Uruguay Educa - Junio 2021.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Referencias bibliográficas:
- American Chemical Society. (2021). Chapter 1: Matter- Solids, liquids and gases. Middle School Chemistry. ACS. http://www.middleschoolchemistry.com/lessonplans/chapter1.
- Compresibilidad. (3 de mayo de 2021). En Wikipedia. https://es.wikipedia.org/w/index.php?title=Compresibilidad&oldid=135269491
- Sánchez, G. (2016). Los estados de agregación de la materia. Una propuesta de enseñanza para 3° de la ESO basada en analogías. Región de Murcia Consejería de Educación y Universidades. http://www.carm.es/web/pagina?IDCONTENIDO=15558&IDTIPO=246&RASTRO=c$m4330
- Saravia, G; Segurola, B; Franco, M. y Nassi, M. (2010). Todo se transforma. Química- 3º Año CB. Montevideo, Uruguay: Contexto.
- Segurola, B; Saravia, G; Szwarcfiter, M; Amoedo, A. y Uzal, C. (2010). Ciencias Físicas 2. Montevideo, Uruguay: Contexto.
Videos y sitios:
Date un Vlog . (2020, 12 de junio). Se consigue CONDENSADO BOSE-EINSTEIN en el espacio [Archivo de Video]. Youtube. https://youtu.be/qU-N783ES9Q- ThinkTac. (2019, 15 de octubre). Matter - Compressibility | ThinkTac [Archivo de Video]. Youtube. https://youtu.be/zlT70pjwNaM
- funlearners. (2016, 25 de mayo). expansion and contraction of liquid and gas [Archivo de Video]. Youtube. https://youtu.be/haYFkkWI7dQ
- Animaciones: American Chemical Society. (2021). Chapter 1: Matter- Solids, liquids and gases. Multimedia. Middle School Chemistry. ACS. https://www.middleschoolchemistry.com/multimedia/
Imágenes:
- Anillos. Autor: Pxhere. Licencia: CC0 Public Domain.
- Agua. Autor: tghurd. Licencia: Gratis para usos comerciales. No es necesario reconocimiento.
- Tubo de ensayo y óxidos de nitrógeno. Autor: Estudiante de Bachillerato de Química Industrial. Licencia: CC BY-SA 4.0.
- Una lámpara de plasma. Autor: Luc Viatour. Licencia: CC BY-SA 3.0.
- Íconos de Flaticon:
