¿Qué factores y variables modifican la rapidez de una reacción química?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué factores y variables modifican la rapidez de una reacción química? |
| Imprimido por: | Invitado |
| Día: | jueves, 3 de abril de 2025, 23:59 |
Tabla de contenidos
1. Introducción
![]()
Cualquier reacción química se produce mediante choques o colisiones entre las partículas de reactivo. Para que se forme una nueva sustancia, los enlaces que mantienen unidas a las partículas que reaccionan primero deben romperse, para posteriormente originar nuevos enlaces, formándose nuevos compuestos como productos de reacción.
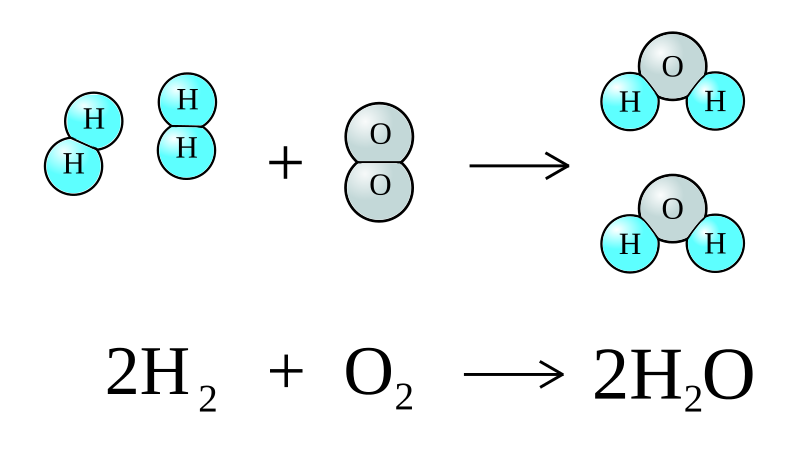
Así, por ejemplo, si tenemos la reacción:
2 H2 (g) + O2 (g) → 2 H2O (g)
Los enlaces de las moléculas de H2 y de O2 deben primero romperse, para que los átomos de
hidrógeno puedan combinarse con los de oxígeno. Pero para ello es necesario que los choques
entre moléculas se produzcan con un mínimo de energía y una buena
orientación. A continuación profundizaremos en estos dos aspectos.
2. Teoría de las colisiones
![]()
Cualquier partícula en movimiento posee energía cinética. Es posible que, al chocar, algunas partículas rompan sus enlaces y esta ruptura ocasione la formación de productos. A mayor concentración se producirá un mayor número de choques o colisiones pero esto no garantiza la reacción pues no todos son eficaces.
Una colisión es eficaz cuando:
- las partículas chocan con la energía suficiente para romper las uniones entre los reactivos y formar los productos.
- la posición de las partículas es la adecuada, es decir que se orientan en el espacio de manera apropiada.
Observa el siguiente video:
Esta teoría fue propuesta por Max Trautz en Alemania (1916) y William C. Mc Lewis en Inglaterra (1918) de forma independiente debido a la falta de comunicaciones existente por la primera guerra mundial. Encontraron que la rapidez de una reacción bimolecular (en la que participan dos moléculas) viene dada por el producto del número de colisiones de las partículas reaccionantes por unidad de tiempo y por la fracción de estas colisiones que poseen una energía igual o superior a un valor mínimo de energía.
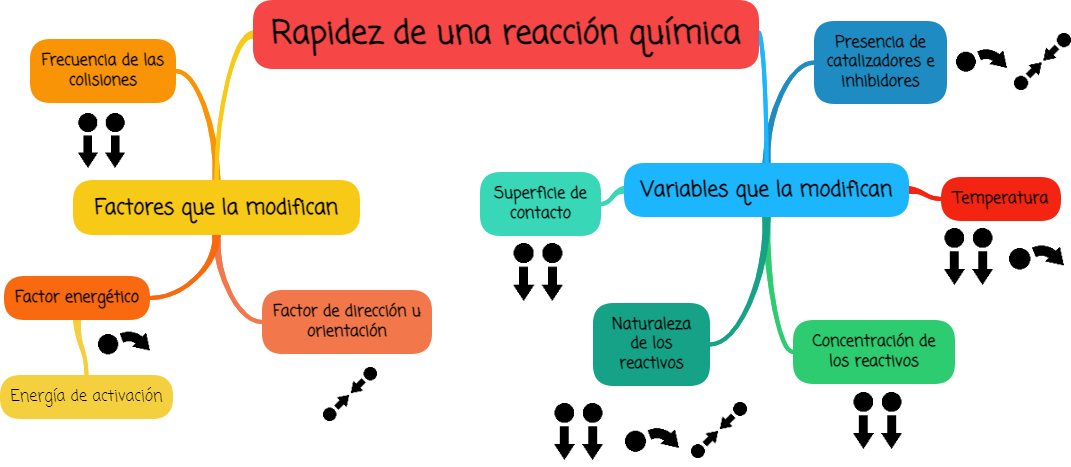
3. Factores que afectan la rapidez de una reacción química
![]()
Como venimos analizando la rapidez de una reacción se puede expresar como el
producto de tres factores:
- frecuencia de las colisiones,
- factor energético y
- factor de dirección u orientación apropiada.
![]()
Es el número de colisiones que ocurren por unidad de tiempo. Depende de:
➔ Cuán aglomeradas están las partículas (se relaciona con la concentración o la presión en el caso de los sistemas gaseosos).➔ Cuán rápidamente se mueven las partículas.
➔ Cuán grandes son las partículas, ya que por lo general las partículas más grandes, también tienen mayor masa y se mueven más lento.
➔ Qué cantidad de partículas pueden interactuar.
![]()
Es la fracción de colisiones suficientemente energéticas. El factor energético es el más importante en determinar la rapidez de reacción. Depende de:
➔ La energía de activación (es
característica de cada reacción).
➔ La temperatura (se puede controlar).
![]()
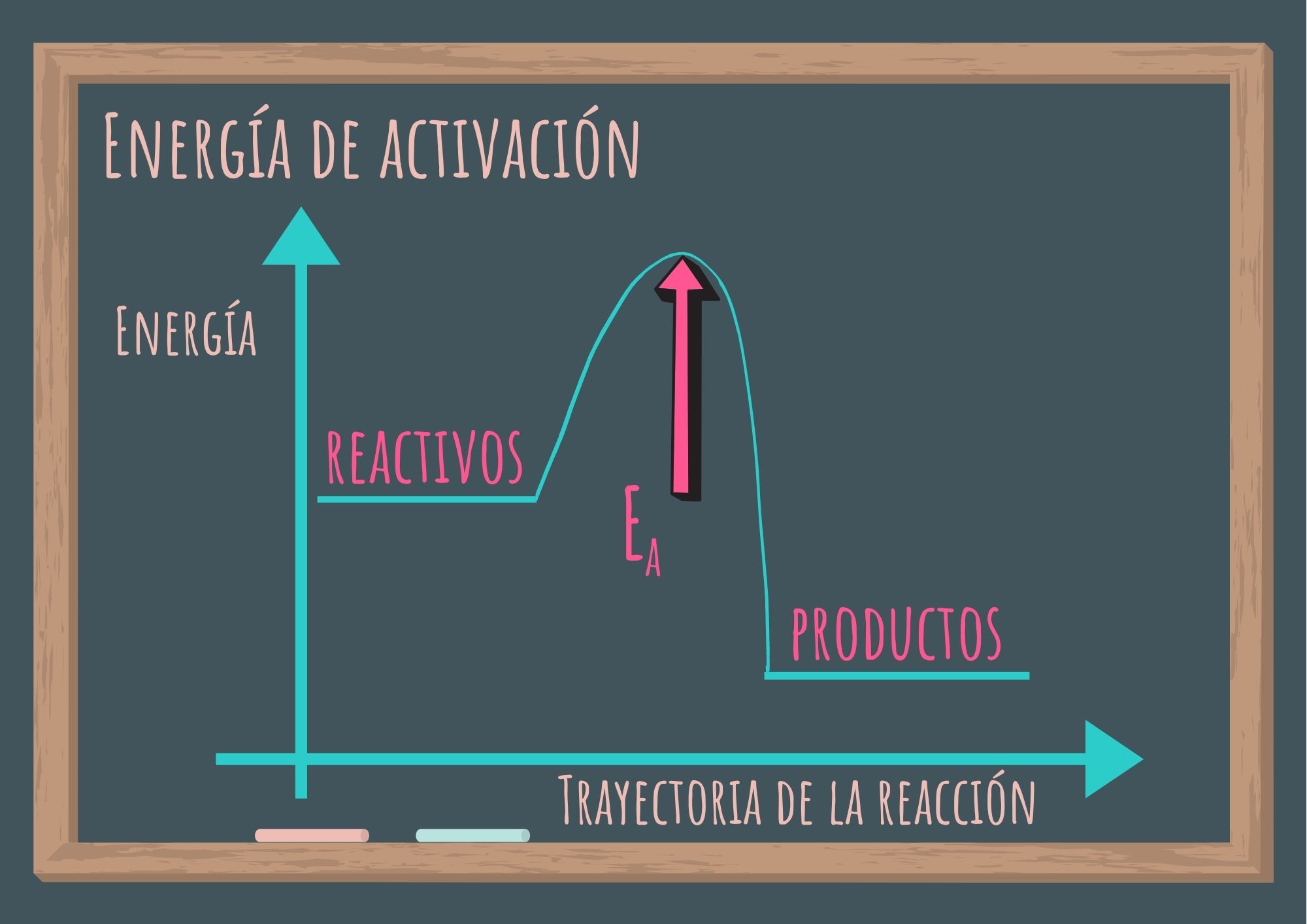
Es la energía mínima que se le debe dar a una colisión para que produzca una reacción química. Esta energía es característica de cada reacción. Se representa como Ea.
Una fuente para alcanzar la energía de activación proviene de la energía cinética de las partículas en movimiento. Las partículas que chocan deben tener una energía cinética total, igual o mayor que la energía de activación. Cuanto mayor sea la Ea menor es la fracción de colisiones que tienen esa energía.
![]()
Expresa la probabilidad de que una colisión tenga la orientación adecuada. Depende de:
➔ La geometría de las partículas.
➔ La dirección del choque.
➔ El tipo de reacción que se está realizando.
4. Variables que afectan la rapidez de una reacción química
![]()
Existen cinco variables que influyen en la rapidez de una reacción:
- Naturaleza de los reactivos
- Superficie de contacto
- Concentración de los reactivos
- Temperatura
- Uso de catalizadores

4.1. Naturaleza de los reactivos
![]()
 | Imagina que tienes tres tubos de ensayo. El tubo uno contiene 10,0 mL de agua (H2O), el tubo dos 10,0 mL de metanol (CH3OH) y el tubo tres 10,0 mL de dimetil éter (CH3OCH3). Agregas a cada uno de los tres tubos la misma cantidad de un antiácido efervescente formado por hidrógenocarbonato de sodio (NaHCO3), carbonato de sodio (Na2CO3) y ácido cítrico (C6H8O7). ¿Qué ocurrirá en cada tubo? ¿Cómo lo explicas? |
|---|
![]()
No todas las reacciones se llevan a cabo a la misma rapidez. Esta diferencia puede atribuirse a las características estructurales de las partículas que reaccionan.
![]()
Los estados de agregación de las sustancias reaccionantes son importantes en la determinación de sus reactividades. Un charco de gasolina líquida puede arder suavemente, pero sus vapores pueden arder explosivamente. Los combustibles en fase líquida o sólida arden lentamente, en cambio, si se encuentran en fase gaseosa, su reacción es explosiva.
Observa el siguiente video:
![]()
El carbono grafito es atacado por el dioxígeno mientras que al diamante no le ocurre lo mismo.
El fósforo blanco y el fósforo rojo son formas sólidas alotrópicas distintas, de la sustancia simple formada por el elemento fósforo. El fósforo blanco se inflama cuando se expone al dioxígeno del aire, mientras que el fósforo rojo se puede guardar en recipientes abiertos durante períodos de tiempo largos.
![]()
Cuando las reacciones se encuentran en un sistema homogéneo se dan con mayor facilidad que cuando solo hay una delgada interfase.
![]()
Las identidades químicas de reactivos y productos afectan la rapidez de reacción. Las soluciones de un ácido fuerte y de una base fuerte reaccionan rápidamente cuando se mezclan porque las interacciones implican fundamentalmente atracciones electrostáticas entre iones en solución. Las reacciones que implican ruptura de enlaces covalentes son normalmente más lentas.
Por ejemplo, muestras de sulfato de potasio seco, K2SO4, y nitrato de bario seco, Ba(NO3)2, se pueden mezclar sin que ocurra una reacción apreciable durante años. Pero si se mezclan soluciones acuosas de ambos, tienen lugar una reacción rápidamente, formándose un precipitado blanco de sulfato de bario.
Ba2+ (ac) + SO42- (ac) → BaSO4 (s)
![]()
Se modifican los factores frecuencia, energético y dirección.
4.2. Superficie de contacto

 | Imagina que tienes dos tubos de ensayo, cada uno contiene 10,0 mL de ácido clorhídrico 1,0 mol/L. Al primero le agregas una granalla de zinc. Observas la reacción. Al segundo le agregas una cantidad equivalente de zinc en polvo. ¿Cuál de los dos procesos imaginas que ocurrirá más rápidamente? ¿Cómo lo explicas? |
|---|
![]()
La mayor parte de las reacciones que se estudian son homogéneas: en ellas participan gases o soluciones líquidas. Si los reactivos están en fases diferentes, como cuando uno es un gas y otro es un sólido, su área de contacto limita la reacción. Por tanto, las reacciones en las que intervienen sólidos tienden a avanzar más rápido si se aumenta el área superficial del sólido. Para lograr aumentar la superficie de contacto se puede molerlos, es decir dividirlos finamente, utilizando un mortero por ejemplo.
Observa el siguiente video:
¿Cómo se puede explicar lo observado aplicando lo propuesto en la teoría de las colisiones? Para que una reacción química ocurra es necesario que las partículas
de los reactivos involucrados choquen entre sí, ya que, en la medida
que ocurran con mayor frecuencia estos choques, aumenta la
probabilidad de que los reactivos reaccionen entre sí con mayor
rapidez. Cuanto mayor sea la superficie de contacto entre los reactivos en un sistema heterogéneo (o grado de subdivisión), mayor será la frecuencia de las colisiones y por lo tanto mayor será la rapidez de la reacción.
![]()
Se modifica el factor frecuencia de las colisiones.
4.3. Concentración de los reactivos
![]()
 | Imagina que tienes tres tubos de ensayo, cada uno contiene 10,0 mL de ácido clorhídrico de concentraciones 0,1 mol/L, 0,5 mol/L y 1,0 mol/L. A los tres tubos le agregas un trozo de cinta de magnesio de 1,00 cm. ¿Qué crees que ocurrirá? ¿Cuál piensas que tendrá mayor rapidez? ¿Cómo lo explicas? |
|---|
![]()
La ley de rapidez establece la dependencia de la rapidez de reacción con respecto a las concentraciones de los reactivos. En las reacciones de orden 1 la rapidez es directamente proporcional a la concentración del reactivo.
Casi todas las reacciones químicas se llevan a cabo con más rapidez
si se aumenta la concentración de uno o más de los reactivos.
Observa el siguiente video:
4.4. Temperatura

 | Imagina que tienes un tubo con 10,0 mL de una solución al 30 % de peróxido de hidrógeno (conocido comúnmente como agua oxigenada, H2O2). Observa el tubo. ¿Qué crees que ocurrirá al colocar el tubo en un baño de María? ¿Cómo lo explicas? |
|---|
![]()
Un aumento de temperatura aumenta la rapidez de la reacción, con independencia de que esta sea exotérmica o endotérmica. La rapidez de la reacción se suele duplicar por cada 10 ºC de aumento de temperatura.
Un ejemplo claro lo tenemos en las reacciones de degradación de los alimentos, para que el proceso sea más lento guardamos los alimentos a baja temperatura.
Observa el siguiente video:
¿Cómo se puede explicar lo observado aplicando lo propuesto en la teoría de las colisiones? El
aumento de la temperatura aumenta la energía cinética de las partículas y eso
incrementa el número de choques efectivos. Esto es así porque hay un mayor
número de partículas en condiciones de superar la barrera que corresponde a la
energía de activación (Ea). El aumento de la temperatura da como resultado una
rapidez mayor para la misma energía de activación y las mismas
concentraciones.
![]()
Se modifican los factores frecuencia y energético. Un aumento de temperatura incrementa:
- La energía cinética promedio de las partículas (factor frecuencia de colisiones) y la rapidez promedio.
- El número de partículas que adquieren la energía suficiente para alcanzar la Ea (factor energético) y la rapidez de formación del producto.
A una temperatura dada, la fracción de choques
con suficiente energía para reaccionar depende
de su Ea.
4.5. Presencia de catalizadores o inhibidores

 | Imagina que tienes un tubo con 10,0 mL de una solución al 30 % de peróxido de hidrógeno (conocido comúnmente como agua oxigenada, H2O2) y le agregas una pizca de dióxido de manganeso. ¿Qué crees que ocurrirá? ¿Cómo lo explicas? |
|---|
![]()
Un catalizador o inhibidor es una sustancia que afecta la rapidez de una reacción química
pero no participa de ella, es decir, no es parte de los reactivos. Existen dos tipos, los cuales
se detallan a continuación:
- Catalizadores: Sustancias que pueden incrementar la rapidez de una reacción. Son sustancias que disminuyen la energía de activación (Ea), es decir, disminuyen la barrera energética que deben superar las partículas de los reactivos, por lo que necesitan menos energía para poder reaccionar y transformarse en productos. En consecuencia la rapidez es mayor. Un ejemplo de catalizador son los convertidores catalíticos utilizados en la industria automotriz, los cuales hacen que la reacción que ocurre en el motor sea mucho más rápida.
- Inhibidores: Sustancias que pueden disminuir la rapidez de una reacción. Corresponden a sustancias que aumentan la energía de activación, por lo tanto, los reactivos necesitan más energía (superar una barrera más alta) para poder transformarse en productos. Lo que hace que la rapidez de reacción sea menor. Un ejemplo es el ácido cítrico presente en limones y naranjas que enlentece el proceso de oxidación o pardeamiento enzimático de los alimentos. Por eso, cuando se le agrega jugo de limón a una palta para que no se oscurezca, lo que se está haciendo es disminuir la rapidez de esta oxidación.
Observa el siguiente video:
![]()
Se modifican los factores energético y orientación.
Tienen dos formas de acción:
1. Crear una ruta alterna con una
energía de activación más baja o
más alta según corresponda.
2. Orientar efectivamente las partículas
(solamente si tiene la capacidad de
hacerlo).
4.6. En resumen
![]()
Observa el siguiente video (se encuentra en inglés, recuerda activar los subtítulos en español) que repasa los conceptos trabajados en este módulo:
5. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Portal Uruguay Educa - Junio 2021.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Bibliografía consultada:
- Alvarado, L., Valenzuela, S. y Saavedra, S. (2020). GUÍA 8: “Factores que afectan la velocidad de una rx”. Departamento de Ciencias Química - Iº medios. Colegio Santa María. La Florida. https://www.colegiostmf.cl/wp-content/uploads/2020/06/Qu%C3%ADmica-I%C2%BA-Gu%C3%ADa-8-Scarlett-Valenzuela-Lidia-Alvarado-y-Sussy-Saavedra-.pdf
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Barrera Herrera, J, (2013). ENSEÑANZA DE LOS FACTORES QUE AFECTAN LA VELOCIDAD DE REACCIÓN: UNA PROPUESTA DE AULA DESDE EL APRENDIZAJE ACTIVO. Horizontes Pedagógicos, 15 (1), 174-180. https://horizontespedagogicos.ibero.edu.co/article/view/413/378
- Bender, G., Cutrera, G. y Defago, A. (2007). CINÉTICA QUÍMICA Y ANALOGÍAS UN ANÁLISIS DE LAS PROPUESTAS DE ENSEÑANZA. Jornadas de Enseñanza e Investigación Educativa en el campo de las Ciencias Exactas y Naturales. http://jornadasceyn.fahce.unlp.edu.ar/i-jornadas-2007/i-jornadas-2007/Bender.pdf
- Castellan, G. (1998). Físicoquímica. (2da edición). México: Pearson.
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill.
- Donato, A. y Zúñiga, L. (2012). REFLEXIONES SOBRE LA ENSEÑANZA DEL CONCEPTO DE CINÉTICA QUÍMICA EN EDUCACIÓN MEDIA A PARTIR DEL MODELO DE RESOLUCIÓN DE PROBLEMAS. Pedagogía didáctica. 50. https://doi.org/10.17227/PPDQ.2012.num50.1598
- Gordon, H. (1973). Cinética Química. Barcelona, España: Reverté.
- Masterton, W. y Hurley, C. (2004). Principios y reacciones. (4ta edición). Madrid, España: Thomson.
- Ministerio de Educación de Chile. (2017). 3° Medio. Experiencias de aprendizaje. Ciencias Naturales. https://bibliotecadigital.mineduc.cl/bitstream/handle/20.500.12365/14440/C-Naturales-3%c2%ba-Medio.pdf?sequence=1&isAllowed=y
- Soto, S., Jiménez, D. y Ramírez, I. (2016). Cinética. Vicerrectoría de Docencia
CEDA - TEC Digital. https://repositoriotec.tec.ac.cr/bitstream/handle/2238/10111/Cin%C3%A9tica.pdf?sequence=1&isAllowed=y
- UAM (2011). Cinética. Fundamentos de Química. Grado en Física. http://www.qfa.uam.es/labqui/presentaciones/Tema4.pdf
- Vaquero, M. (2019). Velocidad de las reacciones químicas y temperatura. Influencia de la tempratura. http://www.deciencias.net/simulaciones/quimica/reacciones/temp.htm
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (Quinta edición). Madrid, España: Mc Graw Hill.
Vídeos, páginas y/o simuladores utilizados:
Grupo SM Chile . (2012, 21 de febrero). Teoría de las colisiones [Archivo de video]. Youtube. https://youtu.be/-RQIfEefAzg- FDC Bomberos. (2016, 7 de diciembre). La gasolina líquida no arde, sus vapores sí. #LeoTips Capítulo 04 [Archivo de video]. Youtube. https://youtu.be/L6NyRwbKuiw
Universitat Politècnica de València - UPV . (2011, 29 de noviembre). Velocidad de una reacción química: Efecto de la superfície de contacto de un reactivo | | UPV [Archivo de video]. Youtube. https://youtu.be/z2245FkSnhoUniversitat Politècnica de València - UPV . (2011, 29 de septiembre). Velocidad de una reacción química: Efecto de la concentración de un reactivo | | UPV [Archivo de video]. Youtube. https://youtu.be/_q_aKZvP3HQUniversitat Politècnica de València - UPV . (2011, 29 de noviembre). Velocidad de una reacción química: Efecto de la temperatura de reacción | | UPV [Archivo de video]. Youtube. https://youtu.be/sbkw8cgyzqcUniversitat Politècnica de València - UPV . (2011, 29 de noviembre). Velocidad de una reacción química: Efecto de la presencia de un catalizador | | UPV [Archivo de video]. Youtube. https://youtu.be/zf6mHX6429I
- Ícono pregunta. Autor: Freepik. Licencia: Gratis para uso personal o comercial con atribución.
- Partículas 1. Autor: Freepik. Licencia: Gratis para uso personal o comercial con atribución.
- Partículas 2. Autor: Freepik. Licencia: Gratis para uso personal o comercial con atribución.
- Partículas 3. Autor: Freepik. Licencia: Gratis para uso personal o comercial con atribución.
- Síntesis del agua. Autor: すじにくシチュー. Licencia: CC0 1.0.