Química - 3º B.D.
¿Qué estudia la cinética química? ¿Qué es la rapidez de una reacción?
2. ¿Cómo se calcula la rapidez de una reacción?
![]()
Se puede representar una reacción con la siguiente ecuación general:
Reactivos → Productos
Durante el transcurso de una reacción, los reactivos se transforman en productos. Es posible seguir el progreso de una reacción al medir, ya que la disminución en la concentración de los reactivos o el aumento en la concentración de productos.
Analicemos una reacción sencilla en donde las moléculas de A se convierten en moléculas de B.
A → B
La siguiente figura muestra lo que ocurre al transcurrir el tiempo.
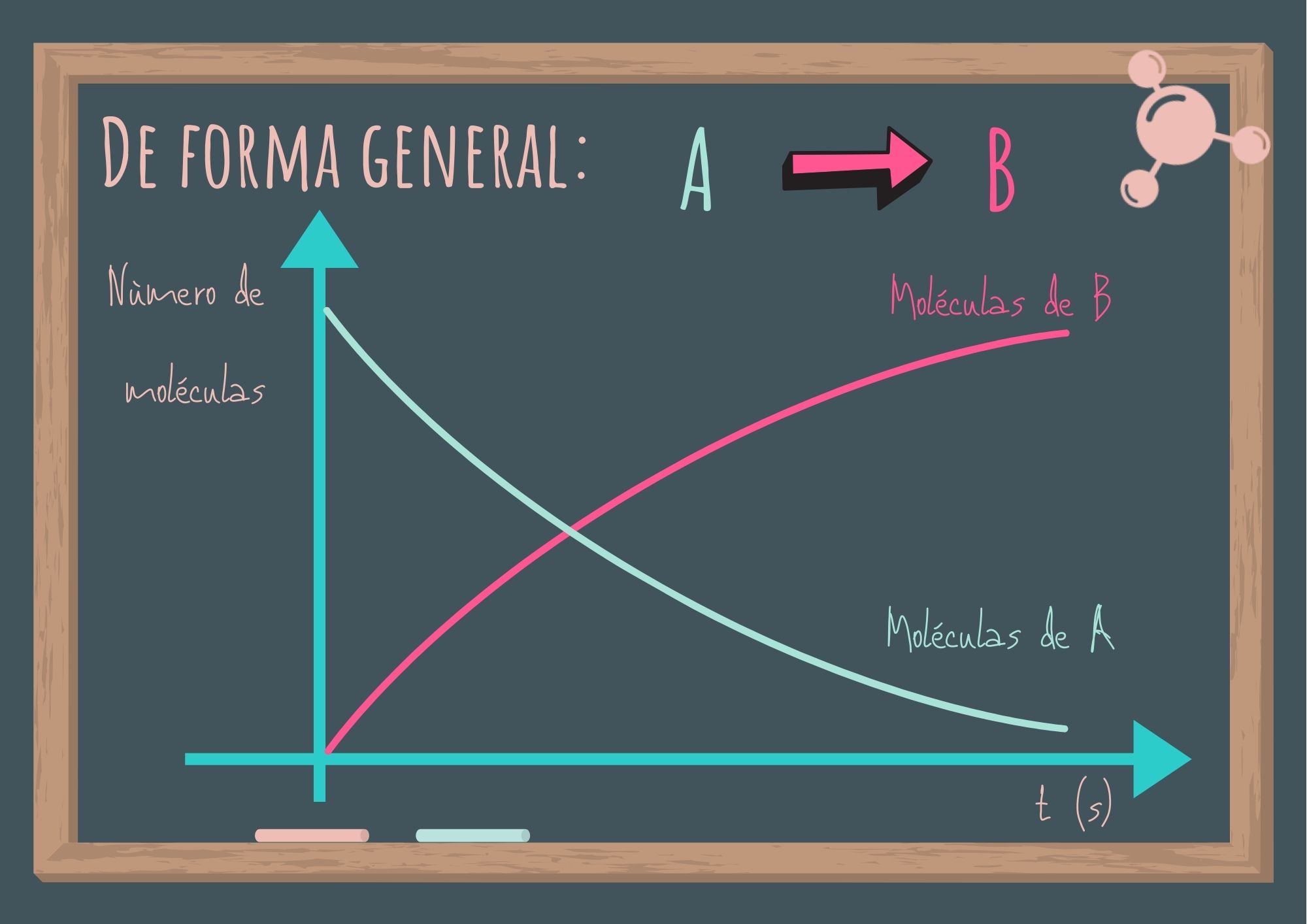
Se observa que el número de moléculas de A va disminuyendo mientras que el número de moléculas de B va aumentando. En general es más conveniente expresar la rapidez de reacción en términos del cambio en la concentración con respecto al tiempo. Para la reacción A → B, la rapidez se expresa:
r = - Δ[A] r = Δ[B]
Δt Δt
Donde Δ[A] y Δ[B] son los cambios en la concentración de A y de B respectivamente en un determinado período de tiempo (Δt).Debido a que la concentración de A disminuye durante el intervalo de tiempo, Δ[A] es una cantidad negativa. Como la rapidez de una reacción es un valor positivo (ya que describe la reacción en sentido directo, de izquierda a derecha) se utiliza el opuesto de la variación en la concentración de A, o sea - Δ[A], obteniéndose así un valor de rapidez positivo.
Esta rapidez corresponde a la rapidez promedio porque representa el promedio en un cierto intervalo de tiempo (Δt).
